小鼠脑干3β羟基类固醇脱氢酶1免疫阳性神经元信号检测方法的优化
曹晓娟,李 强,范奎奎,潘 登,刘昊东,王 昆,海日汗,杜晨光,*
(1.内蒙古农业大学 职业技术学院,内蒙古 包头014109;2.内蒙古农业大学 兽医学院,内蒙古 呼和浩特010018;3.河北省农林科学院粮油作物研究所,河北石家庄050000)
类固醇激素对生活在各种环境中的脊椎动物适应性表型的表达至关重要[1]。通常,仅通过测量循环激素水平很难发现激素合成的潜在机制,因为血液中的类固醇水平并不总是与组织中的激素水平一致;一些循环激素需要通过局部表达的类固醇代谢酶转化为更活跃的代谢物[2-3]。在这些酶中,3β羟基类固醇脱氢酶1(3β-HSD1)在类固醇生成途径中处于关键位置,在性腺和肾上腺中研究较多。证实其可将孕烯醇酮转化为黄体酮和脱氢表雄酮(DHEA),再转化为雄烯二酮,进而合成雄激素(睾酮)[4]。同时,3β-HSD1也在其它脊椎动物组织中表达,包括肝脏、心脏、主动脉、肾脏、脊髓和大脑。然而,它的功能最近才得到充分的重视。这种酶对于将孕烯醇酮转化为孕酮、DHEA转化为雄烯二酮是必不可少的,而雄烯二酮又是产生更强大的雄激素的底物,即,睾酮(T)和5a二氢睾酮,它们与雄激素受体紧密结合发挥多重生理作用。同时,类固醇激素与肥胖、肥胖引起的高血压和2型糖尿病等疾病息息相关[4-6]。
脑作为中枢神经系统的重要组成部分,其包含能量代谢、生殖、内分泌等多种调节中枢,通过下丘脑-垂体-肾上腺轴和下丘脑-垂体-性腺轴两条经典途径调节机体内分泌等诸多稳态[7]。对鸟类的研究表明,3β-HSD1在大脑中的表达和活动,影响鸟类的神经行为功能。例如在鸟类大脑中,3β-HSD1与雌激素合成芳香化酶协同作用,将DHEA转化为雌激素。这些雌激素进而激活神经雌激素受体来调节社会行为,例如以循环睾酮为基础,在非繁殖季节表现出的雌激素依赖性攻击行为[8-10]。
目前,鲜有文章报道3β-HSD1在小鼠脑内的分布情况。本实验以小鼠脑组织为检测对象,采用免疫荧光技术检测3β-HSD1在小鼠脑内的分布情况。但在预试验过程中发现常规的脑组织处理方式难以在小鼠脑组织内检测到3β-HSD1阳性荧光信号。为此,本实验拟通过采用不同的固定液预先灌注小鼠,取其脑组织经上述不同固定液固定后制作冰冻切片,封闭前预处理[1%TritonX-100+0.4%SDS穿孔、10 mmol/L柠檬酸钠抗原修复及配合使用抗体信号增强剂(ASE)降低背景]后,经免疫组化方法检测3β-HSD1在小鼠脑组织中的分布以及不同固定液对其在小鼠脑组中的阳性荧光信号检测结果的影响,以期选择最佳的固定液,优化该免疫组化方法,为进一步研究3β-HSD1在中枢神经系统内的功能,提供检测手段。
1 材料与方法
1.1 主要实验材料 C57BL/6小鼠购自北京维通利华生物科技有限公司,经自群繁育后(避免近交),获得适应现有饲养条件的6周龄~8周龄小鼠。固定液[4%多聚甲醛(4%PFA)、20%甲醇+0.2%丙酮、4%多聚甲醛+10 mmol/L柠檬酸钠]及脑组织切片通透液及封闭前预处理液[1%triton X-100、30%蔗糖、20 mM柠檬酸钠、抗体信号增强剂[9](Antibody signal enhancer,ASE,pH=7.4)]由本实验室配置。标准驴血清白蛋白购自Solarbio公司;兔源3β-HSD1单克隆抗体(MAb)、兔源GAPDH MAb、Alexa标记的驴抗兔IgG购自Abcam公司;IR800标记的山羊抗兔IgG购自Jackson公司。
1.2 小鼠脑组织处理 用于免疫组化试验的12只小鼠经3%戊巴比妥钠深度麻醉,使用灌注泵经心肺以3.5 mL/min灌注3 min生理盐水约10 mL,后将其分为3组,4只/组,分别以5 mL/min灌注3种固定液(4%多聚甲醛、20%甲醇+0.2%丙酮、4%多聚甲醛+10 mmol/L柠檬酸钠)40 min约200 mL,取各组小鼠脑组织置于相应固定液中后固定过夜,修块后转移至30%蔗糖溶液中直至完全沉降。使用冰冻切片机对脑组织冠状面连续切片,厚度为30 μm,漂片法洗涤,4℃保存,并加入叠氮化钠(NaN3)防腐。
用于western blot试验的3只小鼠经断颈迫杀,参照鼠脑立体定位图谱[8]快速将经免疫组化试验检测的有3β-HSD1荧光信号区域的脑干中缝苍白核(RPa),巨细胞网状核(GRN)及臂旁核(PB)取下并冻存于-80℃。
1.3 不同固定液对小鼠脑组织内3β-HSD1阳性信号影响的检测 先前通过文献查阅及相关试剂比例的尝试性试验,发现在免疫组化试验中,不同抗原固定方式对阳性神经元信号的清晰度及饱满度有很大的影响[7]。同时适当浓度的柠檬酸钠在石蜡切片和冰冻切片中的抗原修复中均有积极作用,但尚未有相关文章证实将柠檬酸钠融入多聚甲醛中会对神经元荧光信号的检测有积极作用,为此本实验进行了尝试。通过摸索比较,筛选出3种固定液(4%多聚甲醛、20%甲醇+0.2%丙酮、4%多聚甲醛+10 mmol/L柠檬酸钠)。
将1.2经上述不同固定液灌注小鼠所得脑组织的冰冻切片依次使用本实验室摸索的封闭前预处理方式(1%TritonX-100+0.4%SDS-4℃-4 h、10 mmol/L柠檬酸钠95℃10 min、ASE 4℃2 h)处理。3%标准驴血清蛋白室温封闭1 h,分别以兔源抗3β-HSD1 MAb(1∶200)为一抗,以Alexa647标记的驴抗兔IgG(1∶2 000)为二抗。经免疫组化检测3β-HSD1在小鼠脑组织中的分布及不同固定液对3β-HSD1阳性神经元信号及神经元形态的影响。
1.4 小鼠脑组织中3β-HSD1的western blot检测将小鼠脑组织的PB、GRN和RPa区域材料进行脑组织蛋白提取[9-10]后,经5%~12%SDS-PAGE电泳分离,转印至NC膜上,5%脱脂奶粉室温封闭1 h,分别以兔源抗3β-HSD1 MAb(1∶1 000)和兔源抗GAPDH MAb(1∶5 000)为一抗,以IR800标记的山羊抗兔IgG(1∶20 000)为二抗,经westen blot检测3β-HSD1在小鼠脑干PB、GRN及Rpa内的表达情况。
2 结果与讨论
2.1 不同固定液对小鼠脑组织3β-HSD1阳性荧光信号影响的检测结果 在使用免疫荧光技术检测3β-HSD1在小鼠脑组织中的神经元分布时,组织处理方式对于检测3β-HSD1的阳性荧光信号影响较大。从抗原的保存效率来看,组织的冰冻切片比石蜡切片可以更有效的保留抗原完整性,因此使用脑组织的冰冻切片经免疫荧光染色在科研或病理诊断的应用越来越广泛[11]。冰冻切片需经过固定、脱水、切片、通透、抗原修复、降噪、抗体孵育等多步流程,其中组织的固定、通透以及抗原修复对于免疫荧光最终染色结果影响较大,而固定的目的在于终止组织内酶的活性,避免胞体本身的解体,保持其抗原性,在此基础上将抗原固定在原位[12-13]。目前国内外较常用的固定液有适当比例的福尔马林、多聚甲醛、丙酮、甲醇等。然而在检测某些特定抗体信号时,常规的固定液对最终结果的检测影响较大[14],但目前尚未有一种标准的固定剂可以完全适用于所有的抗原固定[15]。为此需适当调整固定液内的成分以获得较优的染色结果。
本研究用到的封闭前预处理液中的Triton X-100和SDS均是一种非离子表面活性剂,在免疫荧光预处理步骤中常常被稀释至一定比例用作细胞破膜剂,使抗体能够进入细胞内与抗原结合;ASE包含50 mmol/L甘氨酸、0.05%吐温20、0.1%TritonX-100和1%BSA,经鉴定其作为抗体稀释液可以增强抗原抗体结合效率并降低背景色[4];柠檬酸钠是免疫组化试验时用到的较为常见的一种抗原修复液,将脑组织切片内加入适当比例的柠檬酸钠经加热煮沸的方式可暴露出被甲醛的醛基遮蔽的部分抗原[16]。但使用柠檬酸钠热修复组织切片后会导致染色结果背景色偏高,通过使用ASE[4]可以降低背景色。因此本研究采用的封闭前预处理方式不仅降低了免疫组化试验中的背景色,而且可以使抗原充分暴露。适宜的固定液能够获得较优的抗原保存效率,并结合后续的预处理方式使得抗原的暴露更充分,抗原的空间结构更完整。
本实验中小鼠脑组织经3种固定液灌注及固定后所得脑组织切片统一经过相同的封闭前预处理后,经免疫组化试验检测结果显示:4%多聚甲醛固定液组,小鼠脑内(前脑、脑干)未检测到3β-HSD1阳性荧光信号(图1A~图1C);20%甲醇+0.2%丙酮固定液组小鼠后脑脑干的PB、GRN及Rpa核团内均检测到3β-HSD1阳性荧光信号的分布,但阳性神经元信号形态模糊(图1D~图1F);4%多聚甲醛+10 mmol/L柠檬酸钠固定液组小鼠上述核团内检测到3β-HSD1阳性荧光信号的分布,且该阳性荧光信号清晰、神经元形态饱满圆润(图1G~图1I)。图1中D~F和G~I分别是与A~C位置相近的RPa、GRN和PB扫描结果图。
上述结果表明,4%多聚甲醛+10 mmol/L柠檬酸钠固定液灌注小鼠并辅以后续封闭前预处理方式,对检测小鼠后脑脑干内PB、GRN及Rpa核团内3β-HSD1阳性荧光信号分布的检测有积极意义。因此,对于一些未知敏感性及表达位置的组织抗原,应进行多种固定剂及预处理方式的筛选,才能得到最佳的染色效果,以免造成假阳性或假阴性结果,从而影响检测结果。
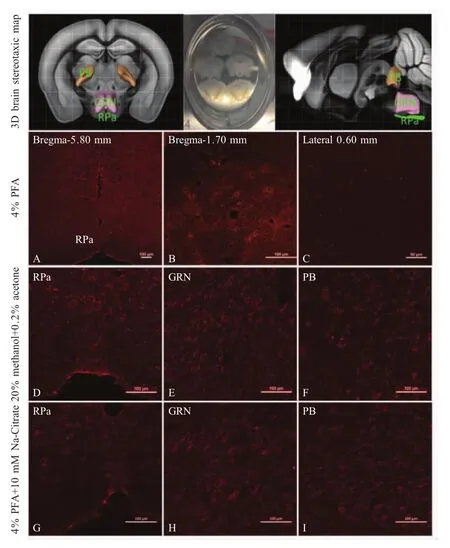
图1 不同固定液的免疫组化试验检测3β-HSD1在小鼠脑内神经元的分布检测结果Fig.1 Effects of different fixation methotls on the distribution of 3 beta-HSD1 neurons in mouse brain
2.2 小鼠脑组织中3β-HSD1蛋白表达的western blot检测结果 本研究通过western blot进一步印证免疫组化结果,检测上述核团内3β-HSD1蛋白表达的情况。结果显示,3β-HSD1在小鼠脑干的RPa、GRN及PB内均有表达(图2)。Western blot结果与免疫组化结果一致,表明本研究优化的免疫组化试验可靠,验证了3β-HSD1在小鼠脑干RPa、GRN及PB内神经元的分布结果。
本实验采用免疫组化试验检测显示3β-HSD1在小鼠脑组织内的RPA、GRN和PB均有分布,western blot进一步证实了以上3个核团内均有3β-HSD1蛋白的表达。研究表明二型糖尿病和瘦素受体基因敲除小鼠中,类固醇激素如整体胆固醇水平、脂联素和甘油三酯等的合成增高,通过检测其类固醇激素合成调节因子结果显示,3β-HSD1 mRNA表达量显著增加[13]。基于3β-HSD1在类固醇激素合成过程中的作用,以及脑组织内RPA、GRN和PB均涉及到激素的合成调控过程[17-18],推测3β-HSD1可能在上述3个核团内参与类固醇类激素的合成过程。

图2 3β-HSD1蛋白在小鼠脑干RPA、GRN、PB核团内表达的western blot检测结果Fig.2 Expression of 3beta-HSD1 protein in RPA,GRN and PB nuclei of mice brain stem
本研究通过对检测3β-HSD1在小鼠脑干中分布的免疫组化试验中的固定液成分以及预处理方式的改良,促进了该实验中抗原抗体结合效率,降低了背景着色,提高了染色结果的清晰度,证实了3β-HSD1在小鼠脑干神经元核团内的分布,为研究脑干内3β-HSD1的功能提供技术手段。

