猪圆环病毒2型的分离鉴定及高免卵黄抗体的研制
丁雨善,翟洪月,李明亮,鲍 印,杨德全,李 娜,姚伦广,阚云超,冷超粮
(南阳师范学院 河南省伏牛山昆虫生物学重点实验室/南阳市兽医生物工程技术研究中心,河南 南阳473000)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是目前在猪群中普遍存在的一种传染性病原,引起猪圆环病毒相关疾病(PCVADs)、断奶仔猪多系统衰竭综合征等(PMWS)[1]。临床表现包括消瘦、呼吸困难、腹泻和黄疸等[2]。此外,PCV2还与猪皮炎与肾病综合征(PNDS)、猪呼吸道疾病综合征(PRDC)、母猪繁殖障碍、仔猪先天性震颤等有关[3]。单独的PCV2感染并不引起明显的临床症状,但当与高致病性猪繁殖与呼吸综合病毒(PRRSV)、猪瘟病毒(CSFV)、口蹄疫病毒(FMDV)等混合感染时,常造成严重的临床症状,给养猪业造成重大的经济损失[4-5]。
卵黄抗体(Immunoglobulin of yolk,IgY)是一种从免疫禽类后禽蛋中提取的特异性抗体,由两条重链和两条轻链组成。两条重链的分子量为60 ku~70 ku,轻链分子量为22 ku~30 ku[6]。蛋鸡免疫后一个月内可获得的IgY抗体量是免疫兔子的18倍[7],而且鸡蛋存储方便。研究显示,鸡蛋储存在室温或者4℃时,6个月内,IgY效价无明显下降[8]。此外,由于结构上的差异,IgY不会激活哺乳动物的补体系统,也不与葡萄球菌蛋白A、葡萄球菌蛋白G和类风湿因子等结合,这些特点使IgY在疾病诊断和治疗方面有诸多优点[9-11]。
本研究首先从河南省部分地区多个规模化养猪场采集疑似PCV2的病料样品,对检测为阳性的样品进行PCV2全基因组测序及序列分析、病毒分离鉴定、制备灭活疫苗,并免疫蛋鸡,制备PCV2高免IgY,为PCV2的防控提供新的思路。
1 材料与方法
1.1 病料样品与主要实验材料 19份疑似PCV2的病料样品为2017年~2018年采集自河南省南阳市、平顶山市、驻马店市、周口市和安阳市的10个规模化养猪场,样品类型包括肺脏、脾脏、淋巴和血清等。病毒DNA提取试剂盒、PCR Master Mix和pMD18-T载体购自北京全式金生物技术有限公司;质粒小提试剂盒、胶回收试剂盒购自OMEGA公司;商品化PCV2灭活疫苗和IgY样品分别购自哈尔滨维科生物技术开发公司和山东绿叶制药有限公司;PCV2 ELISA抗体检测试剂盒购自韩国金诺公司;羊抗鼠IgG-FITC购自武汉三鹰生物技术有限公司;PCV2单克隆抗体(MAb)由刘长明研究员惠赠;120日龄~150日龄海兰褐蛋鸡购自南阳市某规模化养鸡场。
1.2 引 物 参考NCBI中PCV2 HN株(HM038021)基因序列,利用Oligo6.0软件设计1对PCV2检测引物和1对全长扩增引物。检测引物序列为JC-PCV2-F:5'-CCCCAGGAGGGGGCTCAAACC-3'/JC-PCV2-R:5'-GCCTACGTGGTCTACATTCCC-3';全长扩增引物为QC-PCV2-F:5'-ACCAGCGCACTTCGGCAGCG-3'/QC-PCV2-R:AATACTTACAGCGCACTTCTTTCG。引物由苏州泓迅生物科技有限公司合成。
1.3 PCV2全基因组测序及分析 按常规方法处理组织和血液样品提取DNA后,利用检测引物进行PCR检测。对检测为PCV2阳性样品的DNA利用全长扩增引物进行PCV2全基因组扩增,PCR产物由苏州泓迅生物科技有限公司测序。利用DNAStar和MEGA6.0软件对PCV2全基因组进行序列比对、同源性分析和遗传进化树构建。
1.4 病毒分离 分别将PCV2阳性组织匀浆液和血清离心,取上清经0.22 μm滤膜过滤后分别接种于处于分裂期的PK-15细胞,置于37℃、5%CO2培养4 h后弃去培养液,加入新鲜含有8%FBS的DMEM培养基和5 mmol/L D-氨基葡萄糖的维持液,继续培养72 h。收取病毒液,冻融后继续接种PK-15细胞系,按上述操作连续盲传5代。对第5代细胞培养物进行总DNA提取、PCR检测及病毒效价测定[9]。
1.5 灭活疫苗制备与蛋鸡免疫 将效价为106.5TCID50/mL PCV2分离株(17HNA2)细胞培养物冻融后离心取上清液,加入终浓度为0.2%的甲醛溶液,37℃灭活36 h。然后将灭活病毒液与白油佐剂按2∶3比例混合,充分乳化,置4℃备用。
将30只120日龄~150日龄海兰褐蛋鸡随机分为3组(A、B和C),每组10只。A组免疫自制PCV2灭活疫苗,B组免疫商品化PCV2灭活疫苗,C组为阴性对照组。每组均采用胸部肌肉注射的方式免疫。首次免疫200 μL,之后分别在首免后第14 d和28 d再次免疫100 μL,第35 d加强免疫200 μL。收集整个免疫期间各组鸡蛋并做好标记,置4℃备用。此外,在首免后的第0、7 d、14 d、21 d、28 d、35 d、42 d、49 d、56 d、63 d分别采血,制备血清,置-40℃备用。
1.6 不同方法制备IgY及其效价的测定 将首免后第0、7 d、14 d、21 d、28 d、35 d、42 d、49 d、56 d、63 d的鸡蛋分别采用氯仿法[12]和水稀释-硫酸铵沉淀法[13]制备IgY。前者取出蛋黄后,加入3倍体积的PBS,然后加入等体积氯仿萃取,之后吸取水相,加入PEG 6000至终浓度12%,将沉淀重悬后备用。后者取出蛋黄后,加入7倍蒸馏水,用稀盐酸调pH至5.0~5.2,收集上清,此即卵黄水溶性成分(WSF),即粗制IgY,最后再进行两次硫酸铵沉淀。将两种制备的IgY样品分别通过SDSPAGE和PCV2 ELISA抗体检测试剂盒检测其纯度。同时以商品化IgY作为阳性对照。
1.7 免疫鸡血清IgG和蛋黄IgY ELISA抗体和中和抗体效价的检测 将制备的各组鸡免疫后不同时间的血清和IgY分别采用PCV2 ELISA抗体检测试剂盒检测各自的抗体水平。同时,将血清和IgY分别2倍倍比稀释,然后取100 TCID50病毒液分别与等体积不同稀释度的血清和IgY混合,37℃感作1 h。将病毒血清或者病毒IgY混合物接种96孔板培养48 h后的PK-15细胞,每孔100 μL(100 TCID50)。37℃培养5 d后,弃去板内液体,洗涤后加入无水乙醇固定5 min~10 min后,以PCV2特异性MAb(1∶10)为一抗,以羊抗鼠IgG-FITC(1∶100)为二抗,荧光显微镜下观察荧光,并根据Reed-Muench法计算血清和IgY的中和效价。
1.8 统计学方法 本研究ELISA抗体和中和抗体测定中,每组数据设立3个重复,每组实验重复3次,应用SPSS软件对实验数据进行Student氏t检验。其中,*:p<0.05;**:p<0.01。
2 结果
2.1 临床样品的检测结果 对2017年~2018年采集自河南省的10个规模化养猪场19份疑似PCV2的阳性样品进行PCR检测。结果显示,有12份样品检测结果为阳性,阳性率达63.2%,表明PCV2仍是河南地区部分规模化养猪场的重要传染原。
2.2 PCV2全基因组序列分析 对PCR检测为阳性的12份PCV2样品进行全基因组序列扩增并测序,并与PCV2参考株进行同源性和进化树分析。结果显示,本研究中12株PCV2之间的同源性为96.9%~100%,与参考株PCV2a CL(HM038033)、PCV2b 05-32650株(EF394779)、PCV2b HN株(HM038021)和PCV2dBDH株(HM038017)之间的同源性分别为95.1%~95.5%、95.4%~98.5%、95.5%~99.5%和95.5%~99.9%。进化树分析结果显示,12株PCV2中,8株(17HNA2、17HNA3、17HNA4、17HNA6、18HeNA8、18HeNA9、18HeNA11和18HeNA12)属于PCV2d亚型,且形成两个相对独立的分支(图1)。4株(17HNA1、17HNA5、18HeNA7和18HeNA10)属于PCV2b亚型,与参考株PCV2b JF(HM038022)形成一个相对独立的分支(图1)。这些结果表明,PCV2d亚型是目前河南地区PCV2的主要流行株,且存在不断变异的趋势。
2.3 病毒分离 将12份PCV2阳性样品常规处理后分别接种PK-15细胞,盲传5代后经PCR鉴定。结果显示,7份样品可以分离出病毒,分别命名为17HNA1、17HNA2、17HNA5、18HeNA7、18HeNA8、18HeNA9和18HeNA10。其中17HNA2分离株效价为106.5TCID50/mL最高,其它分离株效价为102.0TCID50/mL~104.5TCID50/mL。
2.4 IgY不同制备方法比较 将免疫后28 d收集的鸡蛋分别经氯仿法和水稀释-硫酸铵沉淀法制备IgY样品后经SDS-PAGE电泳检测。结果显示,所有IgY样品均有两条目的条带(重链和轻链),大小分别为67 ku和23 ku(图2)。其中氯仿法制备的IgY样品两条目的条带较为清晰,且杂蛋白较少。水稀释-硫酸铵沉淀法制备的WSF样品杂蛋白较多。一次硫酸铵沉淀后杂蛋白明显减少,但目的蛋白仍不清晰。二次硫酸铵沉淀后,目的蛋白得到浓缩,纯度进一步提高,结果较为理想。
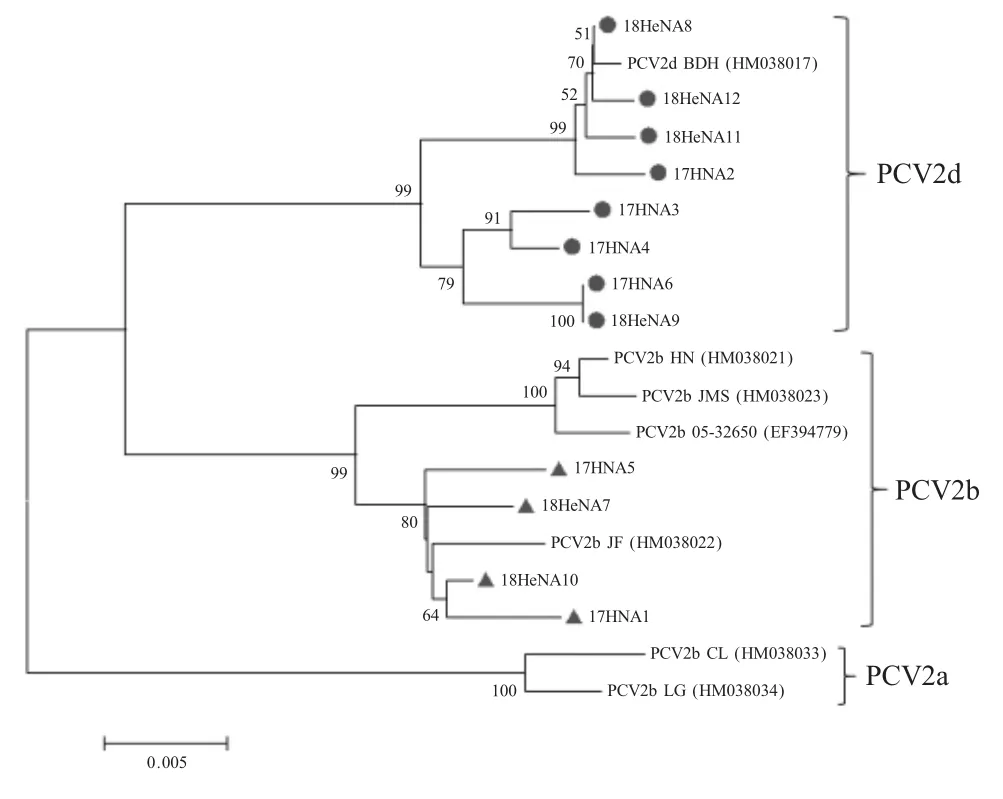
图1 PCV2分离株与参考株的遗传进化树分析Fig.1 Phylogenetic tree based on the newly emerged PCV2 isolates and reference strains
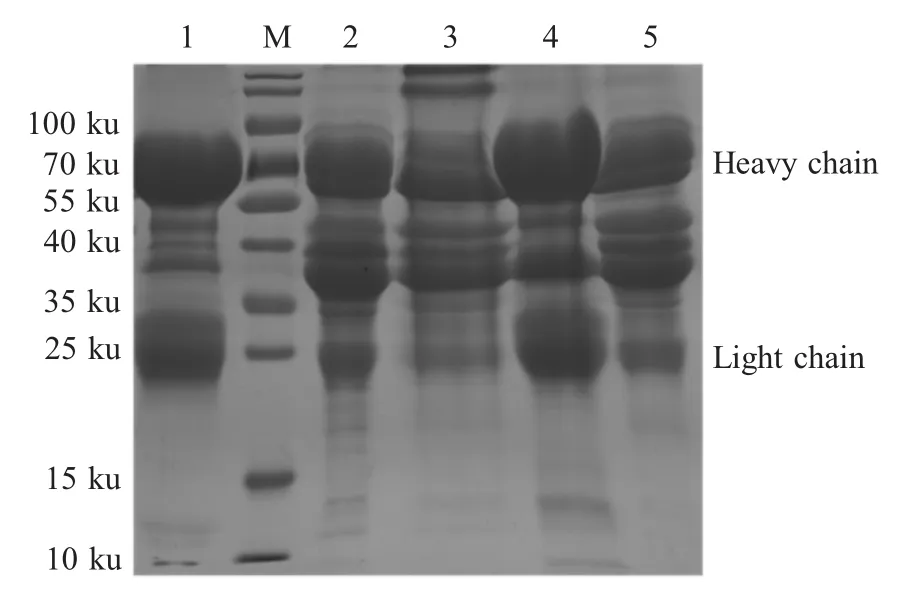
图2 不同方法制备IgY效果的检测结果Fig.2 Analysis of IgY samples with different preparation methods by SDS-PAGE
将各组免疫后0 d蛋样混合物和免疫后28 d的蛋样混合物,分别通过上述两种方法制备IgY,并经PCV2 ELISA抗体检测。结果显示,前者蛋样中,氯仿法制备的IgY样品OD450nm值显著低于水稀释-硫酸铵沉淀法(p<0.01),表明氯仿法制备的IgY纯度较高,特异性较强。而免疫后28 d蛋样中两种方法制备的IgY OD450nm值差异不显著(p>0.05)(图3),表明两种方法制备的IgY均具有较好的活性,能够与PCV2抗原发生特异性结合。
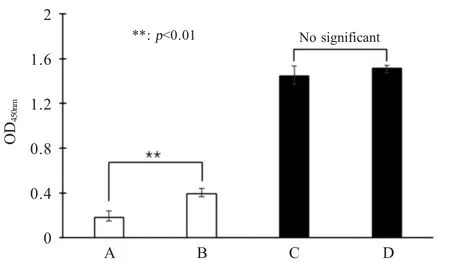
图3 ELISA比较不同方法制备的IgY效果Fig.3 Analysis of IgY samples with different preparation methods by ELISA
2.5 免疫鸡血清IgG和蛋黄IgY ELISA抗体和中和抗体效价的检测结果 分别测定不同组蛋鸡在免疫后不同时间点的血清IgG和蛋黄IgY的ELISA抗体和中和抗体水平。结果显示,在首免后7 d,A组和B组鸡ELISA抗体水平快速上升,28 d达到峰值,此后一直持续至实验结束(首免后63 d)。两组之间均无显著差异(p>0.05);两组鸡的中和抗体水平也是在首免后7 d快速上升,28 d达到峰值,最高中和抗体效价达1∶181。两组之间也无显著差异(p>0.05),对照C组鸡两种抗体在整个实验期间均未检测到(图4)。表明自制PCV2灭活疫苗和商品化PCV2灭活疫苗均可诱导蛋鸡产生较高水平的特异性IgY。
3 讨论
PCV2感染会造成猪生长缓慢,料肉比下降,养殖成本增加,而且其还破坏猪体免疫系统,继发其它病原感染,给养殖业重大损失[14]。此外,近年来,PCV2变异株不断出现,给该病的防控带来了更为严峻的挑战。我国PCV2流行株包括PCV2a、PCV2b和PCV2d,其中以PCV2b为主。但是近年监测显示,PCV2d有逐步替代PCV2b,成为流行株的趋势[15]。本研究报道12株PCV2中,PCV2d亚型8株,占66.7%,也符合这一趋势。
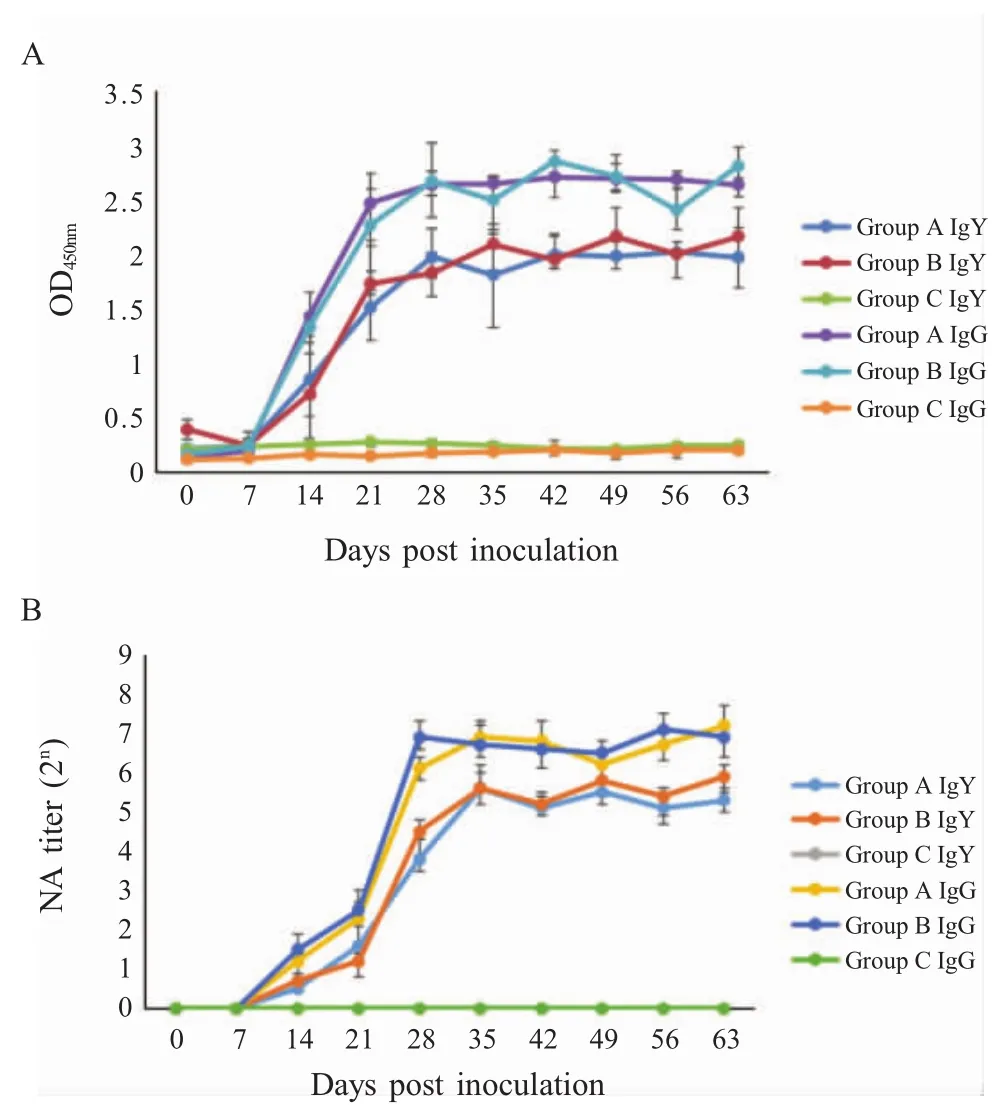
图4 ELISA方法(A)和中和试验方法(B)检测不同免疫组鸡血清IgG和蛋黄IgY抗体的结果Fig.4 Changes of IgG in sera and IgY in egg yolk in different groups detected by ELISA(A)and neutralization test(B),respectively
目前,PCV2引起的疫病的防控主要依靠疫苗免疫。但由于病毒变异、疫苗质量差以及免疫程序不合理等因素,常造成免疫失败。而且,现阶段对PCV2感染的治疗也没有特效药,对病猪的治疗主要集中在防止继发感染、提高机体抵抗力等方面。本研究研制的抗PCV2特异性IgY,不仅可以用于PCV2的预防,也可用于感染后的紧急治疗,给该病的防治带来了新思路。
本研究采用两种方法制备的IgY,效果均较为理想。但由于氯仿具有高毒性,且用量大、价格高,产物中有氯仿残留等缺点,因此该方法不适合用于大规模生产,其制备的抗体也不能用于临床治疗。但该方法制备效果好,省时省力,短时间内即可获得高质量的IgY抗体,适合用于抗体效价检测等。相对而言,水稀释-硫酸铵沉淀法不含毒性物质,不会造成环境污染,且成本较低,适合用于工业化生产。
PCV2细胞培养的病毒效价偏低一直是行业难题。本研究分离出一株效价达106.5TCID50/mL的PCV2。且用该株病毒制备的PCV2灭活疫苗与商品化PCV2灭活疫苗免疫蛋鸡后均能诱导其产生较高水平的IgY,且该IgY具有较高水平的中和效价(1∶181),为进一步降低PCV2 IgY生产成本,提升其工业化生产能力奠定了坚实的基础。
本研究通过PCV2分离鉴定、制备PCV2灭活疫苗及免疫产蛋鸡,获得了较高效价的IgY,且抗体产生稳定,持续时间长。通过水稀释-硫酸铵沉淀法制备的IgY具有纯度高,适合用于工业化生产的特点。本研究为进一步开展IgY抗PCV2研究奠定了基础。

