猪源A型产气荚膜梭菌β2毒素与宿主细胞互作蛋白的筛选鉴定
曾 秀,张兰桥,周 姣,王婧祺,戴益民,张锦华*
(1.江西农业大学 动物科学技术学院,江西 南昌330045;2.江西农业大学 生物科学与工程学院,江西 南昌330045)
产气荚膜梭菌(Clostridium perfringen,Cp),在自然界广泛分布,是革兰氏阳性产芽孢粗大杆菌。Cp是引起人类食物中毒、多种动物坏死性肠炎、肠毒血症的重要病原微生物之一[1]。对幼年动物影响较大,被感染的幼畜即使经治疗存活下来,也会出现发育迟缓的现象[2],对动物的生产性能以及畜牧业的发展造成了重大的经济损失。
根据其主要的4种致死性毒素[2](α、β、ε、ι),Cp可分为A、B、C、D、E 5种类型,除此之外最新的分类还依据肠毒素(CPE)和坏死性肠炎毒素B(NetB)增加了F和G型[3],其中A型和C型Cp是导致动物发病的主要病原。Cp还产生β2、θ等其它外毒素和侵袭性酶,达16种以上。其中β2毒素是一种具有细胞毒性和致死性的强毒素[4-5],其由CPB2基因编码产生,可以由所有型Cp产生[6],目前CpA的β2毒素研究较多。有研究表明β2毒素可能是α毒素的辅助毒素,β2毒素和α毒素具有协同作用[7];也有研究表明β2毒素具有细胞毒性,可以引起豚鼠胃肠道出血坏死[4];β2毒素在体外试验中表现出对人Caco-2细胞的毒性作用[6]。但是β2毒素的致病机制还不明确,其对细胞的毒性作用存在较大的争议,且目前尚未见到与β2毒素相互作用的宿主蛋白的研究报道。因此,本研究首次采用酵母双杂交技术,以CpA(JXJA17菌株)的β2毒素为“诱饵”蛋白,从猪肠上皮细胞系(IPEC-1)的cDNA文库中筛选到4个与β2毒素相互作用的宿主蛋白。其中半乳糖凝集素-1(LGALS1)存在于细胞膜外侧,具有调节细胞生长、细胞黏附、诱导细胞凋亡等作用[7-8]。酵母回交验证试验进一步证实β2毒素和LGALS1存在特异相互作用,为进一步探究β2毒素侵入细胞机制提供实验依据。
1 材料与方法
1.1 主要实验材料 CP JXJA17菌株(CP028149.1)由本实验室分离鉴定并保存;IPEC-1酵母双杂交文库由江西农业大学生命科学与工程学院教研室惠赠;质 粒pGADT7、pGADT7-T、pGBKT7、pGBKT7-Lam、pGBKT7-53、酵母菌株Y2H Gold均购自Clontech公司;PrimeSTAR®HS DNA聚合酶、限制性内切酶EcoRⅠ、BamHⅠ、T4 DNA连接酶均购自TaKaRa公司;蛋白Marker购自Genview公司;MatchmakerTMGold酵母双杂交系统购自Clontech公司;带c-Myc标签的小鼠单克隆抗体(MAb)、山羊抗小鼠IgG-HRP均购自Sigma公司;化学发光(ECL)试剂盒购自美国Amersham公司。
1.2 JXJA17菌株β2毒素基因的PCR扩增 根据Cp β2毒素基因序列(AJ537530.1),设计扩增该基因(798 bp)的引物(表1),使用细菌基因组提取试剂盒按照说明书提取JXJA17菌株(CP028149.1)的DNA,以其为模板,以引物BD-β2-F/和BD-β2-R(表1)PCR扩增JXJA17菌株中的β2毒素基因,PCR产物回收纯化后连接至pMD18-T载体构建重组质粒pMD18-β2,重组质粒经测序鉴定后备用。

表1 实验所用引物Table 1 Primes used in this study
1.3 诱饵质粒pGBKT7-β2的构建与鉴定 质粒pMD18-β2经EcoRⅠ/BamHⅠ双酶切后胶回收β2毒素基因,连接至质粒pGBKT7中构建重组表达质粒pGBKT7-β2,转化Top10感受态细胞,挑选阳性转化子扩大培养,并提取质粒pGBKT7-β2经EcoRⅠ/BamHⅠ双酶切鉴定后,由上海生工生物工程技术服务有限公司测序鉴定。
1.4 含β2毒素基因诱饵蛋白的表达与鉴定 使用LiAc法制备酵母菌Y2H Gold感受态细胞,将测序正确的质粒pGBKT7-β2转化至Y2H Gold中,同时设pGBKT7转化至Y2H Gold中为阴性对照,菌液涂布SD/-Trp固体平板培养基,30℃培养3 d~5 d,挑取阳性克隆提取质粒,由上海生工生物工程技术服务有限公司测序鉴定。
将测序结果正确的pGBKT7-β2/Y2H Gold菌株培养至10 mL SD/-Trp液体培养基中,30℃培养3 d,经5 000 r/min离心2 min收集细菌;用0.2 mol/L NaOH抽提酵母细胞的总蛋白,经10%SDS-PAGE电泳、转膜,用5%脱脂乳室温封闭1 h,以带cMyc标签的小鼠MAb(1∶5 000)为一抗4℃过夜孵育,羊抗鼠IgG-HRP(1∶5 000)为二抗,同时以pGBKT7/Y2H Gold为空白对照,经western blot检测β2毒素基因诱饵蛋白的表达。
1.5 诱饵蛋白β2毒素的毒性及自激活鉴定 将质粒pGBKT7-53和pGADT7-T共转化酵母感受态细胞作为阳性对照;将质粒pGBKT7-Lam和pGADT7-T共转化酵母感受态细胞作为阴性对照组;以诱饵质粒pGBKT7-β2与pGADT7共转化酵母感受态细胞作为实验组,分别取每种转化重组菌液100 μL各涂布于SD/-Leu/-Trp和SD/-Leu/-Trp/-His平板,30℃培养3 d~5 d,观察结果。
1.6 筛选与β2毒素相互作用的宿主蛋白 将pGBKT7-β2/Y2H Gold重组酵母菌培养至OD600nm=0.8时,离心弃上清,用5 mL SD/-Trp液体培养基重悬沉淀,加入1 mL IPEC-1 cDNA文库混合,同时加入含有卡那霉素(浓度为0.1 mg/mL)的2×YPDA液体培养基45 mL,于30℃低速培养20 h以上,在显微镜下观察细胞形态。当大部分细胞呈现“米老鼠头”时,离心弃上清,用YPDA液体培养基重悬菌体,离心弃上清,用10 mL 0.5×YPDA液体培养基重悬沉淀,并涂布于SD/-Leu/-Trp/-His固体培养基上,30℃倒置培养3 d~5 d进行初筛。将初筛获得的阳性菌落重新涂布至SD/-Ade/-Leu/-Trp/-His再次筛选,将复筛长势良好的转化子接种至SD/-Ade/-Leu/-Trp/-His液体培养基中,培养3 d~8 d后提取酵母质粒,并将酵母质粒转化至Top10感受态细胞中提取质粒,由上海生工生物工程技术服务有限公司测序,对测序结果经NCBI数据库进行BLAST比对分析。
1.7 质粒pGADT7-LGALS1和pGADT7-LGALS1-C的构建 根据上述筛选并经NCBI比对得到的与β2毒素相互作用的LGALS1蛋白基因的全长核苷酸序列设计引物(表1),以IPEC-1的cDNA文库为模板,使用引物AD-LGALS1-F/AD-LGALS1-R PCR扩增LGALS1基因的全长;使用引物AD-LGALS1-CF/AD-LGALS1-C-R PCR扩增LGALS1基因的C端序列。反应程序均为98℃10 min;98℃30 s、58℃30 s、72℃30 s,35个循环;72℃10 min。反应结束后,PCR产物经胶回收纯化后分别连接至pGADT7载体,构建重组质粒pGADT7-LGALS1、pGADT7-LGALS1-C,转化Top10感受态细胞中,挑选阳性克隆子经PCR鉴定后由上海生工生物工程技术服务有限公司测序鉴定,鉴定正确的提取质粒pGADT7-LGALS1和质粒pGADT7-LGALS1-C备用。
1.8 LGALS1与β2毒素相互作用的回交试验 将重组质粒pGADT7-LGALS1和pGADT7-LGALS1-C分别转化至1.4得到的pGBKT7-β2/Y2H Gold重组酵母菌中,并以pGADT7-T+pGBKT7-P53转化该重组菌作为阳性对照,分别以pGADT7-T+pGBKT7-Lam转化该重组菌以及以pGADT7-T+pGBKT7-β2转化该重组菌作为阴性对照。分别接种至SD/-Leu/-Trp和SD/-Leu/-Trp/-His液体培养基中30℃培养3 d,将培养后的菌液10倍倍比稀释(100~104)后分别取10 μL各转化重组菌的SD/-Leu/-Trp菌液依次点在SD/-Leu/-Trp平板上;分别取10 μL上述经稀释的各转化重组菌的SD/-Leu/-Trp/-His菌液依次点在SD/-Leu/-Trp/-His平板上,于30℃培养3 d~5 d,观察酵母菌的生长情况。
2 结果
2.1 诱饵质粒pGBKT7-β2的鉴定结果 以JXJA17菌株的DNA为模板,PCR扩增结果显示,扩增得到了约800 bp的目的条带,与预期大小一致(图1)。测序结果显示扩增的β2毒素基因无碱基发生突变。诱饵质粒pGBKT7-β2经EcoRⅠ和BamHⅠ酶切鉴定,结果显示pGBKT7-β2经双酶切后在798 dp处有目的条带(图2),测序结果显示β2毒素基因无碱基突变。

图1 β2毒素的PCR扩增结果Fig.1 PCR amplification of β2 toxin
2.2 β2毒素蛋白的表达鉴定 将质粒pGBKT7-β2转化至酵母菌株Y2H Gold内,涂布SD/-Trp固体平板培养基后,挑取转化子提取质粒并测序鉴定,结果显示pGBKT7-β2/Y2H Gold中含有质粒pGBKT7-β2,且β2基因未发生碱基突变,表明pGBKT7-β2/Y2H Gold可用于后续的试验。采用western blot检测β2毒素基因的表达情况。结果显示,pGBKT7-β2/Y2H Gold重组菌可见约48 ku的目的蛋白条带,而pGBKT7/Y2H Gold未见该蛋白条带(图3),表明β2毒素在酵母菌中能正确表达,满足后续试验的需要。
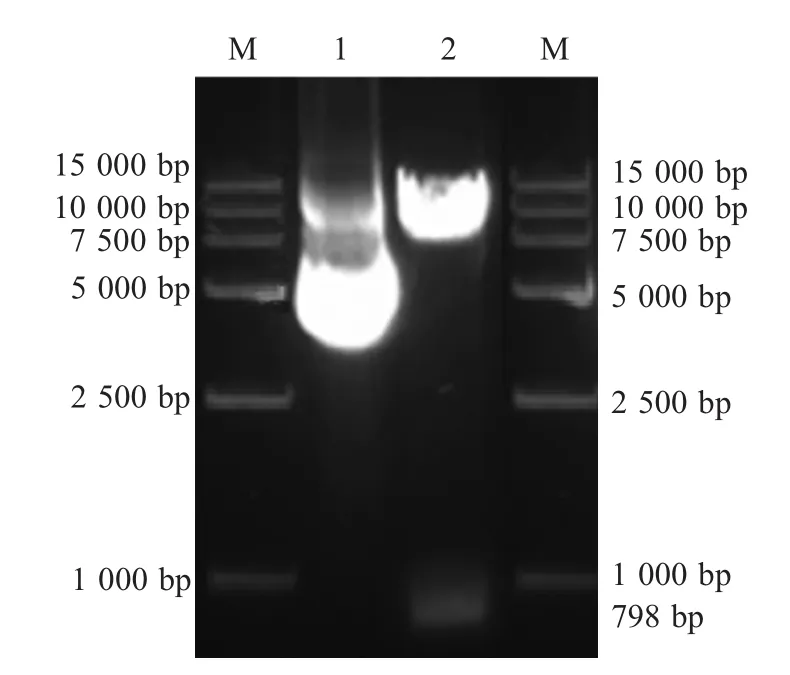
图2 质粒pGBKT7-β2双酶切鉴定结果Fig.2 Identification of pGBKT7-β2 plasmid by double digestion

图3 β2毒素诱饵蛋白表达的检测结果Fig.3 Detection of the expression of bait protein β2
2.3 诱饵蛋白β2毒素的毒性和自激活鉴定结果分别将质粒pGBKT7-53和pGADT7-T共转化酵母感受态细胞作为阳性对照;将质粒pGBKT7-Lam和pGADT7-T共转化酵母感受态细胞作为阴性对照;以诱饵质粒pGBKT7-β2与pGADT7共转化酵母感受态细胞作为试验组,并分别将各重组菌接种在SD/-Leu/-Trp和SD/-Leu/-Trp/-His固体培养基上(图4C),培养后观察可见3种菌均能够在SD/-Leu/-Trp固体培养基上生长,且菌落大小和数量基本一致(图4A),表明诱饵蛋白β2毒素的表达对酵母菌无毒性。在SD/-Leu/-Trp/-His固体培养基上仅阳性对照能生长(图4B),表明诱饵蛋白β2无自激活活性。
2.4 与β2毒素互作蛋白的筛选及序列分析 将pGBKT7-β2/Y2H Gold和IPEC-1 cDNA文库融合得到的菌液涂布于SD/-Leu/-Trp/-His固体培养基上培养,挑选长出的菌落接种至SD/-Ade/-Leu/-Trp/-His固体培养基,培养后,共获得了18个阳性克隆菌株。将得到的18个阳性克隆菌株分别提取质粒,转化Top10感受态细胞并提取质粒测序,测序结果经NCBI数据库比对,得到4种能与β2毒素蛋白相互作用的IPEC基因,这4种基因序列分别编码蛋白S20、LGALS1、L12和Atrophin-1(表2)。

图4 诱饵蛋白β2的毒性(A)和自激活(B)检测结果Fig.4 β2 bait protein toxicity(A)and self-activating activity assay(B)

表2 与β2毒素蛋白相互作用的细胞蛋白基因测序分析结果Table 2 Sequencing results of genes encoding proteins interacting with β2 toxin
2.5 质粒pGADT7-LGALS1和pGADT7-LGALS1-C的构建 以IPEC-1的cDNA文库为模板,采用不同的引物分别扩增LGALS1基因的全长及其C端序列。结果显示,分别扩增得到了约400 bp和250 bp的目的条带,与预期大小一致(图5)。分别将其与质粒pGADT7连接转化后测序,结果显示扩增产物分别与LGALS1基因的全长及其C端序列完全一致,表明质粒pGADT7-LGALS1和pGADT7-LGALS1-C构建正确。
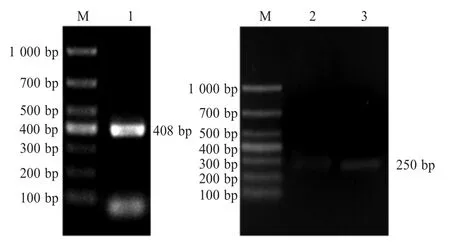
图5 LGALS1基因的PCR扩增结果Fig.5 PCR amplification of LGALS1 gene
2.6 β2毒素与LGALS1全长及其C端相互作用的回交试验结果 将pGBKT7-53和pGADT7-T共转化酵母菌作为阳性对照,其在SD/-Leu/-Trp和SD/-Leu/-Trp/-His平板上均能生长,并且随着菌液浓度的降低,其生长的数量减少;而pGADT7-T和pGBKT7-Lam共转化酵母菌与pGADT7-T和pGBKT7-β2共转化酵母菌作为阴性对照,其在SD/-Leu/-Trp平板上能生长,且随着重组菌的浓度降低,其在SD/-Leu/-Trp平板上生长的数量减少;同时这两组阴性对照在SD/-Leu/-Trp/-His平板上几乎不生长。pGADT7-LGALS1和pGBKT7-β2共转化酵母菌在SD/-Leu/-Trp平板上能够正常生长,但随着重组菌的菌液浓度不断降低,其生长的数量越来越少;该转化菌株在SD/-Leu/-Trp/-His平板上能够生长,但随着菌液浓度的降低,其生长数量减少,且在菌液稀释10倍之后就不再生长。表明β2毒素和LGALS1蛋白存在相互作用,但作用强度较弱。pGADT7-LGALS1-C和pGBKT7-β2共转化酵母菌在SD/-Leu/-Trp平板上能够正常生长,但随着重组菌的菌液浓度不断降低,其生长的数量越来越少。该转化菌株在SD/-Leu/-Trp/-His平板上能够生长,随着菌液浓度的降低,其在SD/-Leu/-Trp/-His平板上生长的数量减少,在菌液稀释103倍后就不再生长,表明β2毒素与LGALS1蛋白C端能够发生较强的相互作用(图6)。上述结果表明β2毒素与LGALS1蛋白在酵母细胞中存在相互作用,但β2毒素与LGALS1蛋白C端的作用比其与LGALS1完整蛋白的作用更强。

图6 β2毒素与LGALS1相互作用的回交试验结果Fig.6 Validation test of the interaction of β2 toxin with LGALS1
3 讨论
酵母双杂交技术是鉴定蛋白质互作最有效和最广泛的分子生物学技术[9],其具有操作简单、成本低、高效、敏感度高、应用范围广等优点。目前,酵母双杂交技术也被用来探究与已知蛋白(Pik-h蛋白、刚地弓形虫14-3-3蛋白等)相互作用的蛋白[9-10]。然而,目前未见有将酵母双杂交技术应用到筛选与Cp β2毒素相互作用的蛋白中,本研究首次将酵母双杂交技术应用到筛选与Cp β2毒素互作的宿主蛋白。Cp是一种存在于肠道内的条件性致病菌,会造成仔猪的腹泻、坏死性肠炎以及猝死等症状[3],该菌产生的β2毒素对小肠粘膜上皮细胞的作用机制还不明确[5],本研究构建了Cp β2毒素的重组表达质粒pGBKT7-β2,将其转化至Y2H Gold后能正常表达β2毒素蛋白,且无自激活和自毒性作用。将其作为“诱饵”蛋白,通过酵母双杂交技术从IPEC-1的cDNA文库中筛选出与β2毒素相互作用的4种蛋白:S20、LGALS1、L12和Atrophin-1。S20、L12和Atrophin-1属于核蛋白,调控其它蛋白的合成[11-13],而LGALS1蛋白与细胞的粘附、增殖和凋亡有关[7],具有进一步的研究价值。LGALS1回交试验证实了LGALS1蛋白与β2毒素具有特异性的相互作用,但两者之间相互作用强度较弱。有研究表明LGALS1是一种位于细胞膜中的蛋白,推测β2毒素与其的作用强度可能与其结构有关,因此选择LGALS1蛋白C端与β2毒素进行相互作用的验证。结果显示β2毒素与LGALS1蛋白C端的作用强于其与LGALS1完整蛋白的作用。本实验所用的C端是从LGALS1蛋白C末端开始的66个氨基酸,其结构中含有6个片层和一个环状结构,包含糖结合识别域(CRD)的大部分结构,与完整蛋白相比该区域可能增加了β2毒素与其作用位点结合的概率,且重组表达的蛋白结构与原蛋白结构可能略有些差异,其具体的作用位点还需要进一步验证。
LGALS1蛋白(半乳糖凝集素1)又称为Galectin-1,由LGALS1基因编码,是哺乳动物凝集素的一种,是最先被报道的一种内源糖结合蛋白,参与多种病理、免疫过程,具有促进肿瘤的转化、参与细胞粘附、调节细胞生长、促进细胞凋亡、炎症反应发生、免疫调节等作用[7-8],并且LGALS1蛋白还是NDV(新城疫病毒)HN蛋白以及VSV(水泡性口炎病毒)G蛋白的受体[14-16],在这些病毒感染的过程中LGALS1的含量会上升,但是还未有研究表明其为细菌毒素的受体。本次研究也为研究LGALS1蛋白的功能作用提供了新的方向。
本研究采用酵母双杂交技术筛选并鉴定出与Cp β2毒素相互作用的蛋白质LGALS1,该蛋白主要通过C端与β2毒素结合,从而调节细胞的炎性因子和细胞凋亡。本研究首次将酵母双杂交技术应用到筛选与β2毒素互作的宿主蛋白中,为β2毒素的研究提供了新方法,并为进一步研究其细胞毒性和致病机理奠定了基础。

