三基因缺失重组弱毒株(PRV-HNX-TK-/gE-/gG-+PCV2 ORF2)不同途径免疫的效果分析
吴 昊,牛伟杰,王久红,胡耀方,姚 伦,库旭钢,何启盖*
(1.华中农业大学 农业微生物学国家重点实验室,湖北 武汉430070;2.华中农业大学 动物医学学院,湖北 武汉430070;3.生猪健康养殖协同创新中心,湖北 武汉430070)
猪伪狂犬病(Pseudorabies,PR)由PR病毒(PRV)引起,主要症状为仔猪高热、食欲废绝、呼吸困难、喷嚏流涎、腹泻、共济失调、昏迷;母猪返情、流产、产死胎、木乃伊胎;公猪则表现睾丸肿胀、萎缩;育肥猪则主要表现为呼吸道症状,15日龄内仔猪死亡率高达100%、断奶仔猪死亡率10%~20%[1]。PRV仅有一个血清型,但是不同病毒株之间具有不同的生物学特性和毒力[2]。2013年以来,出现了如JS-2012株[3]、HNX株[4]、Guizhou-DY株[5]、HN12011株[6]等致病力更高的新流行株,导致我国PR阳性猪场数及猪场野毒感染阳性率大幅升高,对我国PR的防控带来更多挑战。PCV2感染目前也是临床常见疾病。
使用基因缺失弱毒疫苗是PR净化措施中的核心技术之一。当前,肌内注射是PR疫苗的主要免疫途径,滴鼻免疫主要用于新生仔猪乳前免疫,但关于口服免疫PRV疫苗的研究报道不多。Maresch等探索了野猪口服免疫PR疫苗,发现口服免疫PRV弱毒苗能诱导较高的中和抗体,能保护野猪攻毒后不发生临床症状[7]。但PCV2目前未见相关报道。口服免疫能有效诱导机体产生免疫应答,口服免疫方式在规模化养殖场全群免疫甚至野生动物免疫方面省时省力,还能极大地减少动物应激,是很有应用价值的免疫方式[8]。
本实验室前期以HNX野毒株为亲本病毒,将编码2型圆环病毒(PCV2)Cap蛋白的ORF2基因插入gE/TK/gG三基因缺失弱毒株PRV-HNX-TK-/gE-/gG-[9]中,研制出PRV-PCV2重组弱毒株。本研究通过比较口服免疫与肌肉注射免疫该弱毒株的免疫效果,主要对口服免疫该弱毒株的可行性进行了评价。
1 材料与方法
1.1 主要实验材料 PRV-HNX株由本实验室分离并保存;三基因缺失重组弱毒株PRV-HNX-TK-/gE-/gG-+PCV2 ORF2由本实验室构建并保存[10]。实验动物来自湖北某规模化养殖场,该场为PRV野毒阴性的养殖场,13头28日龄的仔猪未免疫PR疫苗,母猪及仔猪(母源抗体)血清经检测为gB抗体阳性,gE抗体全部为阴性。PRV-gB ELISA检测试剂盒购自武汉科前生物股份有限公司;PCV2-dCap-ELISA抗体检测试剂盒购自广州悦洋生物技术有限公司;猪IFN-γ ELISA Kit购自Bio-Swamp;DNA提取试剂盒(离心柱型)购自Tiangen公司;PRV gD荧光定量PCR方法所用引物及探针由本实验室保存。
1.2 实验动物分组 将13头猪随机分成3组,口服免疫组5头,肌注免疫组5头,对照组3头。
1.3 动物攻毒保护实验 仔猪于28日龄初次免疫,56日龄加强免疫,免疫用缺失弱毒株浓度为5×104TCID50/mL,口服免疫组口服剂量2 mL/头、肌注免疫组肌肉注射2 mL/头、对照组肌肉注射2 mL DMEM培养基。84日龄攻毒,攻毒剂量为每头猪口服1 mL PRV HNX株(5×106TCID50/mL)和肌注1 mL PRV HNX株(5×106TCID50/mL),共计接种PRV HNX株(1×107TCID50)。98日龄迫杀。
分别在免疫后第0、3 d、7 d、10 d、14 d、21 d、28 d,加强免疫后第7 d、14 d、21 d、28 d;攻毒后7 d、14 d采集鼻拭子、口腔液、肛拭子、血液;记录攻毒后1 d~14 d体温、体重变化和临床表现。攻毒后第14 d迫杀采集组织样品,进行病理组织学观察。
1.4 gB抗体水平检测 采用gB-ELISA试剂盒检测免疫后各时间点抗体水平。成立条件为:阴性OD值(N)-阳性OD值(P)≥0.4,判定标准为:样品OD值(S)/阴性OD值(N)≤0.6判为阳性;0.6
1.5 血清中和试验抗体的检测(固定病毒稀释血清法) 将50 μL不同稀释度的免疫猪血清与50 μL 200 TCID50的PRV HNX液混合,37℃感作30 min,再加入100 μL PK-15细胞(2×105个/mL~3×105个/mL),37℃5%CO2培养5 d,每d观察CPE,采用Reed-Muench法计算出能保护50%组织培养细胞不出现细胞病变(CPE)的血清最高稀释倍数,作为该血清的50%中和效价(PD50)。
1.6 免疫猪血清IFN-γ含量测定 采用IFN-γ ELISA试剂盒免疫前后各时间点血清中IFN-γ水平,对检测结果进行计算分析。
1.7 PCV2 Cap抗体检测 采用PCV2-dCap-ELISA试剂盒检测免疫前后各时间点PCV2 Cap抗体水平。
1.8 攻毒后临床症状打分 攻毒后,每天观察临床症状30 min,观察症状包括精神沉郁、食欲不振、打喷嚏、咳嗽、鼻液增多、喘气、神经症状等7个指标,每发生一种症状加1分,相同症状不叠加[4]。
1.9 病毒载量的荧光定量PCR检测 将攻毒前后的鼻拭子及粪拭子分别加入1 mL灭菌PBS缓冲液,震荡5 min,8 000 r/min离心5min,取上清200 μL按照DNA提取试剂盒说明提取DNA以此为模板,利用本实验室建立的荧光定量PCR方法[9]检测攻毒后PRV的病毒载量。
1.10 病理组织切片观察 攻毒后14 d迫杀各组免疫猪,取脑、扁桃体组织(约5 mm3),4%多聚甲醛4℃低温固定,蜡块包埋,切片,经HE染色后镜下观察结果。
2 结果
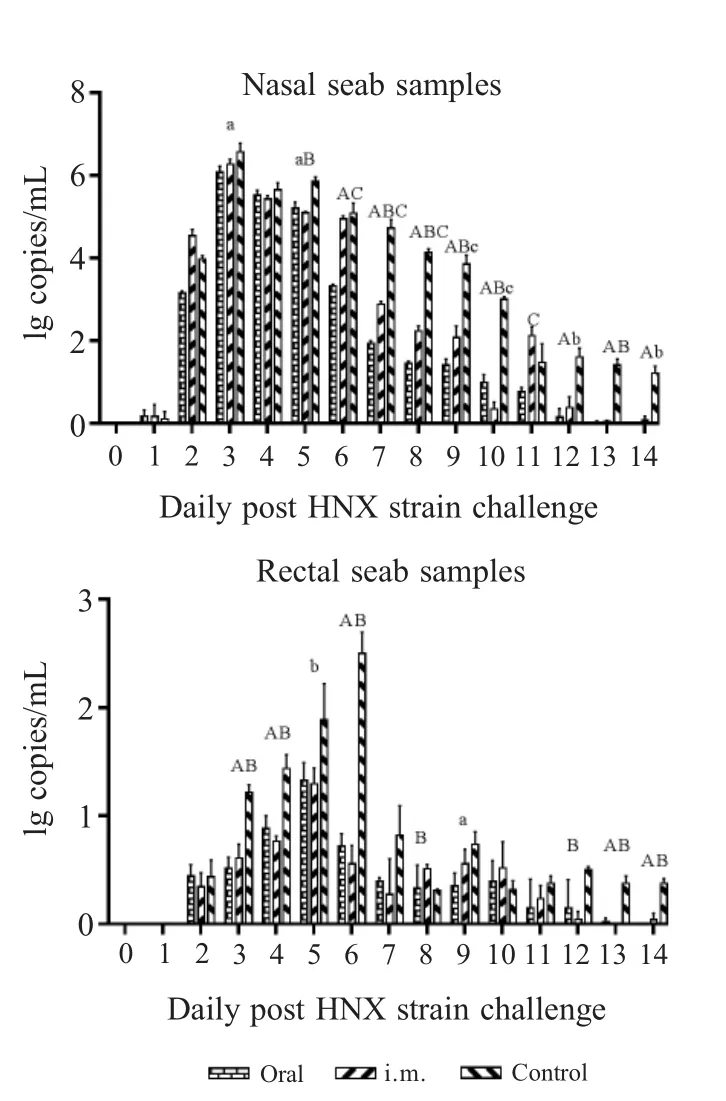
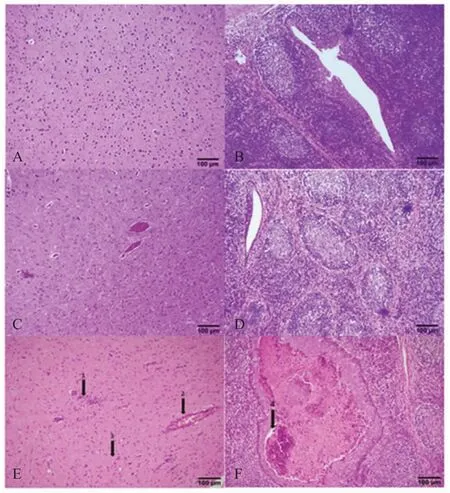
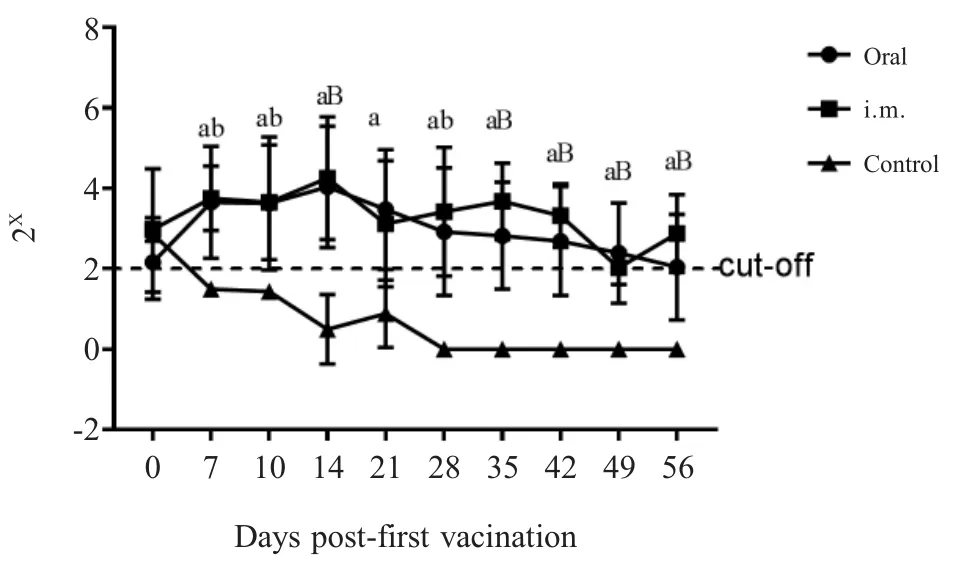
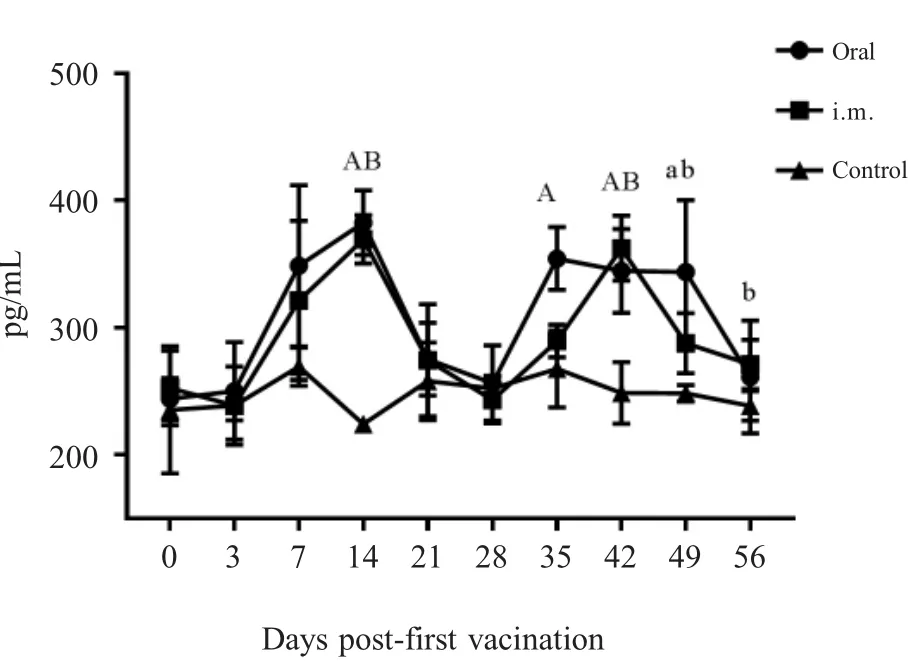
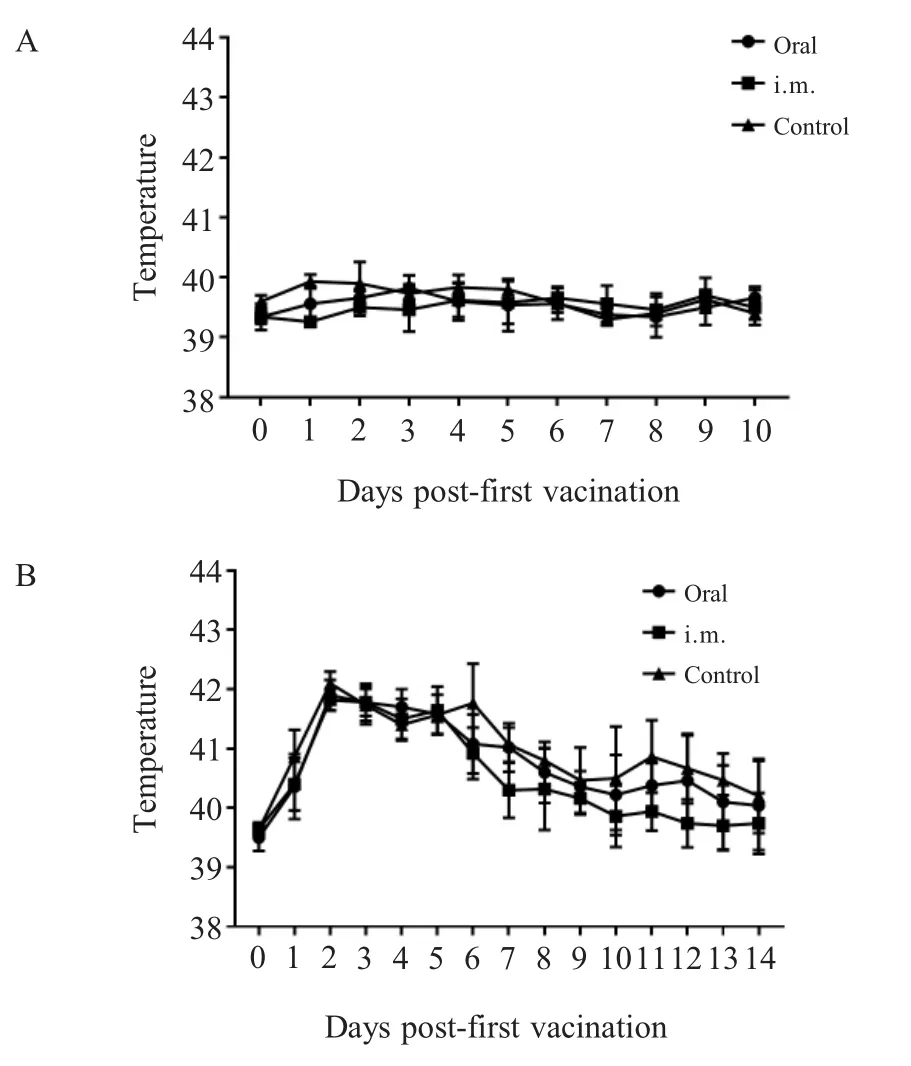
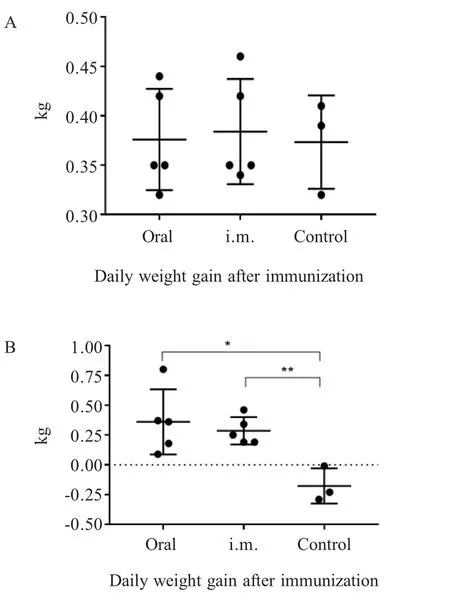
2.1 PRV gB抗体检测结果 免疫前各组仔猪gB抗体均为阳性(母源抗体),各组间S/N值无显著差异(p>0.05);一免后第7 d,3个组仔猪血清抗体的S/N值分别为0.169±0.033(阳性),0.144±0.022(阳性),0.757±0.009(阴性),口服组与肌注组间无明显差异(p>0.05),但均极显著的高于对照组(p<0.01),对照组gB母源抗体消失且一直未转阳;二免后第14 d(42日龄),口服组与肌注组S/N值分别为0.368±0.183(阳性),0.301±0.147(阳性),仍极显著高于对照组0.879±0.033(阴性)(p<0.01);二免后第28 d(56日龄),口服组中有一头猪gB抗体变为阴性0.853,其平均S/N值为0.616±0.136(一头猪转阴)、肌注组平均S/N值为0.408±0.106(阳性),对照组为0.832±0.028(阴性),口服组与对照组间无明显差异(p>0.05),肌注组与对照组差异显著(0.01 2.2 血清中和抗体效价检测结果 免疫前各组猪血清中和效价均大于1∶4,且各组间无显著差异(p>0.05),一免第7 d后口服组与注射组仔猪中和抗体效价均开始升高,且高于1∶4,对照组血清中和效价低于1∶4,且降至1∶2以下,口服组与注射组中和抗体效价均显著高于对照组(p<0.05),且两个免疫组间无显著差异(p>0.05),并持续至二免后28 d(图2)。通过两种免疫途径免疫该弱毒株均能有效地诱导仔猪产生有效的PRV中和抗体。进一步表明口服方式与肌肉注射均能有效地刺激仔猪产生体液免疫反应,且免疫反应强度间差异并不显著,不过肌肉注射产生的免疫反应持续时间更长。 图1 各组猪血清中gB抗体检测结果(N:阴性;P:阳性)Fig.1 Results of gB antibody after immunization(N:Negative;P:Positive) 图2 各组猪血清中和效价的检测结果Fig.2 Results of serum neutralization titer after immunization 2.3 仔猪血清中IFN-γ水平测定结果 免疫前3组仔猪血清中IFN-γ含量并无显著差异(p>0.05);一免后第14 d口服组和肌注组的IFN-γ产生时间及含量水平并无显著差异(p>0.05),分别为382.614±25.507 pg/mL,369.525±18.932 pg/mL,极显著高于对照组224.214±5.876 pg/mL(p<0.01),而在二免后第7 d,口服组的IFN-γ含量(354.458±24.755 pg/mL)极显著高于对照组(267.547±30.066 pg/mL)(p<0.01),肌注组与对照组间差异不显著(p>0.05);二免后第14 d,肌注组IFN-γ含量上升(362.614±25.507 pg/mL),与口服组(344.726±33.010 pg/mL)无显著差异(p>0.05),但均极显著高于对照组(248.648±24.181 pg/mL)(p<0.01)(图3)。通过两种免疫途径免疫该弱毒株均能有效地诱导仔猪产生IFN-γ,二免后口服组IFN-γ含量增加比肌注组更快。表明两种方式免疫该弱毒株均能诱导仔猪产生细胞免疫应答,一免后两种免疫方式所诱导的细胞免疫反应无显著差异,值得注意的是,二免后口服方式所产生的细胞免疫应答更为迅速。 图3 免疫后各组猪IFN-γ含量的检测结果Fig.3 Results of IFN-γ level after immunization 2.4 免疫后血清中PCV2-Cap抗体变化 免疫前各组动物PCV2-Cap抗体均为阳性(母源抗体),各组间S/P值无显著差异;一免后第14 d,口服组仔猪血清抗体阳性率下降至80%(4/5),并在一免后28 d继续下降至40%(2/5),不过在二免后第7 d全部转阳,而后在二免后14 d PCV2-Cap抗体阳性率降至60%(3/5),并维持至二免后28 d;注射组则直到二免后14 d才降低至80%(4/5),并持续至二免后21 d,随后继续下降至60%(3/5);值得注意的是对照组的抗体阳性率直到二免后28 d才下降至66%(2/3)(图4)。表明该重组弱毒株并不能诱导具有PCV2母源抗体的保育猪产生针对PCV2的体液免疫应答,反而会中和部分的PCV2母源抗体,不建议对PCV2母源抗体阳性保育猪使用该疫苗。 2.5 免疫前后及攻毒前后各组猪体温变化 两种途径免疫重组弱毒株后均未引起猪体温升高,攻毒后第2 d,所有猪体温均升高至41℃以上,口服组与肌注组在第5 d体温下降至41℃以下,对照组则持续至第7 d(图5)。免疫该重组弱毒株能够使猪在攻毒后更快的恢复正常体温。表明该重组弱毒株安全性良好,并且能够缩短动物感染PRV后高热时长,具有临床保护力。 图4 免疫后各组猪PCV2抗体阳性率Fig.4 Positive rate of antibodies against PCV2 图5 免疫前后(A)和攻毒前后(B)各组猪体温变化Fig.5 The body temperature changes after immunization(A)and challenge(B) 2.6 攻毒后各组猪临床表现 攻毒后第2 d,所有猪均出现打喷嚏、流鼻涕等症状,对照组猪精神浓郁、流鼻涕、呼吸困难等症状持续至第9 d才开始减轻,肌注组猪第5 d开始进食,鼻液减少,体温下降,少量咳嗽,口服组则在第6 d症状开始减轻(图6)。免疫该重组弱毒株能够有效地保护动物,减轻减少其临床症状,并且能够使其更快的恢复健康。进一步表明该重组弱毒株能够提供较好的临床保护力,并且肌肉注射的免疫途径相较于口服免疫途径更好,不过口服途径具有易于投服,省时省力的优点。 图6 攻毒后各组猪临床表现的打分情况Fig.6 Clinical symptoms after challenge 2.7 免疫前后及攻毒前后各组猪平均日增重 免疫后各组猪平均日增重分别为0.376±0.022 kg/d,0.384±0.024 kg/d,0.373±0.027 kg/d,3组间无显著差异(p>0.05);攻毒后口服组和肌注组猪日增重均显著高于对照组(p<0.05),分别为0.360±0.122 kg/d,0.286±0.051 kg/d,-0.177±0.085 kg/d,口服组与肌注组间差异不显著(p>0.05)(图7)。进一步表明该重组弱毒株安全性良好,并且能够预防动物感染PR后引起的消瘦症状,具有临床保护力。 2.8 各组猪病毒载量的荧光定量PCR结果 攻毒前各组猪鼻、粪拭子中均未检测到病毒拷贝,攻毒后第1 d鼻拭子中开始有少量排毒,第3 d达到排毒高峰,口服组排毒量显著低于对照组(0.01 攻毒后第3 d口服组、肌注组和对照组猪肛拭子中病毒载量分别为1×100.516±0.101拷贝/mL,1×100.610±0.125拷贝/mL,1×101.216±0.069拷贝/mL,口服组与肌注组肛拭子中的病毒载量极显著低于对照组(p<0.01),3个组猪排毒高峰在攻毒后第2 d~6 d。 攻毒第12 d后口服组与注射组鼻拭子与肛拭子中仅有极少量病毒,而对照组在攻毒后第14 d仍然能从鼻拭子和肛拭子中分别检测到1×101.212±0.164拷贝/mL和1×100.375±0.042拷贝/mL的病毒(图8)。 以上结果显示攻毒后,免疫组虽然不能完全阻止排毒,但是均能有效的减少排毒量和缩短排毒期。表明口服和肌肉注射两种途径免疫该弱毒株的免疫效果相近,均有效减少了感染猪的排毒量,降低了PRV在群间水平传播的风险。 图7 免疫前后(A)和攻毒前后(B)各组猪的日增重Fig.7 Daily weight gain after immunization and challenge 2.9 病理切片观察 在镜下观察可见攻毒后对照组猪脑组织中均出现胶质细胞结节、血管袖套现象(血管周围炎性细胞浸润)、卫星现象、噬神经元现象等非化脓性脑炎病理变化,口服组与肌注组猪脑组织中仅出现少量的噬神经元现象和小胶质细胞增生;对照组扁桃体隐窝腔内含有大量脱落的隐窝上皮细胞、白细胞和炎性渗出液,口服组与肌注组猪仅见少量淋巴细胞增生(图9)。表明免疫该重组弱毒株能够有效的防止病毒对组织细胞造成的病理损伤。 口服免疫相较于常规免疫方式具有多种优点:操作更方便,适用于大规模全群免疫;减少人员,节约注射器,减少猪的应激;避免针头重复利用带来的交叉污染;能同时诱发粘膜免疫反应和系统免疫反应等[11]。 图8 攻毒后各组猪的鼻拭子和肛拭子样品中的病毒含量Fig.8 Quantification of PRV DNA load in nasal swab and rectal swab after challenge 图9 各组猪组织病理切片结果Fig.9 Histopathological section results 本研究实验猪免疫三基因缺失重组弱毒株PRV-HNX-TK-/gE-/gG-+PCV2 ORF2后血清gB抗体检测结果表明口服免疫与肌肉注射均能有效的诱导机体产生gB抗体,结合免疫后血清对PRV HNX株的中和效价结果,表明通过口服免疫同样能诱导机体产生有效体液免疫反应,但是其反应时间较滞后。值得注意的是,第二次免疫对体液免疫水平的激发强度低于初次免疫,这可能是由于体内的抗体中和了部分弱毒,导致实际的弱毒滴度下降。因此,在设计免疫程序的时候应避免在抗体水平高时使用活疫苗,该结果也与谭鑫等人的研究结果相印证[12];然而该重组弱毒株并不能有效的诱导具有PCV2母源抗体的保育猪产生高水平抗体,反而会中和部分的PCV2母源抗体。因此,不推荐在保育猪体内具有PCV2母源抗体时使用该重组弱毒株;在细胞免疫方面,免疫后口服组与肌肉注射组IFN-γ水平均升高,但在二免后口服组细胞免疫的响应速度与水平均高于肌肉注射组,表明口服组表现出了更快更强的细胞免疫应答。因此,在使用该弱毒株对存在母源抗体的猪进行免疫时,单纯的通过体液免疫水平进行免疫效果的评价并不全面,应结合细胞免疫水平进行分析。 本研究实验猪免疫后进行攻毒,结果显示口服与肌注两种免疫途径均能为猪提供一定的临床保护力,使其更快的恢复正常体温与日增重,而未免疫的猪均出现了持续咳嗽、喘气、高温、体重下降等临床症状;病理切片结果也表明这两种免疫方式均能阻止PRV对组织细胞造成损伤,母源抗体仅能保护猪不发生死亡,但并不能有效阻止猪出现临床症状;两种免疫途径均能降低排毒量但不能完全阻止排毒,这提示在养殖过程中,若发生免疫猪PRV野毒抗体转阳,应立即淘汰阳性猪、对猪舍进行消毒、紧急免疫未发病猪,防止猪群间交互感染。 本研究对PRV-HNX-TK-/gE-/gG-+PCV2 ORF2重组弱毒株初步尝试经口服途径进行免疫,证明了口服免疫该重组弱毒株对猪的免疫效果与肌肉注射相近,能同时诱发猪的体液免疫和细胞免疫,并且能够为猪提供较好的临床保护力,不过并不能使PCV2母源抗体阳性保育猪产生高水平的PCV2抗体。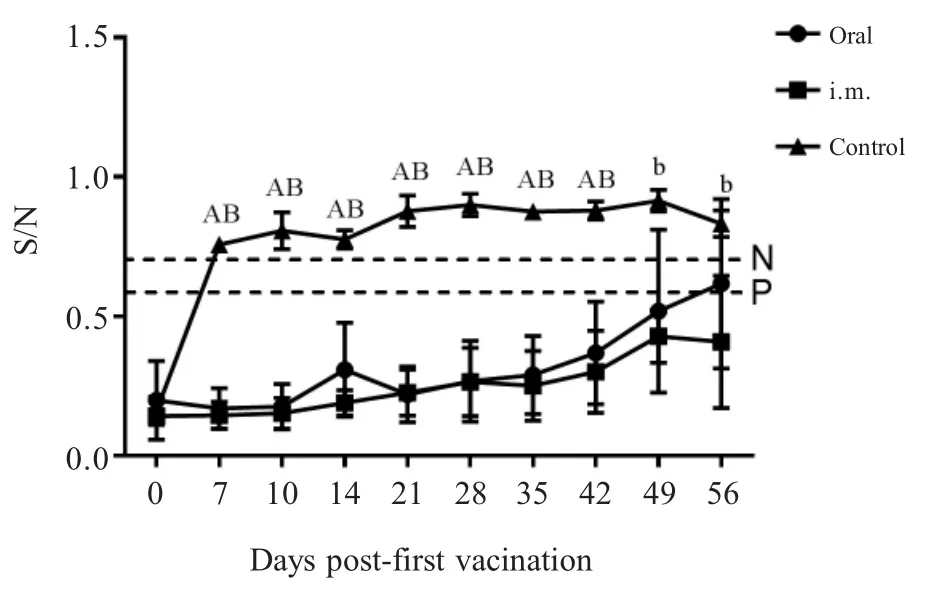


3 讨论