肌萎缩侧索硬化症病程中骨骼肌内铁沉积及其调节
王绍晔,李昊,张皓云,张雅雯,陈燕春,蒋欣,孙菡聪,周彩霞,高莹
(潍坊医学院 1 山东省神经疾病与再生修复重点实验室,2 生物科学与技术学院,3 临床医学院,潍坊261053)
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种选择性累及上、下运动神经元的致死性神经退行性疾病,主要病理改变为进行性大脑皮层、脑干、脊髓上下运动神经元选择性丢失,临床表现为进行性全身骨骼肌萎缩、从而影响患者运动、语言及呼吸功能,最终因呼吸肌麻痹而亡,发病后生存期约为3-5 年[1],目前该病发病机制不清。
散发性ALS (sporadic amyotrophic lateral sclerosis, SALS)及家族遗传性ALS (familial amyotrophic lateral sclerosis, FALS)均检测到铁异常沉积, ALS患者血浆中铁蛋白ferritin 水平升高,而转铁蛋白transferrin 水平降低,提示ALS 病理进程中存在铁代谢异常[2]。ALS 动物模型的脑脊液及运动皮层也观察到铁积聚[3,4]。铁是我们生命中的重要微量金属元素,参与机体基因表达、酶促反应、电子传递等多种生理活动。但铁具有氧化还原的化学性质,体内游离铁,既非血红素结合铁(non-heme iron, NHI)增多,可以通过Fenton 反应形成包括羟自由基(hydroxyl radical, OH·)等在内的多种活性氧(reactive oxygen radical species, ROS)物质,造成组织细胞氧化应激损伤,因此铁的转运、储存、利用受到严格控制[5-8]。
随研究深入,骨骼肌内铁代谢与ALS 神经退行性变间的关联受到普遍关注。骨骼肌是机体重要器官,约占体重40%,在机体能量代谢、蛋白储存、肢体运动等方面发挥重要作用。Halon 等人[9]在ALS转基因大鼠模型中观察到骨骼肌铁代谢异常早于运动功能异常,发病前期可在骨骼肌中检测到铁积聚及脂质、蛋白质过氧化。并且研究者指出,铁沉积可能与血中hepcidin 表达改变及骨骼肌内铁转出蛋白ferroportin1(FPN1)、铁存储蛋白ferritin H 等表达变化有关。
本研究利用ALS 转基因小鼠模型检测其骨骼肌中参与铁代谢的相关转运蛋白,如铁转入蛋白二价金属离子转运蛋白1(divalent metal transporter-1,DMT1)及铁转出蛋白FPN1 随ALS 疾病进展的表达变化、与骨骼肌铁沉积的关系及其可能调控机制。
材料与方法
1 动物模型
表达人源突变SOD1G93A基因的转基因小鼠(B6SJL-Tg SOD*G93A-1Gur/J,ALS 鼠)购自美国Jackson Laboratory (ME, USA)。雌雄不限,以同窝野生型鼠(wild type, WT 鼠)作为对照鼠。实验动物置于室温23±2℃,50%~60%相对湿度,12h 明暗交替环境条件下饲养。动物处置均获得潍坊医学院动物伦理委员会批准。
2 主要试剂
普鲁士蓝染色试剂盒(Perl’s stain,核固红法)购自索莱宝生物技术有限公司,GAPDH 兔源多克隆抗体、辣根过氧化物酶标记山羊抗小鼠及山羊抗兔 IgG抗体均购自Cell Signaling 公司,小鼠抗DMT1、兔抗FPN1、兔抗铁调节蛋白1(iron regulatory protein1,IRP1)抗体购自Abcam 公司,ECL 化学发光试剂盒购自Thermo Fisher Scientific 公司。
3 铁染色
模型鼠分别于生后70d(发病前期)、95d(发病早期)、108d(发病期)、122d(发病后期)以10%水合氯醛腹腔注射麻醉,4%多聚甲醛灌注固定,分离后肢腓肠肌组织,4%多聚甲醛后固定过夜,梯度蔗糖沉淀后制作冰冻切片。切片(7μm)经去离子水漂洗后,应用普鲁士蓝染色试剂盒进行染色,参照说明完成。脱水、透明、封片后,油镜(100×)下观察、拍照。
4 Western blot
模型鼠分别于生后70d、95d、108d、122d 以10%水合氯醛腹腔注射麻醉后,断颈处死,剥取腓肠肌组织并剪碎,加入RIPA 裂解液,超声破碎提取总蛋白,BCA 法测定蛋白浓度。取60μg 蛋白样品SDS-PAGE 凝胶电泳,并转移至醋酸纤维素膜,10%脱脂奶粉/TBST 封闭液室温封闭1h,分别加入小 鼠 抗DMT1(1∶1000)、兔 抗FPN1(1∶500)、IRP1(1∶1000)、GAPDH(1∶2000)一抗,4 ℃孵育过夜。TBST 漂洗后,以辣根过氧化物酶标记山羊抗小鼠或山羊抗兔二抗(1∶5000)室温孵育1 h,加入 ECL 进行发光反应,凝胶成像系统成像(美国ProteinSimple 公司),使用Image J 软件进行条带灰度分析。
5 统计学处理
实验结果采用均数±标准误表示,应用Graph-Pad Prism 5 统计软件采用t-test分析蛋白表达差异,P<0.05 表明差异有统计学意义。
结 果
1 ALS 鼠骨骼肌内铁沉积
铁染色结果显示, 95d、108d、122d ALS 鼠腓肠肌萎缩逐渐加重,肌纤维排列不规则。各时间点WT 鼠腓肠肌切片中少见铁染色阳性细胞;108d、122d ALS 鼠切片中见铁染色阳性细胞显著增多,沉积物呈蓝色颗粒状,位于胞质内(图1)。
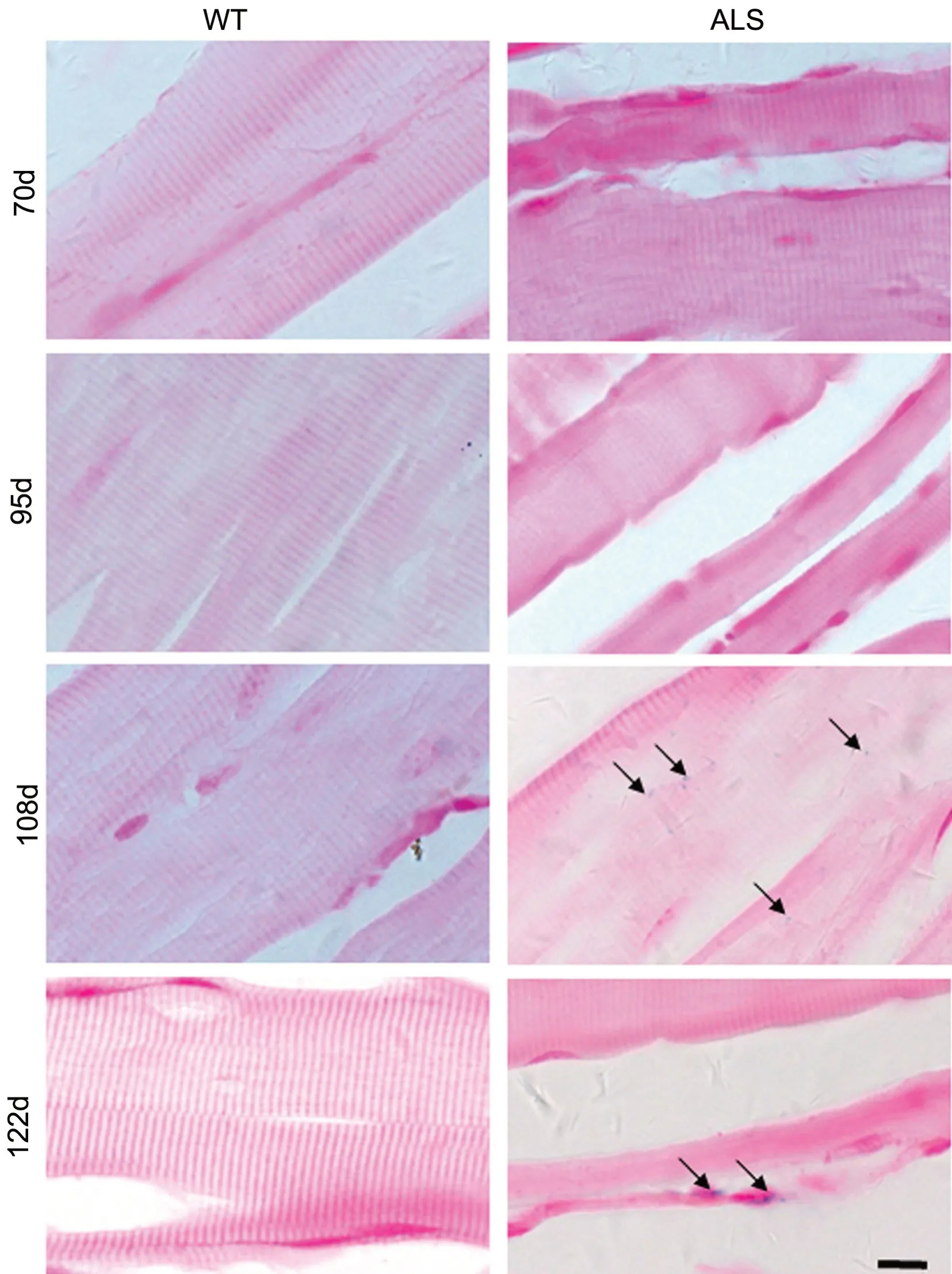
图1 普鲁士蓝染色检测WT 及ALS 鼠腓肠肌内铁沉积。箭示细胞内铁沉积物呈蓝色颗粒状。比例尺,10 μmFig.1 Iron deposition in the gastrocnemius muscle of WT mice and ALS mice detected by Perls Prussian Blue Staining. The arrows showed blue granules of iron deposition inside cells. Scale bar, 10μm
2 骨骼肌内铁转运相关蛋白表达动态改变
Western blot结果显示,随疾病进展,ALS鼠骨骼肌中铁转入蛋白DMT1 较同时间点WT 鼠呈现增高趋势,且在70d、122d 差异有统计学意义(P<0.01)(图2A、2B)。铁转出蛋白FPN1 在70d ALS 组表达略高于WT 组,随后呈现降低趋势,但由于个体差异较大,无统计学意义(图2C、2D)。以上结果提示,随病程进展ALS 鼠骨骼肌内铁转入较转出增多,导致骨骼肌内铁负载。
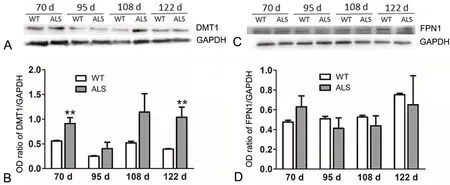
图2 WT 及ALS 鼠腓肠肌内DMT1(A、B)、FPN1(C、D)蛋白动态表达变化。**,与同时间点WT 鼠相比,P<0.01Fig. 2 Dynamic expression changes of DMT1(A, B), FPN1(C, D) in the gastrocnemius muscle of WT mice and ALS mice detected by Western blot. **,P<0.01, compared with WT mice of the same time point
3 铁调节蛋白IRP1 表达动态改变
Western blot 结果显示,与WT 鼠相比,ALS 鼠骨骼肌中铁调节蛋白IRP1 在70d、95d 表达降低,而108d、122d 表达有升高趋势,但仅108d 时升高有统计学意义。
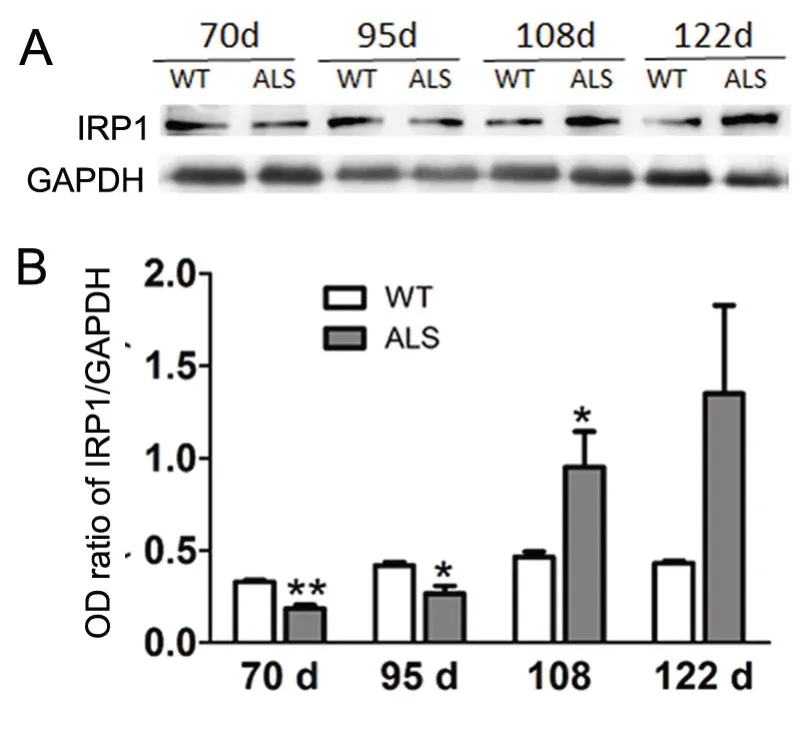
图3 WT 及ALS 鼠腓肠肌内IRP1 蛋白动态表达变化。与同时间点WT 鼠相比:*,0.01<P<0.05;**,P<0.01Fig.3 Dynamic expression changes of IRP1 in the gastrocnemius muscle of WT mice and ALS mice detected by Western blot. *, 0.01<P<0.05; **,P<0.01, compared with WT mice of the same time point
讨 论
ALS 的发病机制不清,研究显示与氧化应激、神经炎症等密切相关。并且有研究者提出,ALS 属于远端轴突变性疾病,由源于所支配骨骼肌的“dying back”信号导致运动神经元进行性退变[10]。骨骼肌是机体内的重要器官,除完成躯体运动功能,还是体内重要的铁储库,储存机体10%~15%的铁[11],且以NHI 为主[12]。规律运动锻炼可提高机体对胰岛素的敏感性,影响体内铁代谢,加强骨骼肌锻炼可减少机体铁储存。骨骼肌内铁过载不仅直接影响骨骼肌收缩功能,同时也会间接影响其支配神经元,从而影响神经退行性疾病的结局[13]。
本研究中我们观察到,在发病期及发病后期(108d、122d)SOD1G93A转基因小鼠腓肠肌内有显著铁沉积。Halon 等应用ALS 大鼠模型同样观察到发病期及发病后期骨骼肌内NHI 增加[9]。铁的跨细胞转运由细胞膜上铁转运相关蛋白完成,铁转入蛋白包括转铁蛋白受体1、DMT1 等;而FPN1 是目前已知唯一参与细胞内铁转出的转运蛋白[14]。我们在ALS 小鼠模型检测到,从发病前期开始随疾病进展,ALS 鼠骨骼肌中DMT1 表达均较WT 鼠增高,而FPN1 表达呈现降低趋势,因此推测ALS 病程早期由于骨骼肌铁转运异常,可出现细胞内铁过载,参与骨骼肌氧化应激损伤,推进ALS 进程,与前人的研究结果一致[9]。
DMT1、FPN1 mRNA 的3’或5’端存在铁反应原件(iron responsive element,IRE),可与IRPs 相互作用发生转录后调节。IRPs 与DMT1 3’端IRE 结合,稳定mRNA,促进DMT1 翻译,实现对DMT1 的正调控;与FPN1 mRNA 5’端IRE 结合导致mRNA降解,抑制其翻译,表现出对FPN1 表达的负调效应[15]。IRPs 包括IRP1 和IRP2,机体内IRP1 表达量高,且与IRE 亲和力强,因此本研究检测ALS 模型鼠腓肠肌内IRP1 的动态表达变化。我们观察到ALS鼠腓肠肌内IRP1 表达随疾病进展先降低,后增高的趋势。IRP1 表达变化除受细胞内铁含量的影响,还受机体氧化应激状态的调节,过氧化氢及NO可诱导IRP1 激活[16,17],从而形成恶性循环促进细胞内铁沉积,本研究中IRP1 的动态变化可能与此有关。实验中我们观察到FPN1 表达的动态变化趋势符合其受IRP1 转录后负调控的变化。但70d、95d DMT1 表达变化未体现IRP1 的转录后调节。DMT1 的蛋白表达调控较为复杂,DMT1 mRNA 存在四种剪接体,分别DMT1A、DMT1B、DMT1 无IRE 型(DMT1-IRE)、DMT1 有IRE 型(DMT1+IRE),除IRPs-IRE 调节系统外,还可受到其它的一些信号机制,如NFκB、Nrf2 等核转录因子的调节[15,18],需要在后续研究中深入探讨。
本研究结果揭示,在ALS 病程早期骨骼肌内铁转运相关蛋白受IRP1 等调节发生异常改变,参与局部铁过载,或推动ALS 疾病进展。

