全麦粉对体外肠道菌群的影响
, , ,
(北京工商大学,食品添加剂与配料北京高校工程研究中心,北京 100048)
小麦是世界上最重要的粮食作物,总产量最高,总贸易量最大,栽培面积和分布面积最广[1]。全麦粉包含完整的胚芽、胚乳和麸皮,麸皮和胚芽中含有丰富的生物活性化合物,包括B族维生素、矿物质、必需氨基酸、维生素E和植物化学素[2]。而人们经常食用的面粉,即精致小麦则去掉了麸皮和胚芽,仅保留胚乳部分[3]。随着人们生活水平的改善,精制面粉占据大部分市场,与此同时,各种慢性疾病如肥胖、糖尿病、癌症等发生的风险也越来越高[4]。全麦粉较精制小麦粉而言,含有较多的营养成分和植物化学素,一方面这些成分保持原生状态并存在着协同增效作用,另一方面,某些物质不被人体内源性消化酶所水解,直接进入大肠被肠道微生物发酵利用产生代谢产物,维持肠道健康,故增加全谷物的摄入更有利于人体健康。
肠道菌群是一个庞大复杂的生态系统,一个健康成人肠道处居住着500~1000种细菌,总数达1013~1014,是人体体细胞的10倍之多,它们编码的基因是人体自身基因的100倍,大量研究表明肠道菌群组成的结构和比例与人体健康状况存在着密切的联系[5]。全麦粉相比于精制小麦粉,外层的麸皮富含纤维、抗性淀粉和低聚糖,内层胚芽含有维生素、矿物质、多酚等有益物质,这些物质的存在可能会降低血糖指数或血糖负荷,改善糖代谢,并减少超重和肥胖的发生[6]。研究表明全谷物中的膳食纤维易吸水膨胀,可增加人体饱腹感,有利于减少食物的摄入,具有减少肠道间有毒物质残留,预防痔疮、便秘、调节肠道微环境等功效[7]。
本文选用山东小麦,用分层碾米机磨去外层麸皮得到小麦籽粒,全麦粉由麸皮与籽粒经研磨得到,精制小麦粉由小麦籽粒研磨得到,依次进行体外模拟消化和发酵实验,实验设置阴性(NC)及阳性(PC)对照,阴性对照不添加小麦粉,阳性对照选择低聚果糖。通过比对全麦粉与精制小麦粉成分区别、以及不同组肠道菌群结构变化与代谢产物的区别,研究了全麦粉和精制小麦粉对肠道菌群调节的影响,旨在通过肠道菌群的视角呼吁大众多食用全谷物。
1 材料与方法
1.1 材料与仪器
小麦 山东沂蒙山新小麦,由中国农业科学院农产品加工研究所提供;α-淀粉酶(1 kU/g)、胃蛋白酶(8 kU/g)、胰液素 美国sigma公司;猪胆盐、低聚果糖、透析袋(1000 Da) 上海源叶生物有限公司;胰蛋白胨酵母浸粉 北京奥博星生物技术有限公司;无水氯化钙、磷酸氢二钾、氢氧化钠、碳酸氢钠、碳酸钠、磷酸二氢钠、磷酸氢二钠 分析纯,西陇化工股份有限公司;七水硫酸镁、树脂天青、维生素K1、氯化血红素 分析纯,麦克林公司;L-半胱氨酸、吐温80 国药集团化学试剂有限公司;β-葡聚糖试剂盒 爱尔兰Megazyme公司;DNA提取试剂盒 美国Omega公司;DNA凝胶回收试剂盒 美国Axygen公司。
AL203电子天平 梅特勒-托利多仪器有限公司;YXQ-LS-50A高压灭菌锅 上海云泰仪器仪表有限公司;TM05C-C分层碾米机 佐竹机械(苏州)有限公司;FDV气引粉碎机 日本佑崎有限公司;DG250小型厌氧工作站 英国Don Whitley Scientific公司;920 Titrando恒定pH电位滴定仪 美国奥豪斯(上海)有限公司;Free-zoneRR实验室冻干机 美国LABCONCO公司;C-MAG HS 7磁力搅拌器 德国IKA公司;AOC-20i气相色谱(配有氢火焰离子检测器) 日本岛津公司;NanoDrop2000紫外分光光度计 美国赛默飞公司;LX-07A研磨机 红光工贸有限公司。
1.2 实验方法
1.2.1 精制小麦粉的制备及前处理 参照Gong等[8]方法,全谷小麦用分层碾米机磨去占总质量20%的外层麸皮后,剩下的籽粒即为精制小麦谷物。全谷小麦和精制小麦用气引式粉碎机粉碎,并过80目筛,分别得到全麦粉(whole wheat,WW)和精制小麦粉(refined wheat,RW)。
1.2.2 谷物粉基本成分及部分活性成分的测定 水分含量测定参照:GB5009.3-2010;灰分含量测定参照:GB5009.4-2010;脂肪含量测定参照:GB/T 5009.6-2003;蛋白质含量测定参照:GB5009.5-2010;膳食纤维含量的测定参照:GB/T 5009.88-2014;β-葡聚糖含量的测定方法参照试剂盒中AACC Method 32-23.01方法进行测定;多酚含量测定参照龚凌霄[9]的方法。
1.2.3 培养基的配制 胰蛋白胨2 g/L、酵母浸粉2 g/L、氯化钠0.1 g/L、磷酸氢二钾0.04 g/L、碳酸钠2 g/L、七水硫酸镁0.01 g/L、无水氯化钙0.01 g/L、吐温80 2 mL/L、氯化血红素50 mg/L、维生素K110 μL/L、L-半胱氨酸0.5 g/L、猪胆盐0.5 g/L、树脂天青1 mg/L。配成溶液后,用1 mol/L 盐酸调节基础培养基的pH=6.8,经高压灭菌后转移到厌氧工作站除氧24 h。
1.2.4 发酵菌液的采集与制备 选取自愿者3人,要求身体健康,没有胃肠病史,近半年来没有接受过抗生素的治疗。于实验当天采集3位志愿者的粪便各30 g左右,置于厌氧箱中,采集过程10 min内完成。用10倍量(w/v)的磷酸盐缓冲溶液(0.1 mol/L,pH=6.8)稀释采集的粪便,混匀后静置用四层纱布滤去残渣即为发酵菌液。
1.2.5 体外模拟胃肠道消化和发酵过程 参照曹文燕等[10]方法,取WW与RW各12 g,分别加入100 mL去离子水在121 ℃条件下灭菌15 min冷却后再加入100 mL无菌蒸馏水,得全麦粉与精制小麦粉悬浊液;于悬浊液中加入7 mL(20 U/mL)α-淀粉酶溶液,在37 ℃恒温水浴振荡器中培养30 min以模拟口腔消化;用6 mol/L盐酸调节pH=2,加入5 mL 0.1 mol/L盐酸(含0.54 g胃蛋白酶),37 ℃恒温水浴振荡器培养2 h,模拟胃消化;用6 mol/L氢氧化钠调节pH=6.8,并加入25 mL 0.5 mol/L碳酸氢钠(含0.11 g胰液素和0.7 g猪胆盐),放入1000 Da的再生纤维素透析袋中,在0.1 mol/L氯化钠溶液,37 ℃过夜透析,第2 d更换一次透析液,再透析2 h,模拟小肠消化;将透析袋中的消化乳糜低温真空冷冻干燥得消化糜粉。取消化糜粉0.5 g,与45 mL培养基(按照1.2.3制备)、5 mL发酵菌液(按照1.2.4制备)充分混匀后在37 ℃厌氧条件下发酵48 h,模拟大肠消化;分别于24和48 h取部分发酵液用于菌群多样性和短链脂肪酸分析。实验设置阴性及阳性对照,其中,阴性对照即以0.5 g纯净水代替消化糜(NC),阳性对照即0.5 g低聚果糖代替消化糜(PC)。
1.2.6 新一代16S rRNA测序技术对菌群多样性分析 参照试剂盒Stool DNA kits提取发酵液中总的DNA,用紫外分光光度计于260 nm测定OD值,并用1%的琼脂糖凝胶电泳对DNA进行检测。扩增细菌的16S区域V4区,扩增引物515F(5′ GTGCCAGC MGCCGCGGTAA 3′)和806R(5′ GGACTACHVGGG TWTCTAAT 3′),在引物的5′端加上合适的Hiseq2500 PE250测序的index序列和接头序列,完成特异性引物的设计。以稀释后的基因组DNA为模板,使用KAPA HiFiHotstart ReadyMix PCR kit高保真酶进行PCR[11],确保扩增的准确性和高效性。用2%的琼脂糖凝胶电泳检测PCR产物,并用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物。切胶回收后,用紫外分光光度计和1%的琼脂糖凝胶电泳进行文库质检。质检合格后,使用Illumina Hiseq PE250进行上机测序。测序结束后,按照相似度97%进行聚类,得到OTU(Operational Taxonomic Units),每个OTU被认为可以代表一个物种。
1.2.7 气相色谱(GC)测定发酵液中短链脂肪酸(SCFA)含量
1.2.7.1 样品前处理 取发酵24、48 h的2 mL发酵液,加0.2 mL 50% H2SO4酸化10 min,再加2 mL乙醚在冰上间歇震荡提取30 min,后于4800 r/min离心10 min,取上清液进样[12]。
1.2.7.2 色谱条件色谱柱 SH-Rtx-5柱(30 m×0.25 mm×0.25 μm);以氮气作为载气,总流速为140 mL/min;进样量1 μL,进样口温度280 ℃,FID检测器温度300 ℃,不分流;采用程序升温:80 ℃;3 ℃/min,150 ℃;20 ℃/min,250 ℃,2 min[13]。
1.2.8 相关性分析 利用Pearson对发酵液中SCFA与肠道菌群的变化量相关性进行分析。
1.3 数据处理
2 结果与分析
2.1 基本成分分析
从表1可知,全麦粉(WW)中膳食纤维含量显著高于精制小麦粉RW(p<0.05),达12.45%,与赵吉凯等[14]研究一致,碾磨脱去小麦籽粒总质量20%的外层麸皮(主要含有纤维素、半纤维素和木质素),RW中总膳食纤维降低了33.1%。WW中总酚含量显著高于RW(p<0.05),达2765.50 μg GAE/g,与向莉[15]对黑小麦多酚含量的测定相近。除此之外,WW中蛋白质、脂肪含量也显著高于RW(p<0.05)。研究表明,WW较RW在成分组成上,膳食纤维和多酚等可被微生物发酵利用的成分含量显著增加(p<0.05),分别为精制小麦粉的1.49倍和1.45倍。
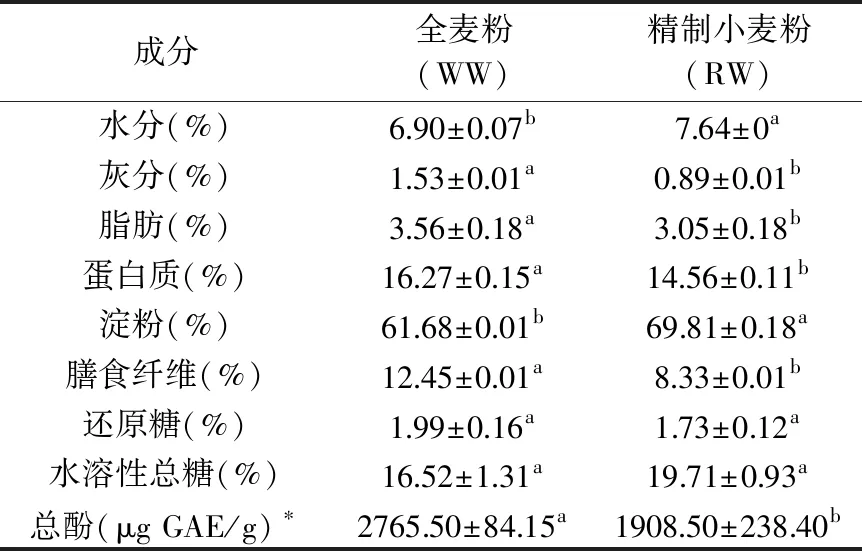
表1 基本成分Table 1 Component of samples
2.2 小麦粉对体外发酵肠道微生物的α-多样性的影响
从图1可知,随着测序深度的延长,曲线趋于平缓,这表明本实验测序深度挖掘的信息量足够本实验分析[16]。用Observed species指数、Chao1指数、ACE指数、Shannon指数来评价微生物α-多样性,从表2可知,与阳性和阴性对照组相比,WW和RW微生物多样性下降,WW下降更多,产生这种结果可能是由于WW和RW中复杂的化学组成在体外进行发酵后,打破了原有体系中微生物之间的平衡,刺激了某些微生物的生长,导致微生物-微生物之间产生竞争作用,降低了微生物多样性。杜亚军[17]研究了7种水溶性膳食纤维发现显著促进了双歧杆菌或嗜酸乳杆菌的生长,而嗜酸乳杆菌或双歧杆菌的增殖对大肠杆菌的生长产生了抑制作用。这表明某些微生物的生长会改变另一些微生物的生长情况,与本文的研究结果一致。而随着发酵时间的延长,由于营养物质有限,微生物多样性呈现下降趋势。
图1 Shannon稀释曲线图Fig.1 Shannon rareation curve
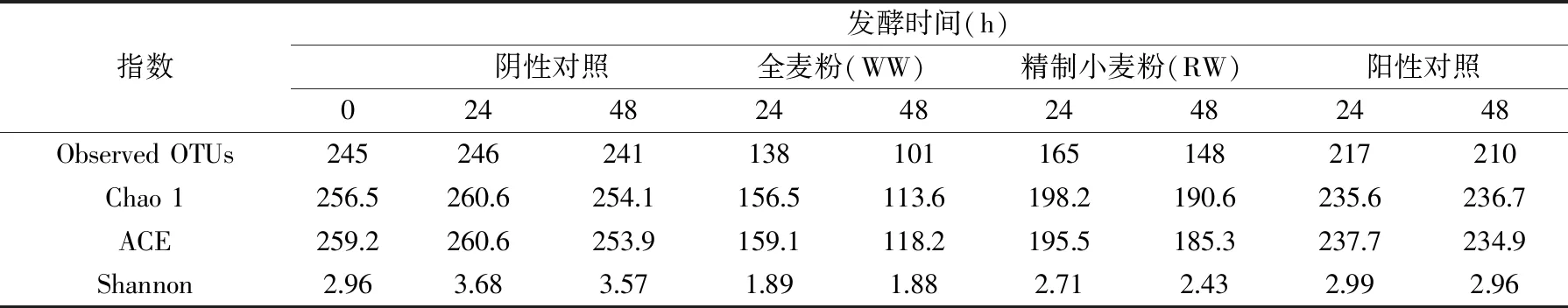
表2 α-多样性指数Table 2 Index of α-diversity
如图2所示,发酵24 h后,各组间共有OTU 103个,随着发酵时间的延长到48 h时,各组间共有OTU减少到74个。与阴性和阳性对照组相比,WW和RW发酵24 h后,特有OTU较少,分别为1和2个OUT,发酵48 h后特有OUT则减少为0和1个,这同样也表明了WW和RW发酵后微生物多样性降低。
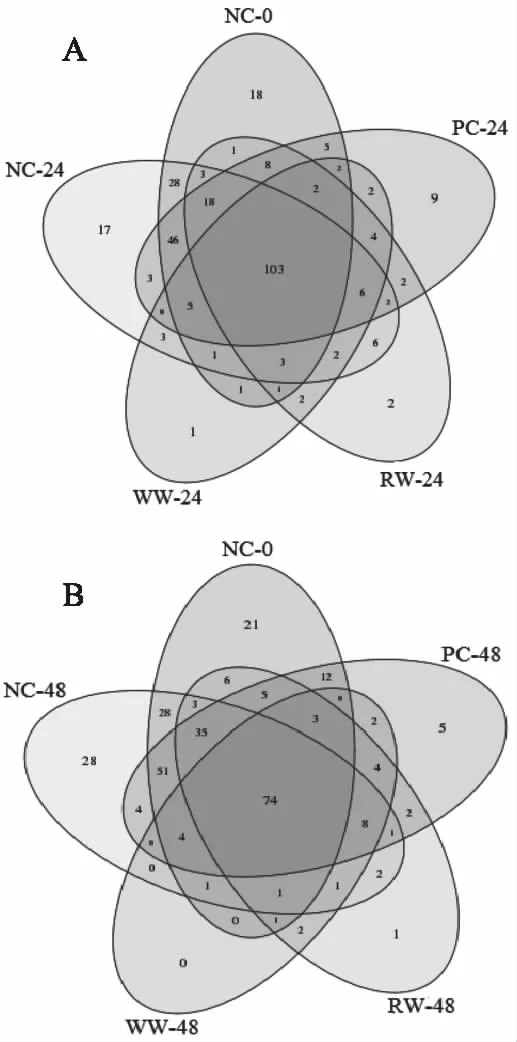
图2 不同发酵时间Veen图Fig.2 Veen diagram of different fermentation times
2.3 小麦粉对体外发酵肠道微生物物种组成的影响
图3A和图3B分别是物种在门和属的水平上进行的物种组成分析。变形菌门(Proteobacteria)为革兰氏阴性菌,包含大多数致病菌,如大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonella)等[18],与添加发酵基质组相比,图3A所示,阴性对照组(不添加发酵基质)中变形菌门相对丰度较高,高达13%~20%;WW组在体外发酵变形菌门相对丰度最低,比阴性对照组大约降低了5倍,这表明小麦中某一成分在体外发酵时抑制了变形菌门的生长繁殖。与阳性对照组相比,添加小麦发酵后在门的水平上发生了明显的变化,拟杆菌门(Bacteroidetes)降低,厚壁菌门(Firmicutes)升高,可能是谷物中成分刺激了厚壁菌门生长,厚壁菌门大量增殖占用了发酵液中的营养和空间,从而抑制了拟杆菌门的生长。
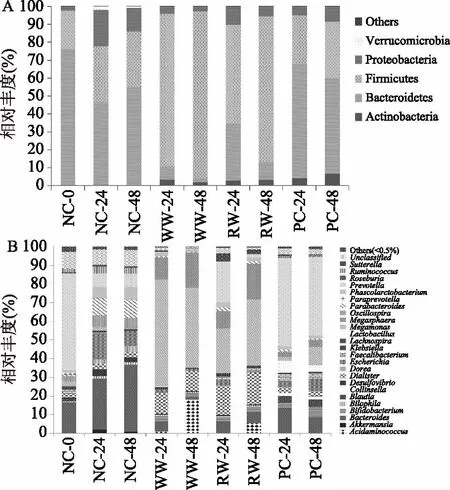
图3 相对丰度柱状图Fig.3 Relative abundance histogram注:A:在门的水平上;B:在属的水平上。
低聚果糖被公认为是一种益生元,低聚果糖能够刺激益生菌双歧杆菌(Bifidobacterium)[19]和乳酸杆菌(Lactobacillus)的生长,同时在体外能够维持普斯菌属(Prevotella)的生长[20]。与阴性对照组相比,添加小麦谷物发酵,降低了艾克曼菌属(Akkermansia)、拟杆菌属(Bacteroides)、噬胆菌属(Bilophila)、布劳特氏菌属(Blautia)、脱硫弧菌属(Desulfovibrio)、埃希式菌属(Escherichia)、梭菌属(Dorea)毛螺菌属(Lachnospira)、颤螺菌属(Oscillospira)、副杆菌属(Parabacteroides)、考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminoccus)的相对丰度,Jensen等[21]研究发现梭菌属(Dorea)、埃希式菌属、颤螺菌属和瘤胃球菌属可能会增加炎症发生的风险;升高了氨基酸球菌属(Acidaminococcus)、双歧杆菌属(Bifidobacterium)、小类杆菌属(Dialister)、克雷伯氏菌属(Klebsiella)、乳酸杆菌属(Lactobacillus)、巨单胞菌属(Megamonas)、和巨型球菌属(Megasphaera)相对丰度。与RW相比,WW发酵升高了氨基酸球菌属、双歧杆菌属、噬胆菌属、巨单胞菌属、巨型球菌属的相对丰度,且双歧杆菌属相对丰度是RW发酵的1.19倍,表明WW较RW更易刺激益生菌-双歧杆菌的增殖;降低了脱硫弧菌属、小类杆菌属、埃希式菌属(Faecalibacterium)、普斯菌属和萨特式菌属(Sutterella)的相对丰度,且埃希氏菌属相对丰度降低了52%。以上结果表明,体外添加小麦基质发酵后,会调节肠道微生物物种组成的变化,与RW相比,WW更易刺激双歧杆菌生长,抑制致病菌埃希氏菌的增殖。
2.4 短链脂肪酸(SCFA)含量的测定
SCFA主要是饮食中不被内源性消化酶所消化的乳糜物质进入大肠后被微生物利用发酵产生的代谢产物,是2~4碳组成的脂肪酸,在大肠处乙酸大约为60%,丙酸为25%,丁酸为15%,大部分的乙酸参与系统循环达到周边组织,丙酸主要被肝脏利用,然而大部分的丁酸作为结肠上皮细胞的能量物质被利用[22-23]。乙酸、丙酸与丁酸在肠道中的含量最高,是肠道中主要的短链脂肪酸[24]。此实验只对这三种短链脂肪酸做相应检测。由表3可得,与发酵48 h的阴性对照组相比,WW、RW发酵48 h后乙酸、丙酸、丁酸的含量均显著增加(p<0.05),且发酵48 h后WW中的乙酸含量与阳性对照组接近。本实验结果发现,发酵过程中WW和RW内的丙酸在短链脂肪酸中含量最高,这可能与接种源个体差异有关,De等[25]分别用10个不同的个体粪便发酵小麦麸皮,结果发现乙酸、丙酸和丁酸的比例和个人差异性有关。在物种组成分析(图3B)时,WW组和RW组在体外发酵后巨单胞菌属(Megamonas)和巨行球菌属(Megasphaera)丰度较高,达60%,Megamonas和Megasphaera是产丙酸盐的细菌[26],因此丙酸含量较高。
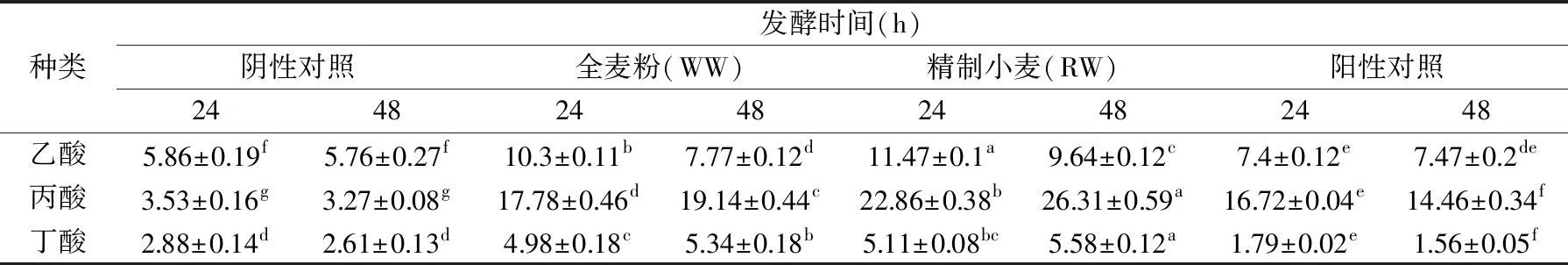
表3 发酵液中短链脂肪酸含量(mmol/L)Table 3 Short-chain fatty acid contents of fermentation broth(mmol/L)
2.5 短链脂肪酸(SCFA)与肠道菌群分布的相关性分析
经Pearson相关分析可以得知,短链脂肪酸中(乙酸、丙酸、丁酸)与肠道菌群的变化量存在相关性,如表4。其中,双歧杆菌属(Bifidobacterium)、小类杆菌属(Dialister)、普拉梭菌属(Faecalibacterium)、克雷菌属(Klebsiella)、巨单细胞菌属(Megamonas)、萨特氏菌属(Sutterella)、氨基酸球菌属(Acidaminococcus)、巨球型菌(Megasphaera)与乙酸、丙酸、丁酸存在显著正相关。说明这些菌属会促进短链脂肪酸的生成,如双歧杆菌属等有益菌会在肠道中分解消化糜中的碳水化合物以及蛋白质等物质产生短链脂肪酸,短链脂肪酸不但可以为上皮细胞提供能量来源,同时可以降低肠道pH,抑制炎症的发生,这就在代谢产物的角度验证了益生菌的益生作用所在。但艾克曼菌属(Akkermansia)、拟杆菌属(Bacteroides)、噬胆菌属(Bilophila)、布劳特氏菌属(Blautia)、脱硫弧菌属(Desulfovibrio)、梭菌属(Dorea)、埃希式菌属(Escherichia)、副杆菌属(Parabacteroides)、考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminoccus)、颤螺菌属(Oscillospira)等则与短链脂肪酸呈负相关,这说明短链脂肪酸抑制了抑制致病菌埃希氏菌属等致病菌的增殖。Pan等[27]研究表明益生菌(双歧杆菌属)的生长与SCFA的生产有关,与实验结果一致。

表4 发酵液中SCFA与肠道菌群分布之间的相关性系数分析表Table 4 Analysis table of correlation coefficient between SCFA in fermentation broth and intestinal flora distribution
3 讨论与结论
本实验研究了全麦粉(WW)和精制小麦粉(RW)在体外对肠道菌群的调节作用,结果表明,WW较RW在成分组成上,膳食纤维和多酚等可被微生物发酵利用的成分含量显著增加。体外添加小麦基质发酵降低了肠道微生物多样性,其中拟杆菌门相对丰度下降,厚壁菌门相对丰度升高,但明显增加了短链脂肪酸的含量并调节了肠道菌群的物种组成。被肠道微生物发酵利用后产生WW比RW更多的短链脂肪酸,而短链脂肪酸又与双歧杆菌属、小类杆菌属等一些益生菌有正相关作用,因此高含量的膳食纤维、多酚、短链脂肪酸与肠道菌群的丰度与多样性有密切的交互作用。此外,与RW相比,WW升高了发酵液中氨基酸球菌属、双歧杆菌属、噬胆菌属、巨单胞菌属、巨型球菌属等的相对丰度,且益生菌双歧杆菌属相对丰度是精制小麦粉发酵的1.19倍;降低了脱硫弧菌属、小类杆菌属、埃希式菌属、普斯菌属和萨特式菌属等的相对丰度,且致病菌-埃希氏菌属相对丰度降低了52%。由于全麦粉(WW)较精制小麦粉(RW)具有更好的调节肠道菌群、保护肠道健康的作用,因此在面粉加工处理上如果较多地保留外层麸皮中可被肠道微生物利用的益生元成分,即可以提升小麦粉的健康价值。

