佛手苷内酯对磷酸三钙磨损颗粒诱导骨细胞损伤的影响及机制*
杨子键,黄君瑶,高烨飞,黄文吉,徐世磊,金晶晶,万烨东,严 明,毛红娇,张 云△
(1. 绍兴文理学院医学院基础医学部,浙江 绍兴 312000;2. 杭州电子科技大学自动化学院生物医学工程系,浙江 杭州 310018)
人工关节假体植入体内后经过长期磨损、碰撞会产生大量的聚乙烯(polyethylene,PE)、钛(titanium,Ti)和磷酸三钙(tricalcium phosphate,TCP)等磨损颗粒,这些微米粒径的细小颗粒可激活假体周围单核/巨噬细胞、成纤维细胞和成骨细胞等组织细胞释放肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)、白介素1β(interleukin-1 beta,IL-1β)、白介素6(interleukin-6,IL-6)和前列腺素E2(prostaglandin E2,PGE2),以上破骨细胞活化这些因子可诱导破骨细胞形成和假体周围骨溶解,最终导致关节假体晚期松动及人工关节置换失败[1, 2]。假体周围除了含有上述组织细胞外,还存在着丰富的骨细胞(osteocyte),其数量占骨组织细胞的90%~95%。以往研究和本室前期实验结果表明磨损颗粒诱导假体周围骨细胞损伤及凋亡[3, 4],释放 TNF-α、IL-1β和IL-6等因子,促进假体周围炎症性骨溶解[1, 2, 5]。因此,骨细胞在磨损颗粒诱导的假体周围骨溶解中发挥重要的作用,是防治假体周围骨溶解及关节松动的一种新的靶细胞。
有研究显示双膦酸盐类药物可抑制循环疲劳载荷诱导或骨质疏松大鼠尺骨或椎骨中骨细胞活性降低,减少骨细胞凋亡[6, 7],阻止假体周围骨溶解和关节松动。但是,双磷酸盐类药物存在副作用多,不宜长期服用等缺点[8]。因此,寻找一种高效、毒副作用少,且能长期应用于阻止假体周围骨细胞损伤和凋亡,减轻假体周围骨溶解及关节松动的药物已经迫在眉睫。
佛手苷内酯(bergapten,BP,图1)是从佛手、当归和白芷等中药材中提取的一种天然香豆素类化合物,目前已用于炎症和肿瘤等方面的治疗[9-11]。有研究证实佛手苷内酯能明显促进成骨细胞增殖、分化及新骨形成[12],诱导破骨细胞及其前体细胞凋亡而抑制骨吸收[13],可用于治疗骨折、骨软化和骨质疏松症。但是,佛手苷内酯对TCP磨损颗粒诱导的骨细胞损伤的影响如何,目前尚不明确。本研究构建TCP磨损颗粒诱导的小鼠骨细胞MLO-Y4损伤体外模型,观察佛手苷内酯对TCP磨损颗粒诱导的骨细胞损伤及凋亡的影响,并阐明其可能作用机理,为佛手苷内酯用于防治假体周围骨溶解和关节松动提供一种新的治疗靶点。

Fig. 1 Chemical structure of bergapten (MW=216.19)
1 材料与方法
1.1 材料
TCP磨损颗粒由浙江大学化学系馈赠;小鼠骨细胞MLO-Y4由美国密苏里大学口腔学院Bonewald教授馈赠。佛手苷内酯(HPLC≥95%)购自上海源叶生物科技有限公司;α-MEM培养基、胎牛血清(FBS)和小牛血清(CS)购自美国Gibco公司;超敏ECL化学发光检测试剂盒购自杭州联科生物技术有限公司;Calcein-AM活体分子探针、MTT、TRIzol、BCA蛋白浓度检测试剂盒、RIPA裂解液和SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术研究所;Applied BiosystemTMSYBRTM试剂购自美国ThermoFisher Scientific公司;兔抗GRP78抗体、兔抗PERK抗体、兔抗phospho-PERK(p-PERK)抗体、兔抗eIF2α抗体、兔抗phospho-eIF2α(p-eIF2α)抗体、兔抗ATF4抗体、兔抗CHOP抗体、兔抗caspase-3抗体和小鼠抗β-actin抗体购自美国Cell Signaling公司;PVDF膜购自美国Millipore公司。
1.2 骨细胞MLO-Y4的培养
第39代小鼠骨细胞MLO-Y4复苏后加入含有2.5% FBS和 2.5%CS的α-MEM培养基中,置于37 °C、5% CO2及饱和湿度下常规培养,24 h后换新的培养基。当细胞80%~85%铺满培养瓶底时加入0.125%胰蛋白酶/0.01%EDTA消化2~3 min进行传代。
1.3 佛手苷内酯的毒性剂量研究
取骨细胞(1×104cells/ml)接种于96孔培养板中培养24 h,加入佛手苷内脂(0.2 μmol/L、1 μmol/L、5 μmol/L、20 μmol/L和40 μmol/L)孵育48 h后,加入MTT(5 mg/ml)温室避光孵育4 h;弃上清液后,加入二甲基亚砜(DMSO,200 μl)溶解甲瓒;充分振摇后,置于酶标仪测定OD490nm和OD690nm,计算各组骨细胞的活性变化,确定佛手苷内脂的毒性剂量。
1.4 TCP磨损颗粒诱导骨细胞损伤模型的制备及分组
取骨细胞MLO-Y4(1×104cells/ml)接种于96孔、24孔或6孔培养板中孵育24 h后,倾去培养基,加入TCP磨损颗粒(0.1 mg/ml)继续共孵育48 h建立骨细胞损伤体外模型。实验分为正常对照(Control)组、TCP磨损颗粒(TCP,0.1 mg/ml)组、佛手苷内酯(1 μmol/L)组、佛手苷内酯(5 μmol/L)组和佛手苷内酯(20 μmol/L)组。
1.5 MTT法和Calcein-AM染色检测细胞活性和形态的变化
取骨细胞(1×104cells/ml)接种于96孔培养板中培养24 h,采用筛选出的佛手苷内脂有效干预剂量(1 μmol/L、5 μmol/L、20 μmol/L)预孵育4 h后,加入TCP磨损颗粒(0.1 mg/ml)后分别继续孵育48 h。加入MTT(5 mg/ml)温室避光孵育4 h;弃上清液后,加入二甲基亚砜(DMSO,200 μl)溶解甲瓒;充分振摇后,置于酶标仪测定OD490nm和OD690nm,计算各组骨细胞的活性变化。
1.6 Calcein-AM染色观察骨细胞形态改变
取骨细胞(1×104cells/ml)接种于打孔皿中培养24 h,按照方法1.5处理。去除培养基后加入Calcein-AM(5 μmol/L)室温避光孵育30 min,PBS清洗后置于激光共聚焦下观察骨细胞形态和活性变化。
1.7 Hoechst3342染色观察骨细胞凋亡
取骨细胞(1×104cells/ml)接种于打孔皿中培养24 h,按照方法1.5处理。去除培养基后加入Hoechst 33342染色液(5 μmol/L)室温避光孵育5 min,PBS清洗2次后置于激光共聚焦下观察骨细胞核染色质聚集、核碎裂及胞质浓缩等情况。
1.8 流式细胞术检测细胞凋亡
取骨细胞(1×104cells/ml)接种于24孔培养板中培养24 h,按照方法1.5处理。然后通过消化获取骨细胞,经1 000 r/min离心10 min去除培养基,PBS清洗2次。 然后加入5 μl Annexin V-FITC/10 μl碘化丙啶(PI),避光室温37℃温育15 min。最后加入200 μl PBS并混匀后上流式细胞仪检测各组骨细胞凋亡情况。FITC的激发波长为488 nm,检测发射波长575 nm。
1.9 实时荧光定量PCR检测骨细胞特征蛋白的mRNA水平
取骨细胞(1×104cells/ml)接种于24孔培养板中培养24 h,按照方法1.5处理。。然后加入TRIzol法提取总RNA,反转录后应用Applied BiosystemTMSYBRTM试剂盒进行荧光定量PCR检测。设置程序:95℃ 5 min预变性,后以95℃ 30 s变性、56℃ 30 s退火、72℃ 40 s延伸等45个循环进行扩增,最后37℃ 30 s。导出扩增曲线,记录Ct值,以mRNA水平以相对定量(GADPH)表示,应用2-△△Ct测定,引物序列见表1。

Tab. 1 Sequences of PCR primers
1.10 Western blot检测PERK通路相关蛋白表达
取骨细胞(1×104cells/ml)接种于6孔培养板中培养24 h,按照方法1.5处理。。去除培养基后,每孔加入RIPA裂解液(100 μl)冰上裂解30 min。经13 000 r/min离心15 min上清液,利用BCA试剂盒检测各组蛋白浓度。各组蛋白经煮沸10 min,冷却后每孔上样30 μg蛋白,行12%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经5%脱脂牛奶常温封闭2 h后,分别加入兔抗GRP78抗体(1∶1 000稀释)、兔抗PERK抗体(1∶1 000稀释)、兔抗p-PERK抗体(1∶1 000稀释)、兔抗eIF2α抗体和兔抗p-eIF2α抗体(1∶1 000稀释)、兔抗ATF4抗体(1∶1 000稀释)、兔抗CHOP抗体(1∶1 000稀释)、兔抗capase-3抗体(1∶1 000稀释)和小鼠抗β-actin抗体(1∶1 000稀释)4℃孵育过夜。次日用TBST洗涤3次后加入HRP标记的二抗室温孵育2 h,TBST清洗3次加入ECL显色液;通过凝胶成像系统扫描分析各蛋白变化。
1.11 统计学处理
2 结果
2.1 佛手苷内酯对TCP磨损颗粒诱导骨细胞活性改变的影响
MTT活性检测结果显示:佛手苷内酯浓度在1~20 μmol/L范围内对正常骨细胞MLO-Y4无毒性作用,骨细胞活性变化不大(图2A)。而佛手苷内酯(40 μmol/L)可明显抑制MLO-Y4细胞增殖,细胞活性明显降低,仅为Control组的64.07%。据此,本研究选取1 μmol/L、5 μmol/L和20 μmol/L为干预剂量。
MTT检测和Calcein-AM染色结果表明:与Control组比较,TCP组骨细胞MLO-Y4活性显著降低,伪足明显减少,其细胞活性减少为Control组的 44.95%(图2B、图2C,P<0.05);与TCP组比较,佛手苷内酯处理组骨细胞活性及伪足明显增加,呈一定的剂量依赖性,细胞活性分别增加为TCP组1.04倍(1 μmol/L)、1.53倍(5 μmol/L)和2.19倍(20 μmol/L)(图2B、图2C,P<0.05)。

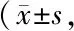
A, B: Cell viability measured by MTT;C: Representative morphology of MLO-Y4 cells (Calcein-AM, ×200); TCP: Tricalcium phosphate; MTT: Tartrate resistant acid phosphatase; BP: Bergapten
*Pvscontrol group;#PvsTCP group;△PvsBP (1 μmol/L) group;▲PvsBP (5 μmol/L) group
2.2 佛手苷内酯对TCP磨损颗粒诱导骨细胞凋亡的影响
流式细胞术定量检测结果显示:与Control组比较,TCP组骨细胞核染色质聚集、核碎裂及胞质浓缩等典型形态学改变,细胞膜外翻,凋亡率显著增加为Control组的7.61倍(图3、图4,P<0.05),并伴随caspase-3的活化。与TCP组比较,佛手苷内酯组骨细胞凋亡及caspase-3的活化显著减少,其凋亡率分别减少为TCP组的87.88%(1 μmol/L)、51.84%(5 μmol/L)和28.35%(20 μmol/L)(图3、图4,P<0.05)。

Fig. 3 Effects of bergapten on morphologic changes of apoptosis induced by TCP wear particles in osteocytes MLO-Y4 cells (Hoechst 33342, ×200)
TCP: Tricalcium phosphate; BP: Bergapten

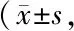
A: FCM for apoptosis caused by TCP wear particles in osteocytes MLO-Y4; B: Casp-3 activation examined by western blot; C: The percentage of apoptosis analyzed; TCP: Tricalcium phosphate; BP: Bergapten
*Pvscontrol group;#PvsTCP group;△PvsBP (1 μmol/L) group;▲PvsBP (5 μmol/L) group
2.3 佛手苷内酯对TCP磨损颗粒诱导骨细胞功能损伤的影响
与Control组比较,TCP组骨细胞中DMP-1的RNA水平显著减少,而SOST和FGF23的mRNA水平明显增加,造成DMP-1/SOST减少(表2,P< 0.05);与TCP组比较,佛手苷内酯组骨细胞中DMP-1的mRNA水平明显增加,SOST和FGF23的mRNA水平明显减少,造成DMP-1/SOST显著增加(表2,P<0.05)。
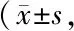
Tab. 2 Effects of bergapten on dysfunctions of osteocytes caused by TCP wear particles in MLO-Y4 cells n=3)
TCP: Tricalcium phosphate; BP: Bergapten; DMP-1: Dentin matrix protein1; SOST: Sclerostin; FGF23: Fibroblast growth factor 23.
*P<0.05vscontrol group;#P<0.05vsTCP group;△P<0.05vsBP (1 μmol/L) group;▲P<0.05vsBP (5 μmol/L) group
2.4 佛手苷内酯对TCP磨损颗粒诱导骨细胞内质网应激反应及PERK通路活化的影响
Western blot检测结果显示:与Control组比较,TCP组骨细胞发生内质网应激反应及PERK信号通路被激活,表现为TCP组骨细胞中内质网应激标志蛋白质GRP78、PERK、p-PERK、eIF2α、p-eIF2α、ATF4和CHOP等蛋白质表达均明显上调(P<0.05,图5),p-PERK/PERK和p-eIF2α/p-eIF2α值也明显减少。与TCP组比较,佛手苷内酯组骨细胞中GRP78、ATF4和CHOP等蛋白质表达显著下调、p-PERK/PERK和p-eIF2α/p-eIF2α值也明显增加(P<0.05,图5),且佛手苷内酯对内质网应激反应和PERK通路的激活影响具有一定的剂量依赖性。
3 讨论
人工关节置换术是指用人工关节置换和代替损伤或病损关节,是临床治疗晚期髋、膝关节等严重关节疾病的重要手段,它可有效减轻患者关节疼痛、恢复关节功能,提高患者生活质量。但是,随着关节置换病例的增加和时间的延长,假体晚期松动问题日益突出。大量研究表明,PE、Ti和TCP等三类关节假体植入体内后,经过长期磨损、碰撞产生大量的磨损颗粒,这些微米粒径的细小颗粒聚集于假体表面会刺激假体周围组织细胞释放TNF-α、IL-1β、IL-6和PGE2,以上破骨细胞活化这些因子可诱导破骨细胞形成和假体周围骨溶解,最终导致关节假体晚期松动及人工关节置换失败[1, 2]。
目前有关磨损颗粒对假体周围巨噬细胞、成骨细胞和破骨细胞的影响研究较多,而对于假体周围含量丰富的骨细胞在假体周围骨溶解的作用研究还很少。2015年,Zawawi[14]研究团队利用小鼠颅骨溶解模型证实PE磨损颗粒可诱导假体周围骨细胞凋亡,与人工全髋关节翻修术假体周围骨细胞损伤情况一致。最近我们前期实验结果也显示TCP磨损颗粒植入小鼠颅骨矢状缝初期假体周围骨细胞发生凋亡[4],释放TNF-α、IL-1β、SOST和RANKL从而促进破骨细胞活化与骨溶解,且假体周围骨细胞凋亡先于破骨细胞的活化。另外,TCP磨损颗粒可减少假体周围骨细胞特征蛋白DMP-1的mRNA水平,增加SOST和FGF23的mRNA水平。而DMP-1正调控骨代谢,其表达降低可抑制新骨形成而诱导骨吸收;而SOST和FGF23是一种负性调节骨量因子,SOST和FGF23的表达增加容易造成破骨细胞性骨溶解[15, 16]。因此,DMP-1、SOST和FGF23的mRNA水平以及DMP-1/SOST变化可反映骨细胞功能损伤情况。以上研究结果表明,骨细胞是诱导假体周围骨溶解的重要启动者,而阻止假体周围骨细胞损伤及凋亡可防治磨损颗粒诱导假体周围骨溶解和关节松动。

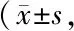
A: Activation of PERK/eIF2α signaling pathway examined by western blot; B, C, D, E and F: Densitometric analysis data;
GRP78: Glucose regulated protein 78; PERK: Phospho-protein kinase R-like ER kinase; p-PERK: Phospho-PERK; eIF2α: Eukaryotic initiation factor 2α; p-eIF2α: phospho-eIF2α; ATF4: Activating transcription factor 4; CHOP: C/EBP-homologous protein; TCP: Tricalcium phosphate; BP: Bergapten
*Pvscontrol group;#PvsTCP group;△PvsBP (1 μmol/L) group;▲PvsBP (5 μmol/L) group
佛手苷内酯是一种天然香豆素类化合物,具有抗炎和抗肿瘤等活性[9-11],临床上也常用于白癜风等皮肤病的治疗。有报道显示,佛手苷内酯可促进成骨细胞的增殖和分化,增加新骨形成;另有研究认为佛手苷内酯能诱导破骨细胞及其前体细胞凋亡,阻止破骨细胞生成和骨吸收[12, 13]。本研究结果显示佛手苷内酯可显著抑制TCP颗粒诱导的骨细胞MLO-Y4活性降低、减少细胞凋亡,上调DMP-1的mRNA水平,并下调SOST和FGF23的mRNA水平。这表明佛手苷内酯可通过抑制细胞凋亡来保护MLO-Y4细胞,使其免受TCP磨损颗粒的功能损伤。但是,其具体调控机制目前还不清楚。
众多研究证实内质网应激参与调控骨细胞凋亡[17, 18],调节骨吸收疾病的发生和发展。内质网作为真核细胞重要的细胞器,是细胞内脂质代谢及蛋白质合成后修饰和折叠的场所。缺氧、葡萄糖缺乏、蛋白转运异常及Ca2+耗竭等病理刺激均可诱导未折叠蛋白或错误折叠蛋白在内质网腔内大量堆积,引起内质网应激。内质网应激的调控包括PERK、肌醇需要酶-1( inositol-requiring enzyme 1,IRE1)和活化转录因子(activating transcription factor 6,AFT6)等3条信号通路[19-21]。其中,PERK是一种丝氨酸/苏氨酸蛋白激酶。正常情况下,PERK与内质网分子伴侣GRP78结合形成稳定的复合物,处于无活性状态。当发生ERS时,PERK与GRP78解离,解离后的PERK形成同源二聚体并发生自身磷酸化,活化的PERK使下游eIF2α发生磷酸化,抑制未折叠蛋白质合成,恢复内质网功能而促进细胞存活[22]。但是,当发生长时间过强的ERS时,磷酸化的eIF2α可通过上调其下游ATF4和CHOP表达而介导细胞凋亡[23]。本研究发现佛手苷内酯显著减弱TCP磨损颗粒诱导的骨细胞内质网应激反应及PERK通路的活化,阻止骨细胞发生内质网应激性凋亡,表现为:与TCP组比较,内质网应激相关蛋白质GRP78、ATF4和CHOP的表达明显下调,p-PERK/PERK值和p-eIF2α/p-eIF2α值显著增加,与佛手苷内酯对骨细胞凋亡的抑制作用基本一致(图4)。然而,另外两条内质网应激通路IRE1和ATF6在佛手苷内酯阻止TCP磨损颗粒诱导的骨细胞损伤中所发挥的作用如何,还需要我们以后进行深入的探讨。
综上,佛手苷内酯可通过减轻TCP磨损颗粒诱导的内质网应激及PERK通路活化而阻止骨细胞凋亡。因此,佛手苷内酯有望成为防治假体周围骨细胞损伤及骨溶解的一种潜在药物。

