海马齿状回神经再生对WKY大鼠抑郁样行为的影响*
陈 玲,马近腾,常鑫蕊,冯 俐,杨小荣
(山西医科大学生理学系,细胞生理学教育部重点实验室,细胞生理学山西省重点实验室,太原 030001)
抑郁症是指持续超过两周,不能自控的以情绪低落、快感缺失、意志活动和认知功能减退以及思维迟缓为主要特征的情感性精神障碍。据2017年统计全球抑郁症患者高达3.22亿,占世界人口的 4.4%[1]。流行病学调查显示20%的中国人存在抑郁症状,其中仅有不足10%患者得到正规治疗[2]。
目前临床上广泛使用的一线传统抗抑郁药主要是通过增加单胺类神经递质如5-羟色胺、去甲肾上腺素、多巴胺的浓度发挥抗抑郁效果。然而患者在服用这类抗抑郁药虽然数小时内脑内的单胺递质水平显著增高,但其抑郁情绪在服药后的3~4周才得到有效改善[3]。已知神经干细胞从增殖、分化、成熟、再到整合到现有神经环路中发挥其作用大约需要4周的时间[4],由此可见神经再生所需时间与抗抑郁药发挥临床疗效具有相同的时程性。由此推断从神经再生的角度进行深入研究或许能找到抑郁症发病的核心机制。
中枢的侧脑室室管膜下区(subventricular zone, SVZ)和海马齿状回(dentate gyrus, DG)颗粒下层区(subgranular zone, SGZ)是目前较为公认的两个存在有神经前体细胞、具有神经再生潜能的区域[5]。近年来有研究表明,成年海马神经再生及其调控会对抑郁症发病和抗抑郁治疗产生显著影响,提出海马神经再生障碍可能成为抑郁症形成的重要病理机制之一[3, 6, 7]。但也有部分研究者并不认同抑郁症的神经再生障碍假说,例如在一项临床研究中并未观察到抑郁症患者海马区成年神经干细胞的增殖减少,且抗抑郁药对情绪的改善作用并不依赖于神经再生[8, 9]。因此,关于神经再生在抑郁症中的作用尚存在争议。
Wistar Kyoto(WKY)大鼠作为Wistar大鼠品种的近交系,因其表现出高水平的内源性抑郁样行为[10-12],而被作为抑郁症的动物模型广泛使用。我们首先应用免疫组织荧光染色方法观察WKY抑郁大鼠的海马神经再生情况,并通过促进海马的神经再生进一步观察对大鼠抑郁样行为的影响,为探讨神经再生在抑郁症中的重要作用提供新的证据。
1 材料与方法
1.1 实验材料
9周龄雄性Wistar大鼠(10只)和WKY大鼠(20只)购自北京维通利华实验动物技术有限公司,许可证编号SCXK(京)2016-0011。阿米替林(amitriptyline, AMI)购自Sigma公司;兔免疫荧光Ki67一抗购自Abcam公司;兔免疫荧光DCX(doublecortin, 微管相关蛋白)一抗购自Cell Signaling Technology公司;山羊抗兔荧光二抗购自中杉金桥公司;山羊血清购自Life Sciences公司;DAPI购自武汉博士德公司。
1.2 实验分组及处理
大鼠适应环境一周后,分为3个组(n= 10):(1)正常对照(Wistar)组:选取9 周龄雄性Wistar大鼠,给与生理盐水 3 周;(2)抑郁模型(WKY)组:选取同龄雄性WKY大鼠并经行为学测定后筛选出抑郁大鼠作为抑郁模型组,给予生理盐水 3 周;(3)阳性对照(AMI+WKY)组:选取同龄雄性WKY大鼠,给予阿米替林 3 周。将生理盐水(10 mg/kg)或阿米替林溶液(10 mg/kg)灌胃给药 21 d。行为测试在 09:00-15:00 进行。糖水偏好实验(sucrose preference test, SPT)在给药的第16~18日进行,旷场实验(open field test, OFT)在第 19 日进行,强迫游泳实验(forced swimming test, FST)在第 20~21 日进行。在第 22 日处死大鼠,然后进行免疫荧光实验。
1.3 免疫荧光实验
1.3.1 灌注大鼠 使用4%水合氯醛(1 ml/100 g)对大鼠进行腹腔麻醉。4℃生理盐水 500 ml心脏快速灌注,随后先快后慢灌注 4℃ 4%多聚甲醛 300 ml。断头取脑后,在 4℃ 4%多聚甲醛下后固定 4 h,15%和30%蔗糖浓度梯度分别脱水。用OCT包埋剂包埋脑组织,在冰冻切片机下进行冰冻切片,留取含海马层面的切片(30 μm厚)。
1.3.2 免疫荧光染色 根据隔六取一的原则,每组取 6 张切片分别进行Ki67免疫荧光染色和DCX免疫荧光染色。具体步骤如下:将大鼠脑片在37℃干燥箱 30 min烘干;随后使用0.3% Triton PBS洗两次,每次5 min,0.01 mol/L PBS洗一次,每次5 min;将脑片浸泡在丙酮内,-20℃下保存 20 min;晾干后再洗三次;之后用10%山羊血清37℃封闭 1 h;加入兔源Ki67(1∶200)或DCX(1∶200)一抗,4℃过夜;洗三次后荧光二抗抗兔594(1∶100)37℃孵育 2 h;DAPI室温孵育 10 min;PBS洗一次,每次5 min;用抗荧光衰减封片剂封片。在Olympus显微镜(BX51)下观察海马DG区染色结果并拍照,每次随机选取DG区 5 个视野中的阳性细胞进行计数,并计算 6 张切片的平均值。
1.4 糖水偏好实验
在给药的第16日开始糖水适应,给予大鼠一瓶1%蔗糖(200 ml)和一瓶纯水(200 ml)适应 1 d,每 12 h调换一次水瓶位置。第 17 日大鼠开始禁食禁水 23 h。随后给予大鼠一瓶1%蔗糖和一瓶纯水正式测试 1 h,每 30 min调换一次水瓶位置。在实验结束时,记录总消耗的蔗糖溶液和纯水的量,并通过下式计算糖水偏好百分比:糖水偏好百分比=总蔗糖溶液消耗量/(总水消耗量+总蔗糖溶液消耗量)×100%[13]。
1.5 旷场实验
OFT装置长 50 cm,宽 50 cm,高 50 cm,其中底部设置成 25 宫格。实验时将大鼠置于旷场底部的中心以自由活动 5 min,并使用安装在旷场上方的摄像机记录总距离和中心时间。每次测试记录后,用70%乙醇清洁旷场底部和四壁[14]。
1.6 强迫游泳实验
第1日的预训练期 15 min,将每只大鼠置于透明的有机玻璃圆筒(直径 20 cm×高 44.5 cm)中,水温24~26℃,水位以大鼠直立时刚不触及水底为准。第2日正式测试 5 min。在完成测试后,擦干大鼠体表,然后放回笼中。对测试时段进行录像并测量 5 min内的不动时间[15]。
1.7 统计学处理
2 结果
2.1 免疫荧光染色实验结果
2.1.1 海马的神经干细胞增殖情况 如图1A所示为3组大鼠海马DG区的Ki67+染色的代表性免疫荧光图片。与正常对照组(10.9±1.9)相比,WKY抑郁大鼠海马DG区Ki67+细胞数量(7.3±1.0)降低了33.0%(P<0.01);而阿米替林给药后使海马DG区Ki67+细胞数量(10.5±1.6)较抑郁组(7.3±1.0)增加了43.8%(P<0.01,图1B)。以上结果提示成年抑郁大鼠海马神经干细胞的增殖能力降低,阿米替林可以促进成年抑郁大鼠海马神经干细胞的增殖。
2.1.2 海马的神经干细胞分化情况 如图2A所示为各组大鼠海马DG区DCX+染色的代表性免疫荧光图片。与正常对照组(136.0±21.6)相比,WKY抑郁大鼠海马DG区DCX+细胞数量(82.7±11.7)降低了39.2%(P<0.01);而阿米替林给药后使海马DG区的DCX+细胞数量(121.3±20.9)较抑郁组(82.7±11.7)增加了46.7%(P<0.01,图2B)。以上结果提示成年抑郁大鼠海马神经干细胞的分化能力降低,阿米替林可以明显增加成年抑郁大鼠海马神经干细胞的分化能力。
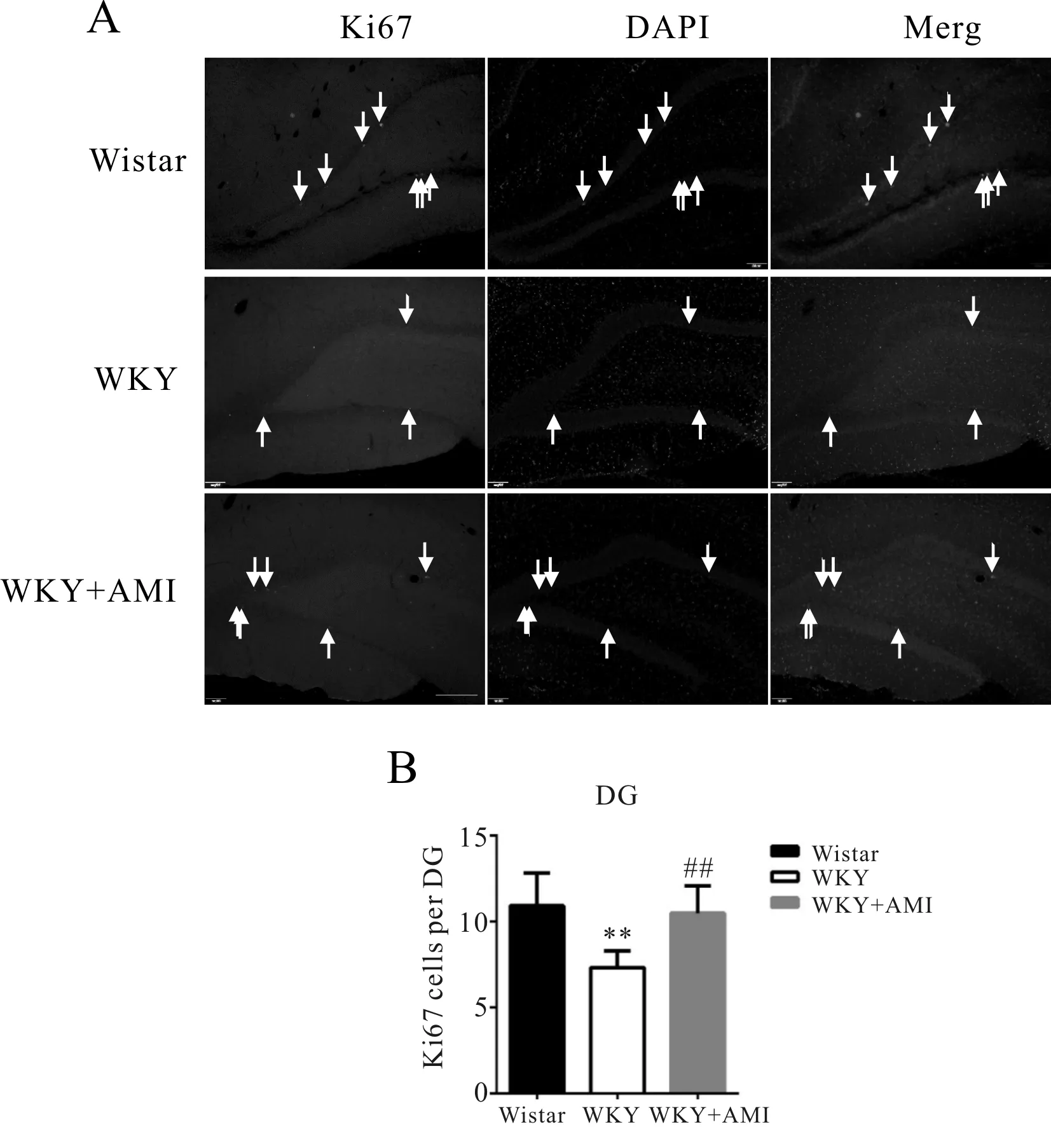
Fig. 1 The proliferating cells in hippocampal DG region in different groups (Immunofluorescence ×100)
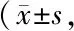
**PvsWistar group;##PvsWKY group
2.2 行为学实验结果
2.2.1 糖水偏好实验结果 结果如表1所示:与正常对照组相比,抑郁模型组大鼠糖水偏好百分比明显降低(P<0.01);而阿米替林给药后使抑郁大鼠的糖水偏好百分比显著升高(P<0.01,表1)。以上结果提示WKY大鼠出现快感缺乏症状,阿米替林可以改善WKY大鼠的快感缺乏症状。
2.2.2 旷场实验结果 与正常对照组相比,抑郁模型组大鼠在旷场中水平运动的总距离更短(P< 0.01),并且停留在中心的时间更短(P<0.01);而阿米替林给药后使抑郁大鼠的水平运动总距离显著增加(P<0.01),并使其中心停留时间显著延长(P< 0.05,表1)。以上结果提示WKY大鼠的运动活动能力降低,并且对陌生环境的探索能力降低;阿米替林可以增加抑郁大鼠的运动活动能力和探索能力。

Fig. 2 The immature neurons in hippocampal DG region in different groups (Immunofluorescence ×100)
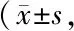
**PvsWistar group;##PvsWKY group
2.2.3 强迫游泳实验结果 与正常对照组相比,抑郁组大鼠的不动时间显著延长(P<0.01);而给予阿米替林干预后,大鼠的不动时间较抑郁组明显缩短(P<0.05,表1)。以上结果表明WKY大鼠出现绝望行为,阿米替林可以改善抑郁大鼠的绝望行为。
3 讨论
抑郁症已成为危害人类健康最主要的疾病之一,目前临床上治疗抑郁症的方法主要包括药物治疗、心理治疗和物理治疗。(1)一线的抗抑郁药:主要包括选择性的5-羟色胺和去甲肾上腺素再摄取抑制剂,但这些药物起效慢(一般2~4周),缓解率低(只有67%)[16],临床疗效不理想。(2)心理疗法:包括认知行为疗法和人际关系疗法。一般作为抑郁症药物治疗的辅助疗法,不单独使用[17]。(3)物理疗法:主要包括电休克治疗或经颅磁刺激治疗,但其复发率高并可能诱发癫痫[18]。可见,目前临床上对于抑郁症的治疗效果并不理想,尤其是临床上一线抗抑郁药物治疗起效慢、有效率低,因此对于抑郁症患者的治疗已成为精神科所面临的巨大挑战。
阿米替林是临床上最常用的三环类抗抑郁药物,其作用机制是阻断5-羟色胺和去甲肾上腺素的再摄取,通过提高突触间隙的递质浓度增强突触传递功能发挥抗抑郁作用[17]。现有的研究显示阿米替林能够促进成年哺乳动物神经干细胞的增殖、分化、成熟和存活从而增强神经再生[19-21],但有关其促神经发生的机制研究较少。有文献报道阿米替林可能通过促进脑源性神经营养因子(brain derived neurotrophic factor, BDNF)及其同源受体(tyrosine kinase receptor B, TrkB)的酪氨酸磷酸化增加,从而促进海马齿状回神经再生[19];此外,阿米替林还可能通过降低海马中酸性鞘磷脂酶活性和神经酰胺的浓度促进神经再生[20, 21];但其具体机制有待进一步研究。在本实验中我们使用阿米替林作为阳性对照,观察它是否通过改善神经再生而逆转大鼠的抑郁样行为。
在本实验中观察到WKY抑郁大鼠海马的神经再生受损,应用阿米替林改善其神经再生后则使大鼠的抑郁样行为得到改善,再次证实了海马神经再生在抑郁症的发病过程中发挥重要作用。早在2000年,Duman等人就发现抑郁症患者的海马体积减小,并伴有神经细胞的萎缩和缺失[22]。近期也有研究显示抑郁症患者出现认知记忆功能降低的部分原因是减少的神经再生及缩小的海马体积[23, 24]。Hill等人的一项研究中发现灭活神经祖细胞的促凋亡Bax基因促进海马的神经再生,可以减轻由慢性皮质酮处理引起的小鼠抑郁样症状[3]。此外,NSI-189磷酸盐是一种能够刺激海马神经再生的新型神经源性化合物。在重度抑郁症(major depressive disorder, MDD)患者进行的双盲安全性Ib期研究表明,口服NSI-189具有显著长效的抗抑郁和改善认知的作用[25],并在近期的II期研究中也证实了此疗效[6]。这与通过辐射消融海马的神经再生则取消氟西汀的抗抑郁作用相类似[7]。以上研究表明成年海马神经再生及其调控会对抑郁症发病和抗抑郁治疗产生显著影响,因此,海马神经再生情况的改变
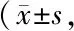
Tab. 1 Overview of behavioural tests n=10)
OFT: Open field test;AMI: Amitriptyline
**P<0.01vsWistar group;#P<0.05,##P<0.01vsWKY group
已经成为抑郁症发病的重要病理机制之一。综上所述,本研究在WKY抑郁大鼠观察到海马的神经再生受损,改善其受损的神经再生可以部分逆转大鼠的抑郁样行为,因此为进一步证实抑郁情感障碍的“神经再生假说”提供实验依据,为今后治疗抑郁提供理论依据。

