心理应激对小鼠脂肪组织黄嘌呤氧化酶表达、活性及相关指标的影响*
买买提·依斯热依力,艾克拜尔·艾力,买买提艾力·艾则孜,吾布力卡斯木·吾拉木,李义亮,阿孜古丽·阿力木江,闫 晶,克力木·阿不都热依木
(1. 新疆维吾尔自治区人民医院普外微创研究所,2. 新疆维吾尔自治区人民医院微创,疝和腹壁外科,3. 新新疆维吾尔自治区人民医院心外科,4. 新疆维吾尔自治区人民医院妇产科门诊,新疆 乌鲁木齐 830001)
尿酸(uric acid, UA)是核酸中嘌呤碱基代谢的最终产物,嘌呤合成过程中的产物次黄嘌呤、黄嘌呤在黄嘌呤氧化酶(xanthine oxidase, XO)的催化作用下产生UA[1]。高尿酸血症不仅导致痛风,而且与代谢综合征(metabolic syndrome, Met S)关系密切。据报道,高尿酸血症诸多生活方式相关慢性病(如高血压、2型糖尿病、肥胖等)发生发展中的重要危险因素[2]。现代工作和生活方式中慢性心理压力与Met S、高尿酸血症、糖尿病和血栓栓塞症的发生密切相关。心理压力可激活机体各种应激途径,包括下丘脑-垂体-肾上腺轴和交感神经系统,最终导致应激相关的疾病[3]。慢性心理压力可对心血管、内分泌和免疫系统带来不良的影响。
脂肪组织不仅是一个被动的能量储存的器官,它还是一个调节机体内分泌、能量代谢及炎症的内分泌器官。在各种异常的生理代谢如高尿酸、血脂异常、胰岛素抵抗、2型糖尿病和心血管疾病的发生中发挥着关键作用[4]。脂肪组织中活性氧(reactive oxygen species, ROS)的积聚,被认为Met S的早期诱因和潜在治疗靶点。因此,本研究通过建立小鼠慢性束缚应激(Stress)模型,探讨心理应激诱导UA形成、脂肪炎症、胰岛素抵抗和凝血酶原状态发生中的作用机制。
1 材料与方法
1.1 实验设备与试剂
自制式束缚器;电子天平(EL-5.2K),常州市天之平仪器设备有限公司;低温高速离心机(1-14K),美国Sigma公司;光学显微镜(Eclipse E200),日本尼康公司;梯度PCR扩增仪(C1000),美国Bio-Rad公司;PBS缓冲液粉末、HE染色相关试剂、DAB显色试剂盒、免疫组化通用试剂盒,均购于北京中杉金桥生物技术有限公司;XO抗体(货号:EPR4605)、Nox-4抗体(货号:UOTR1B493)购于美国Abcam公司;柠檬酸,美国Sigma公司;TRIzol试剂,美国Invitrogen公司;cDNA合成试剂盒,北京天根生化科技有限公司;实时定量RT-PCR试剂盒,日本TaKaRa公司。
1.2 实验动物及分组
SPF级雄昆明(KM)小鼠25只,8周龄,购于新疆实验动物研究中心,许可证号:SCXK(新)2011-0001;饲养于新疆维吾尔自治区维吾尔医药研究所IVC系统动物中心。25只小鼠进行编号及体重测量,并排除体重变异较大的5只。采用Microsoft Office Excel软件随机分2组(各10只),即慢性束缚应激(Stress)组和正常对照(Control)组。小鼠单只饲养在自由进食水的鼠笼内,每日给予12 h昼夜循环,光照均始于8:30 分,止于20:30分。
1.3 Stress模型的建立
所有小鼠在相同环境中适应性喂养1周。该模型的心理应激属性为慢性束缚应激,束缚应激均在每日上午10:30~12:30进行。10只Stress组小鼠置于用50 ml离心管所制的自制式束缚器中(离心管提前烫制出直径约5 mm的通气孔若干,分布于左右及上侧管壁,管口塑料盖做1小孔以暴露小鼠尾巴),每日限制活动2 h,期间禁食禁水,后放回鼠笼内自由活动,连续束缚14 d。Control组小鼠自由饮水摄食,其余时间两组小鼠处理相同。两组小鼠实验过程中3 d 1次进行测量体重及饮食量。
1.4 取材与标本处理
束缚应激第14日下午17:00开始对所有小鼠禁食,于次日11:00进行取材。麻醉的小鼠以平卧位固定,从腹部正中至剑突取切口取3 cm切口,下腔静脉取血注入于1.5 ml EP管中。腹部及皮下脂肪剪断取材,先进行腹部脂肪重量测量,然后置于4%中性甲醛固定;检测两组WAT组织中XO,Nox-4的蛋白水平,检测WAT组织中XO、Nox-4、Mn SOD、GSH-Px、CAT、ADPN、MCP-1、IL-6、TNF-α、IRS-1、GLUT-4、TF以及PAI-1的mRNA表达。
1.5 脂肪组织病理学检查
脂肪标本4%中性甲醛固定24 h后水洗、脱水、透明、浸蜡、包埋,制成4 μm厚切片行HE染色。各组脂肪组织常规HE染色后,切片质量及组织形态学改变均由富有经验的病理科医师诊断。
1.6 免疫组化染色
脂肪组织石蜡切片脱蜡水化后,10%过氧化氢甲醛阻断过氧化物酶,柠檬酸法高压修复抗原,山羊血清封闭1 h,分别在不同切片滴加XO和烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate,NADPH oxidase,Nox-4)一抗(1∶100,均购于abcam),4℃过夜,滴加二抗,37℃孵育30 min,DAB显色。以PBS 液取代一抗作为阴性对照。每只小鼠脂肪组织标本随机取两张切片,光镜下观察脂肪组织染色情况,在200倍镜下随机取5个视野,应用Image-Pro Plus 6.0软件进行拍照,以明显黄色/棕黄色细胞为阳性细胞。
1.7 实时定量RT-PCR
采用实时定量RT-PCR方法检测各项指标的mRNA的相对表达。取每只小鼠脂肪组织20 mg,采用TRIzol试剂提取总RNA,采用天根公司Fast Quant RT试剂盒合成第一链cDNA。由上海生工生物工程股份有限公司设计并合成引物,各指标及β-肌动蛋白(actin)引物序列见表1。RT-PCR反应严格按照试剂盒操作说明进行。实时定量RT-PCR,反应体系为20 μl,反应条件为: 94℃ 3 min,然后95℃ 20 s,60℃ 20 s,72℃ 20 s,共40循环。反应结束后由电脑自动得出荧光曲线及Ct值,采用2-△△Ct计算出Stress小鼠脂肪组织相对于Control组中目标基因的相对表达倍数。

Tab. 1 Sequences of primers used for RT-PCR
1.8 酶联免疫吸附(ELISA)测定
取血后不经任何处理,4℃下静置2 h,之后以 3 500 r/min的速度低温离心5 min,取上层血清,-80℃保存,用于后续测定。ELISA法检测WAT组织中XO酶活性,血清中甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, T-Cho)、游离脂肪酸(free fatty acid, FFA)、Nox-4及UA的含量。实验过程及测量指标浓度的计算严格按试剂盒说明书进行。
1.9 统计学处理
2 结果
2.1 心理应激对小鼠WAT组织XO表达和酶活性的影响
XO免疫染色阳性着色细胞在Stress小鼠腹股沟WAT组织中表达较Control组黄褐色沉淀深且丰富,主要表达于脂肪细胞中(图1)。Stress组WAT组织中XO mRNA转录水平显著高于Control组(P<0.01)。Stress组血清XO浓度以及WAT组织中XO、XOR的酶活性显著高于Control组(P<0.01,表2)。
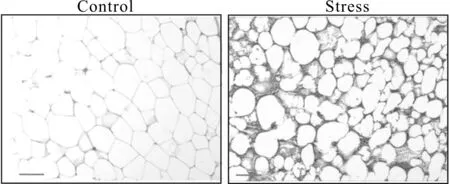
Fig. 1 Expressions of XO in the WAT of control and stressed mice(Immunohistochemistry ×200)
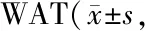

GroupXO mRNAXO(mU/ml)Activity(nmolsIXP/min/μg)XOXORControl1.00±0.0012.47±4.631.25±0.081.37±0.14Stress2.45±0.52∗∗29.34±5.27∗∗4.06±0.65∗∗4.52±1.05∗∗
**P<0.01vscontrol
2.2 心理应激对小鼠血生化指标的影响
Stress组WAT组织重量与Control组相比显著降低(P<0.01);Stress组小鼠血清中甘油三酯(TG)、总胆固醇(T-Cho)的释放浓度有上升的趋势,但与Control组相比无统计学差异(P>0.05);而Stress组游离脂肪酸(FFA)以及尿酸(UA)的含量显著增高,约为Control组的2倍,两组间具有明显的统计学意义(P<0.01,表3)。
Tab. 3 White adipose tissues(WAT) weight and blood parameters of control and stress n=10)
**P<0.01vscontrol
2.3 心理应激对小鼠WAT组织中Nox-4和抗氧化蛋白表达的影响
Stress组WAT组织Nox-4阳性表达细胞与control组相比,黄褐色沉淀深且丰富,主要表达于脂肪细胞中(图2)。Stress组小鼠WAT组织中Nox-4的mRNA表达水平及其血清浓度显著高于Control组(P<0.01,表4);Stress组WAT组织中抗氧化蛋白如锰超氧化物歧化酶( Mn-SOD )、谷胱甘肽过氧化物酶(GSH-Px)及过氧化氢酶(Catalase)的mRNA转录水平显著降低(P<0.01,表5)。
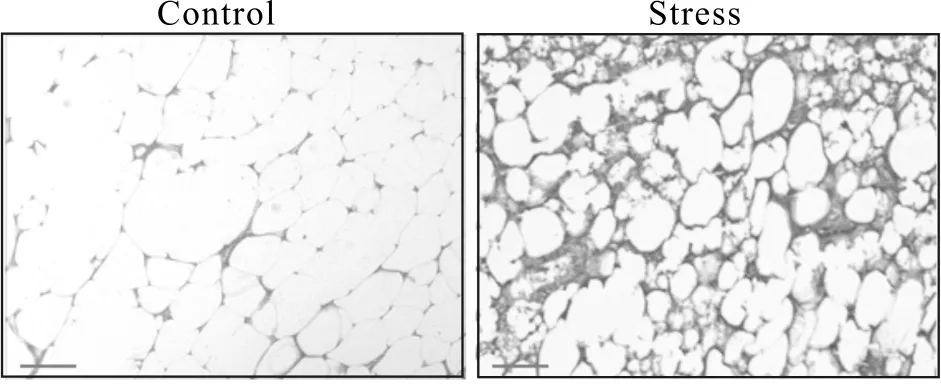
Fig. 2 Expressions of Nox-4 in the WAT of control and stressed mice(Immunohistochemistry ×200)
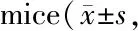

GroupNox-4 mRNANox-4(ng/ml)Control1.00±0.000.65±0.04Stress2.48±0.37∗∗2.75±0.77∗∗
**P<0.01vscontrol
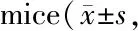

GroupMn SOD mRNAGSH-Px mRNACatalase mRNAControl1.00±0.001.00±0.001.00±0.00Stress0.62±0.05∗∗0.60±0.03∗∗0.57±0.02∗∗
**P<0.01vscontrol
2.4 心理应激对小鼠脂肪组织的影响
HE染色镜下观察发现(图3),Stress组小鼠WAT出现大量的单核细胞、中性粒细胞、嗜酸性粒细胞及浆细胞浸润反应和炎症性改变,而Control组小鼠WAT未发现异常。
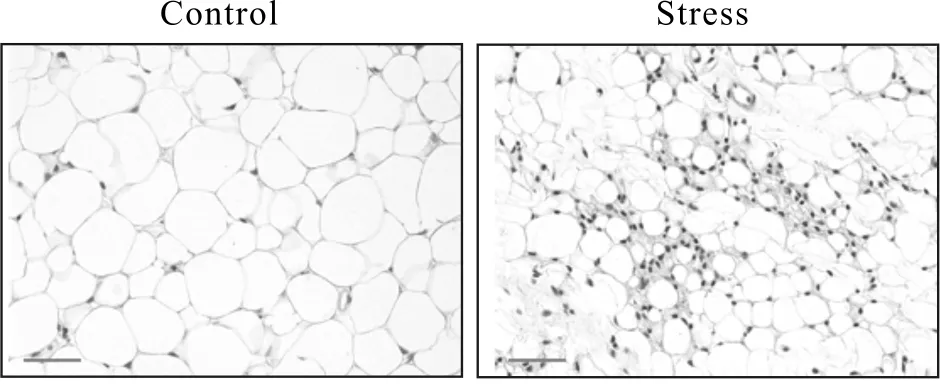
Fig. 3 HE staining in the WAT of control and stressed mice(HE staining ×200)
2.5 心理应激对小鼠脂肪组织细胞因子表达的影响
Stress组小鼠WAT组织中单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)、白介素-6(interleukin-6, IL-6)及肿瘤坏死因子(tumor necrosis factor-α, TNF-α)的mRNA转录水平与Control组相比显著增高,两组间具有明显的差异(P<0.01,表6);在Stress组WAT组织中Adiponectin(ADPN)的mRNA转录水平显著低于Control组(P<0.01,表6)。
2.6 心理应激对小鼠脂肪组织糖代谢相关蛋白和促凝血因子表达的影响
Stress组WAT组织中胰岛素受体底物-1(insulin receptor substrate-1, IRS-1)及葡萄糖转运蛋白4(glucose transporter-4, GLUT-4)的mRNA转录水平显著底于Control组(P<0.01,表7)。Stress组WAT组织中纤溶酶原激活物抑制因子-1(plasminogen activator inhibitor-1, PAI-1)及组织因子(tissue factor, TF)的mRNA转录水平明显高于Control组(P< 0.01,表7)。
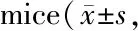
Tab. 6 The mRNA expressions of adipocytokines in the WAT of control and stressed n=10)
**P<0.01vscontrol
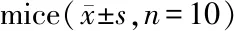
Tab. 7 Expressions of glucose and prothrombic biomarkers in the WAT of two group
**P<0.01vscontrol
3 讨论
高尿酸血症是心血管、内分泌和肾脏疾病的独立危险因素,同时诸多疾病如痛风、2型糖尿病、高血压和动脉粥样硬化的发生发展中发挥着关键的作用[5]。UA结晶可沉积于血管内皮细胞,直接诱发血管内皮的损伤,可导致血液中脂质沉积于损伤的内皮细胞下,诱发动脉粥样硬化。过量的UA形成尿酸结晶沉积于胰岛β细胞,干扰其功能,进而引发糖代谢紊乱,促进糖尿病的发生[6]。UA可以引起脂肪MCP-1的产生增加,而激发脂肪细胞炎症反应;UA使脂联素(adiponectin)的合成减少,而引起脂肪细胞特异性胰岛素减少[7]。高水平的UA可通过ROS产生、活化核转录因子κB诱导型一氧化氮合酶NO信号通路或激活AMP活化蛋白激酶信号通路来抑制胰岛β细胞增殖或增加其凋亡[8]。
黄嘌呤氧化还原酶(xanthine oxidoreductase, XOR)是一种含钼蛋白的酶,能催化次黄嘌呤氧化为黄嘌呤,最后氧化形成为UA。XOR以两种形式存在:黄嘌呤脱氢酶(xanthine dehydrogenase, XDH),倾向于NAD+电子受体和黄嘌呤氧化酶(XO),通过XDH翻译后修饰而衍生,并产生活性氧(ROS)超氧化物[9]。在动物内脏脂肪XOR的表达水平和酶活性较高,类似于肝脏和肠道。脂肪组织是一个重要的内分泌器官,可分泌瘦素(leptin)、Adiponectin、肿瘤坏死因子(TNF-α)、MCP-1等多种脂肪细胞因子,这些细胞因子与许多疾病的生理和病理过程有关[10]。Adiponectin在调节糖脂代谢中发挥着重要的作用,它可以促进血浆中FFA氧化,提高胰岛素敏感性,增加外周组织对葡萄糖的摄取,抑制肝脏葡萄糖输出和葡萄糖再生。2型糖尿病是最常见的慢性病之一,全球大约1.5亿糖尿病患者。通常认为2型糖尿病患者的胰岛素水平并不降低,但是肝脏、肌肉及脂肪组织等外周器官存在胰岛素抵抗。临床研究发现,血尿酸水平和高尿酸血症发病率随体重指数(BMI)增加而增加。高脂血症患者60%~80%伴有高尿酸血症,血尿酸浓度与甘油三酯和总胆固醇水平呈正相关[11-12]。
胰岛素抵抗通常是与体重增加及心血管功能异常存在相关性,Adiponectin、TNF-α和IL-6是在这些病理状态的重要分子。在这些细胞因子中,只有Adiponectin的血浆水平在胰岛素抵抗和肥胖的情况下降低,在合并冠心病的患者中降低更加明显,在胰岛素敏感性增加和体重减轻时Adiponectin的表达和血浆水平上升,同时有研究显示,血浆Adiponectin高的冠心病患者将来心肌梗死的危险性降低[13]。此外,Adiponectin还具有抗炎、抗动脉粥样硬化的功能。研究发现,冠心病患者血浆Adiponectin的含量较正常人低,Adiponectin通过抑制NF-κB的激活来抑制TNF-α诱导的单核细胞粘附和血管内皮粘附分子如血管细胞粘附分子-1的表达,并抑制血管平滑肌细胞的增殖,提示Adiponectin在动脉粥样硬化形成过程中发挥着保护作用[14]。
ROS不但是细胞代谢的有害副产物,而且是细胞信号传导和基因调控的主要参与者。过量的ROS不仅可直接对机体和组织细胞产生损伤,而且最近的研究发现微量的ROS在细胞内可作为信号分子,通过调节与炎症有关的基因表达,参与炎症反应[15]。心理压力增高是诱导ROS发生的重要机制,而ROS也在Met S,冠心病,2型糖尿病等诸多疾病的进程中发挥着重要作用。ROS是激活细胞内NF-κB信号通路的主要介导剂,抗氧剂在降低ROS含量的同时抑制NF-κB激活[16]。NADPH为细胞内一组具有氧化活性的酶复合体,是主要的ROS来源,它通过催化NADPH的单电子氧化将单个电子传递给氧分子,产生超氧阴离子自由基,由6种不同的亚基构成,其中Nox-4与ROS关系较密切的氧化酶[17]。活性氧积累与Nox-4的活性增加有关。Nox-4广泛存在于多种组织或细胞内如心血管内皮、平滑肌细胞[18]、脂肪细胞[19]、肾小管[20]等。
由于UA的临床意义重大,国内外学者讨论心理压力与血清尿酸(serum uric acid, SUA)水平之间的关系,然而尚未阐明其如何影响UA代谢的机制。机体受到心理应激作用导致ROS产生过多,超出机体氧化物的清除能力,使得氧化与抗氧化系统失衡,而引起氧化损伤的加重。本研究结果表明,stress诱导小鼠脂肪组织XO表达显著增高,进而导致UA的过量产生;并进一步引起脂肪组织中ROS指标(Nox-4)、抗氧化蛋白(Mn SOD、GSH-Px、Catalase)的表达异常,证明了心理应激诱导XO和Nox-4的过量产生是破坏脂肪氧化/抗氧化防御平衡的主要原因。脂肪组织中巨噬细胞是促炎因子的主要来源之一,并促使慢性炎症反应的发生;本研究发现,stress诱导脂肪组织单核细胞、中性粒细胞、嗜酸性粒细胞及浆细胞浸润反应和炎症性改变;同时stress诱导Adiponectin的表达降低以及导致脂肪细胞因子如MCP-1、IL-6、TNF-α的mRNA表达量显著升高,与control组相比存在明显差异;更重要的是,接受为期14 d的心理应激诱导小鼠脂肪分解(FFA)、糖代谢(IRS-1、GLUT-4)及促凝血因子(TF、PAI-1)表达异常。因此,我们认为脂肪组织氧化/抗氧化防御系统的平衡在维持脂肪稳态、炎症、高尿酸、糖代谢以及血栓形成中起关键作用。根据本研究结果,我们认为心理应激使脂肪组织氧化、抗氧化防御系统受损,进而出现脂肪细胞因子的异常表达,可能是心理压力相关高尿酸、糖代谢和凝血功能异常发生的机制之一。

