丹参对非酒精性脂肪肝Th17细胞及相关细胞因子的影响*
崔桂玉,白 剑,苗兰英,林大勇,王学良,刘喜成
(1. 内蒙古民族大学医学院,通辽 028000;2. 辽宁中医药大学,沈阳 110847;3. 深圳市人民医院麻醉科,广东 深圳 518020)
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)是一种与过量饮酒无关的,以肝脏脂类代谢异常,肝细胞内脂肪类物质蓄积过多而呈现弥漫性的肝脂肪变性为主要病理特征的一类临床综合征。随着人民生活水平的逐步提高,居民饮食习惯发生了改变,在膳食中的脂肪比例逐渐增加,使得NAFLD的发病率呈现出逐年增加的态势[1-2]。目前,NAFLD人群的数量在世界范围内已经达到约100万[3],严重危害人类健康。NAFLD发病机制不明,涉及炎症反应、脂质过氧化及免疫失衡等多种因素。近年来,越来越多的研究关注于免疫细胞及相关细胞因子在NAFLD中的作用,其中辅助性T细胞17 (T help cell 17, Th17)是研究的热点,大量实验研究也表明,Th17细胞与NAFLD的发生发展密切相关[4-5]。
中医药在NAFLD的治疗中应该广泛,中药复方的功效以单味药为基本单元,是在各种单味药发挥疗效的基础上相互影响所获得的。临床应用中,单味药能够更好的控制药品的有效成分,较少药物副作用,而且便于制定规范的质量标准,临床应用重复性较好。中药丹参(Salvia mil)所具有的养血护肝、活血化瘀的功效,能够有效改善肝脏微循环,清除氧自由基,抗肝纤维化,保护肝细胞[6]。既往研究表明,在NAFLD的中医药治疗中,丹参具有明显的降脂作用,临床上最为常用[7]。然而丹参是否能够通过免疫调节进而防治NAFLD及其具体机制尚不明确。本实验通过高脂喂饲建立NAFLD大鼠模型,探讨单味中药丹参对非酒精性脂肪肝Th17细胞及相关细胞因子的影响。
1 材料与方法
1.1 实验动物
SPF级别SD大鼠32只,全部为雄性,周龄为6,体重为170~200 g,由哈尔滨兽医研究所提供。大鼠买入后先予标准饲料适应性喂养1周,4~5只放置于1个动物盒内,每日正常光照,灯光照射周期为12 h/12 h,空气流通,自由饮水,饲养间室内温度为(20±2)℃,湿度维持在50%~65%,更换垫料的频率为隔天1次,以提供一个较为清洁的饲养环境,提高动物成活率。
1.2 实验试剂和仪器
高脂饲料(饲料配方:基础饲料、猪油30%、、酪蛋白25%、蔗糖8%、豆油3%、矿物质7%、纤维素7%、糊精20%);甘油三酯(triglycerides, TG)、总胆固醇(total cholesterol, TG)、高密度脂蛋白(high density lipoprotein, HDL-C)、低密度脂蛋白(low density lipoprotein, LDL-C)检测试剂盒由四川迈克生物科技有限公司提供;丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)检测试剂盒由北京中生北控生物科技股份有限公司提供;白细胞介素6(interleukin 6, IL-6)、白细胞介素17(interleukin 17, IL-17)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)酶联免疫法(ELISA)试剂盒由美国Cloud-Clone公司提供;苏木素-伊红染液(HE)由南京建成科技有限公司提供;维甲酸相关孤儿核受体(retinoic acid-related orphan nuclear receptor, RORγt)荧光PCR试剂盒由日本Toyobo公司提供;实验所需分析纯由国药集团提供。全自动生化检测仪(型号:TBA-40FR)由日本东芝公司提供;流式细胞仪(型号:FACSAria)由美国BD公司提供;荧光倒置显微镜(型号:CKX53+DP80)由日本Olympus公司提供;荧光实时定量PCR 仪(型号:7500)由美国Life公司提供;多功能全波长酶标仪(型号:SpectraMaxi3)由美国MD公司提供。
1.3 实验药物
单味中药丹参、葛根制备方法:将配制好的药材使用清水浸泡30 min,然后将药材加入到自动煎药包装机内(SANYANBZYl50K-1型,购买与天津三延精密机械有限公司),先用武火煎煮30 min,然后转文火煎制20 min,待药液温度转凉使用独立塑料袋进行包装,并且将做好的药包放置于-20℃的冰箱柜内保存,在使用时,将药液取出加热,耗掉大部分的水分,当药液浓缩到合适浓度(丹参0.5 g/ml,葛根1.5 g/ml),按照6.25 g·kg-1·d-1的浓缩液进行灌胃,疗程为4周。
1.4 实验方法
取32只雄性SD大鼠,按照随机数字表法随机分为4组,每组8只,分别为模型组、空白对照组、葛根对照组、丹参组。其中葛根对照组、丹参组每日给予相应单味药物按照6.25 g·kg-1·d-1的浓缩液进行灌胃,模型组、空白对照组给予等体积生理盐水灌胃,各组动物分别饲养4周。所有动物于第8周末麻醉后处死采血,收集肝脏组织称重,进行Real-time PCR及肝脏指数指标检测。空白对照组喂饲普通饲料4周;模型组采用高脂饲料喂养4周以建立NAFLD大鼠模型。
1.5 标本采集
实验完全结束(第8周),各组大鼠禁食12~14 h,禁水2 h后,称重,通过水合氯醛腹腔麻醉后,经腹主动脉采血20 ml,检测血脂相关指标TC、TG、LDL-C、HDL-C;肝功能指标ALT、AST;细胞因子IL-6、IL-17、TNF-α的水平。取2 ml全血检测Th17细胞;取出各组大鼠肝脏组织,称重,计算肝脏指数;运用Trizol法从剩余的肝脏组织中提取肝脏总mRNA,检测肝脏组织中RORγt基因表达;采用HE染色,观察肝脏组织的病理学改变。
1.6 血脂相关指标检测
取2 ml全血分离出血清和血浆,立即移至超低温冰箱保存,使用全自动生化检测仪按照试剂盒的操作说明检测血清TC、TG、LDL-C、HDL-C水平。
1.7 肝功能指标检测及肝组织病理学观察
取2 ml全血分离出血清和血浆,立即移至超低温冰箱保存,使用全自动生化检测仪按照试剂盒的操作说明检测血清ALT、AST水平。解剖取出各组大鼠肝脏,将新鲜的肝脏经过称量重量计算肝脏指数后,取体积为2.0 cm×2.0 cm×0.2 cm的新鲜组织,将切好的标本固定于10%中性福尔马林溶液中24 h,经酒精脱水和石蜡包埋后,将组织切成4 μm的薄片,而后展片、粘附、烤片。采用HE染色观察肝脏组织病理学改变。
1.8 外周血Th17、Treg细胞含量检测
Th17细胞抗体标记为FITC-抗CD4和PE-抗IL-17,CD4+IL-17+即为Th17含量;Treg细胞抗体标记为FITC-抗CD4和PE-抗CD25,CD4+CD25+即为Treg细胞含量。取2 ml肝素抗凝腹主动脉全血,分离出单个核细胞(peripheral blood mononuclear cells, PBMC) ,将细胞浓度设定为1×107cells/ml,置于温度为37℃,浓度为5%的CO2培养箱中培养4 h。取出100 μl细胞悬液,分别加入0.5 μl FITC-抗CD4及0.5 μl PE-抗IL-17、PE-抗CD25,混匀,4℃避光孵育25 min。24 h内上流式细胞仪检测。
1.9 血清Th17相关炎症指标检测
取2 ml全血分离出血清和血浆,立即移至超低温冰箱保存,采用ELISA法检测血清IL-6、IL-17、TNF-α水平,具体方法参照试剂盒操作说明。使用酶标仪读取数据。
1.10 肝脏组织RORγt基因表达检测
分别取各实验组大鼠肝脏组织,Trizol法提取其总RNA,其OD260/ 280均在1.8~2.2。反转录反应体系为: Total RNA,4 μl;5×Buffer 4 μl,RT Enzyme MixⅠ 1 μl;RT Primer Mix 1 μl,RNase FreedH2O 0.25 μl,反应条件为:37℃15 min,85℃ 5 s。cDNA扩增反应体系为:cDNA 2 μl,RNase FreedH2O 20 μl,RORγt基因以及β-actin内参上下游引物序列0.5 μl(表1),SYBR Premix Ex TaqⅡ 12.5 μl,反应条件:95℃10 min;95℃20 s,60℃ 20 s,40 个循环。采用2-ΔΔCT法计算样品中 mRNA 含量,以β-Actin作为内参照计算样品中 mRNA 相对表达量。计算各组大鼠RORγt mRNA 的表达量(△Ct值),计算公式为:△Ct=目的基因Ct-内参照基因Ct。
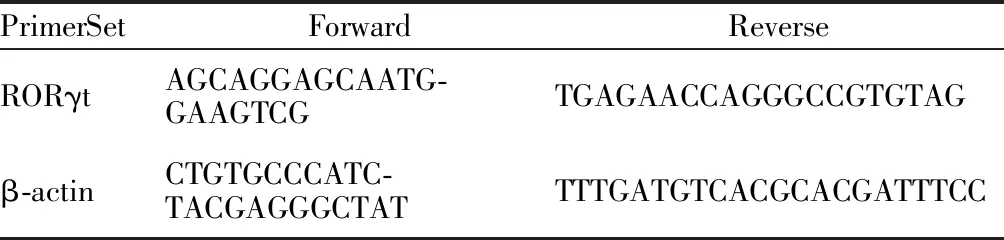
Tab. 1 Gene primer sequences of RORγt
1.11 统计学处理
2 结果
2.1 丹参对NAFLD大鼠血脂水平的影响
研究结果显示,丹参治疗组和葛根对照组大鼠TC、TG、LDL-C水平显著低于模型组(P<0.05);HDL-C水平显著高于模型组(P<0.05)。丹参治疗组TC、TG、LDL-C水平低于葛根对照组(P>0.05);HDL-C水平高于葛根对照组(P>0.05, 表2)。

Tab. 2 Effects of Salvia mil on serum lipid levels in rats(mmol/L, n=8)
*P<0.05vscontrol group;#P<0.05vsmodel group
2.2 丹参对NAFLD大鼠肝功能、肝脏指数及肝脏病理学的影响
2.2.1 丹参对NAFLD大鼠肝脏指数的影响 分别记录空白对照组、模型组、葛根对照组、丹参治疗组大鼠在实验开始前的起始体重以及实验结束时(8周末)的体重,以计算大鼠平均每周体重变化的重量。将大鼠处死后,取出肝脏组织并称取重量,计算肝脏指数,公式为:肝脏指数=肝脏的重量/大鼠的重量。实验结果显示,丹参治疗组、葛根对照组大鼠肝脏指数显著低于模型组(P<0.05);丹参治疗组大鼠肝脏指数低于葛根对照组(P>0.05,表3)。
Tab. 3 Effects of Salvia mil on liver mass index in n=8)
*P<0.05vscontrol group;#P<0.05vsmodel group
2.2.2 丹参对NAFLD大鼠肝功能的影响 实验结果显示,丹参治疗组、葛根对照组大鼠ALT、AST水平显著低于模型组(P<0.05);丹参治疗组大鼠ALT、AST水平显著低于葛根对照组(P<0.05,表4)。


GroupALTASTControl33.8±3.762.9±4.3Model102.4±5.1∗175.8±3.3∗Pueraria control39.6±2.4#83.3±5.4∗#Salvia mil35.6±2.3#Δ68.1±4.6#Δ
*P<0.05vscontrol group;#P<0.05vsmodel group;ΔP<0.05vspueraria control group
2.2.3 丹参对NAFLD大鼠肝脏病理学的影响 正常对照组的肝细胞排列整齐,呈放射状排列,核大而圆,胞质均匀,位于细胞的中央,肝小叶形状规则而完整,肝细胞未见脂肪变;与正常对照组相比,模型组肝细胞排列不规则,体积明显增大,肝小叶消失,在肝细胞质内有大量的脂滴空泡,并可见大量的炎性灶,说明NAFLD模型复制成功;葛根对照组大鼠肝细胞排列整齐,呈条索状排列,核圆居中,细胞质均匀无脂肪变,肝小叶形状规则完整;丹参治疗组大鼠肝细胞排列整齐,呈条索状排列,核圆局中,细胞质均匀无脂肪变,炎性灶明显减少,肝小叶形状规则完整,肝窦正常。
2.3 丹参对NAFLD大鼠外周血Th17、Treg细胞含量的影响
实验结果显示,丹参治疗组、葛根对照组大鼠外周血Th17细胞含量显著低于模型组(P<0.05);Treg细胞含量、Treg/ Th17比例显著高于模型组(P<0.05);丹参治疗组大鼠Th17细胞含量显著低于葛根对照组(P<0.05);Treg/ Th17比例显著高于葛根对照组(P<0.05,表5)。

GroupTh17(%)Treg(%)Treg/ Th17Control1.46±0.144.59±0.213.14±0.26Model3.50±0.16∗3.71±0.22∗1.06±0.24∗Pueraria control1.69±0.20#4.52±0.19#2.67±0.26#Salvia mil1.58±0.18#Δ4.58±0.18#2.91±0.25#Δ
*P<0.05vscontrol group;#P<0.05vsmodel group;ΔP<0.05vspueraria control group
2.4 丹参对NAFLD大鼠Th17相关炎症指标及肝组织RORγt基因表达的影响
实验结果显示,丹参治疗组、葛根对照组大鼠IL-6、IL-17、TNF-α水平显著低于模型组(P<0.05);丹参治疗组大鼠IL-6、IL-17水平显著低于葛根对照组(P<0.05);丹参治疗组、葛根对照组大鼠RORγt基因表达量显著低于模型组;丹参治疗组大鼠RORγt基因表达量显著低于葛根对照组(P<0.05,表6)。
Tab. 6 Effects of Salvia mil on the levels of IL-6, IL-17 and TNF-α in n=8)
*P<0.05vscontrol group;#P<0.05vsmodel group;ΔP<0.05vspueraria control group
3 讨论
NAFLD主要是由于甘油三酯在肝内过度堆积而引发的肝脏疾病,目前已成为我国乃至全球性的严重公共卫生问题[8]。目前NAFLD的发病机制并不明确,因此,深入探索NAFLD的发病机制,并寻找行之有效的治疗方法具有非常重要的临床意义。本次实验通过高脂喂饲4周,模型组大鼠的血脂(TC、TG、HDL-C、LDL-C)水平、肝功能损伤特异性标记物(AST、ALT)水平显著升高,肝脏发生脂肪变性,有大量炎症细胞浸润,成功复制了NAFLD大鼠模型,中医认为“脾虚肝郁,痰浊瘀阻”是NAFLD的关键病机[9],丹参具有养血护肝、活血化瘀作用,在NAFLD的治疗中应用非常广泛,是应用频率较高的药物。既往研究表明,丹参能够促进脂肪在肝中氧化、降低肝脏脂肪含量并明显改善NAFLD大鼠的肝脏脂质沉积[10]。丹参酮ⅡA作为中药丹参的主要有效成分之一,能够通过调节CD4+T细胞及IL-17等炎症因子,从而发挥调节机体免疫功能及抗炎等作用[11,12]。
目前越来越多的研究表明,NAFLD与机体的免疫功能及炎症细胞因子失衡密切相关[13],Th17细胞和Treg细胞的失衡是其主要病理机制之一。Th17细胞是CD4+淋巴细胞重要亚群,参与多种炎症性及免疫性疾病,能够诱导上皮细胞分泌IL-6、IL-17以及TNF-α等促炎因子,进而促进炎症反应、肝细胞炎症及脂肪变性的发生发展,而Treg细胞具有免疫抑制作用,主要参与免疫应答或免疫抑制的调控[14,15]。本次实验结果表明丹参治疗组大鼠外周血Th17细胞含量显著低于模型组及葛根对照组;Treg细胞含量高于模型组及葛根对照组;丹参治疗组大鼠IL-6、IL-17、TNF-α水平均低于模型组及葛根对照组,且IL-6、IL-17水平下降尤为明显。说明丹参能够通过降低Th17细胞含量,进而减少IL-6、IL-17、TNF-α的分泌,抑制肝脏炎症反应及脂肪变性,从而发挥疗效。RORγt是维甲酸相关核孤儿受体的家族成员之一,是Thl7分化的特异性关键转录因子,CD4+T细胞能够STAT3通路调控RORγt向Th17分化,RORγt的缺失会导致Thl7的分化缺失[16]。本次实验结果显示,丹参治疗组大鼠RORγt基因表达量显著低于模型组及葛根对照组,说明丹参能够通过降低RORγt基因表达而抑制Th17分化。
综上所述,单味中药丹参通过降低血清中IL-6、IL-17、TNF-α水平,抑制RORγt基因表达,降低外周血Th17细胞含量,升高Treg细胞含量,调整Th17/Treg平衡,进而发挥有效防治NAFLD发生发展的作用。这为丹参临床治疗非酒精性脂肪肝提供一定的实验依据

