甘西鼠尾草对大鼠高原肺动脉高压的干预作用及机制*
王亚峰,王爱霞,王生彪,朵德龙,李 茜,严英俊
(青海省人民医院静配中心,西宁 810007)
HAPH主要是因高原习服不适应或不良适应而引起的以肺血管收缩、肺血管重构以及肺血管平滑肌细胞过度增殖等病理改变为特征的疾病,其中肺动脉平滑肌细胞过度增殖和肺血管重构被认为是HAPH最主要的病理机制[1]。此外,研究表明,RhoA/ROCK信号通路过度激活在人类肺动脉高压发病过程中起到重要作用,故抑制这一信号通路亦是治疗肺动脉高压的重要靶标之一[2]。甘西鼠尾草又名大紫丹参、甘肃丹参,为唇形科鼠尾草属植物,主产于甘肃、四川、云南、西藏和青海等地,是著名的藏药之一(藏药名:吉恩子保)[3],其作为青藏高原丹参的代用品,是目前治疗心血管疾病和高原病的常用中藏药材[4]。本实验通过采用实地高原环境构建HAPH大鼠模型,旨在探究SPM预防HAPH的作用,并通过研究其在抑制平滑肌细胞增殖和RhoA/ROCK信号通路方面的作用探究其可能的分子机制,现将有关结果汇报如下。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠70只,体重120~160 g,SPF级,均购自西安交通大学实验动物中心,许可证号:SCXK(陕)2017-003。
1.2 药品和试剂
SPM药液(自制):为SPM药材采用70%的乙醇溶液超声提取、过滤、干燥后所得的浸膏粉用蒸馏水配置所得;氨基甲酸乙酯(乌来糖):购自上海展云化工有限公司;肝素钠注射液:购自江苏万邦生化医药集团有限责任公司;RNA提取试剂盒(批号:AA6901-1)、逆转录试剂盒(批号:AI40713A)和RT-PCR反应试剂盒(批号:AA1102-1)以及引物(批号:CIPG886)均购自TaKaRa公司。
1.3 仪器和设备
MP150十六导生理信号采集系统(BioPac,美国)、高速低温台式离心机(Eppendorf,德国)、NanoDrop核酸浓度测量仪(Thermo,美国)、实时定量PCR仪(Applied Biosystems,美国)。
1.4 动物分组与给药
将70只SD大鼠随机分成对照组、缺氧组、SPM(0.5 g/kg、1 g/kg、2 g/kg)剂量组,每组14只,对照组饲养于西宁(海拔约2 260 m),其余组均饲养于玛多县人民医院(海拔约4 260 m)。SPM剂量组灌胃不同浓度的SPM(1 ml/100 g),浓度分别为0.5 g/kg、1 g/kg、2 g/kg(1 g/kg剂量为SPM生药临床常用剂量的等效剂量),对照组和缺氧组灌胃等体积蒸馏水,每日一次,连续处理4 周。
1.5 大鼠平均动脉压mPAP测定
4周后每组大鼠经腹腔注射20%的乌拉坦(100 mg/kg)麻醉后仰位固定于手术台上,分离右侧颈静脉,然后将与压力传感器相连的聚乙烯导管迅速插入血管,根据MP150十六导生理信号采集系统采集到的血压波形曲线调整导管的位置,导管经上腔静脉、右心房、右心室、最终到达肺动脉,从而测得各组大鼠的mPAP[5]。
1.6 大鼠肺组织中PCNA、CDK4、CyclinD1、RhoA、ROCK1、ROCK2的mRNA表达水平测定
大鼠经放血处死后,迅速取右肺下叶组织约1 g,剪碎,用锡箔纸包裹后装于无酶管中,置液氮中保存备用(约2 min左右完成)。取冻存的肺组织样品,用RNA提取试剂盒分别提取总RNA后,按逆转录试剂盒操作步骤依次进行后续的RT反应。以2 μl得到的cDNA产物为模板,以GAPDH为内参,在PCR反应体系中扩增相应基因片段,每个样品进行3次RT-PCR实验,具体采用两步法PCR反应程序,第一步反应条件为95℃,120 s,1个循环,第二步反应条件为95℃,30 s,60℃,60 s,40个循环,95℃,10 s,60℃,60 s。反应结束后确认RT-PCR的扩增曲线和融解曲线,确认得出数据的可信性,并以GAPDH做归一化处理后,通过F=2-△△ct计算mRNA的相对表达量。具体引物序列详见表1。

Tab. 1 Primer sequences
1.7 统计学处理
2 结果
2.1 SPM对大鼠mPAP的影响
由表2可知,与对照组比较,缺氧组大鼠的mPAP明显升高(P<0.01),提示HAPH造模成功。与缺氧组比较,SPM各剂量组大鼠的mPAP均降低,且1 g/kg和2 g/kg剂量组的mPAP与缺氧组比较(P均<0.01)。
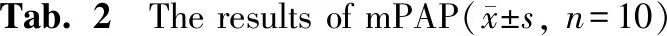
**P<0.01vscontrol group;##P<0.01vshypoxia group
2.2 SPM对肺组织中PCNA、CDK4及CyclinD1 mRNA表达的影响
由表3可知,与对照组比较,缺氧组大鼠肺组织中PCNA、CDK4及CyclinD1 mRNA表达水平均升高(P<0.01);与缺氧组比较,SPM各剂量组大鼠肺组织中PCNA、CDK4及CyclinD1 mRNA表达水平均显著降低(P<0.01)。
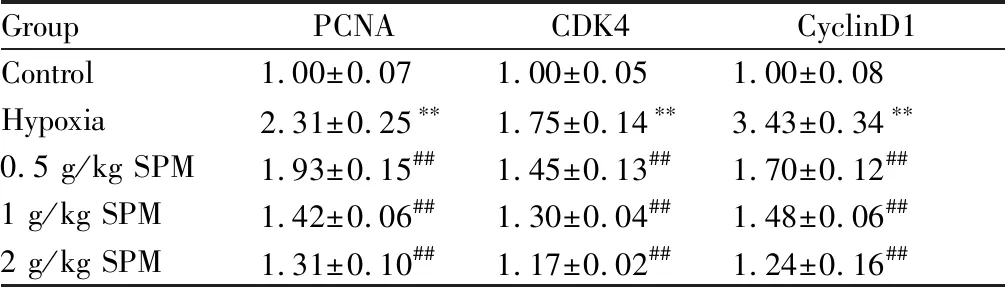
GroupPCNACDK4CyclinD1Control1.00±0.071.00±0.051.00±0.08Hypoxia2.31±0.25∗∗1.75±0.14∗∗3.43±0.34∗∗0.5 g/kg SPM1.93±0.15##1.45±0.13##1.70±0.12##1 g/kg SPM1.42±0.06##1.30±0.04##1.48±0.06##2 g/kg SPM1.31±0.10##1.17±0.02##1.24±0.16##
**P<0.01vscontrol group;##P<0.01vshypoxia group
2.3 SPM对肺组织中RhoA、ROCK1及ROCK2 mRNA表达的影响
由表4可知,与对照组比较,缺氧组大鼠肺组织中RhoA、ROCK1及ROCK2 mRNA表达水平均升高(P<0.01);与缺氧组比较,SPM各剂量组大鼠肺组织中RhoA、ROCK1及ROCK2 mRNA表达水平均显著降低(P<0.05或P<0.01)。
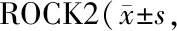
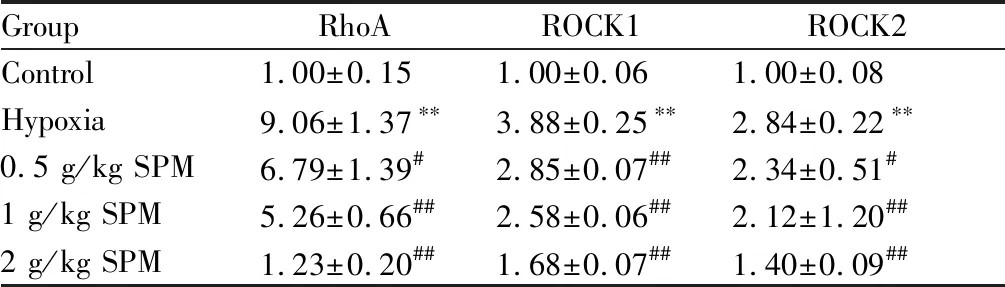
GroupRhoAROCK1ROCK2Control1.00±0.151.00±0.061.00±0.08Hypoxia9.06±1.37∗∗3.88±0.25∗∗2.84±0.22∗∗0.5 g/kg SPM6.79±1.39#2.85±0.07##2.34±0.51#1 g/kg SPM5.26±0.66##2.58±0.06##2.12±1.20##2 g/kg SPM1.23±0.20##1.68±0.07##1.40±0.09##
**P<0.01vscontrol group;#P<0.05,##P<0.01vshypoxia group
3 讨论
HAPH是一种常见的慢性高原病,是因长期暴露于高海拔环境而引起的以肺动脉压持续升高和肺血管重构为特征的疾病,若不及时治疗,可发展为严重的心脏病、心衰甚至死亡[6-7]。当前对于该疾病的治疗手段主要以干预血管收缩因子为主,如吸氧、NO吸入治疗、使用钙通道阻滞剂和磷酸二酯酶抑制剂等,这些治疗措施的特点是仅能缓解症状,很难逆转疾病的恶化[8],加之HAPH的预后不佳,不仅增加患者的经济负担,而且严重影响患者的生活质量[9],故研究新型治疗药物刻不容缓。本研究发现测试剂量的SPM均可降低HAPH大鼠的mPAP,其中1 g/kg和2 g/kg给药组大鼠的mPAP降低作用更显著,且与模型组比较均具有显著性差异。但是就两个剂量的mPAP而言,并无显著性差异,提示给予临床常用剂量的等效剂量即1 g/kg的SPM,即可发挥明显的预防HAPH的作用。
HAPH是一种进行性的疾病,具体病因机制目前尚不明确,其病理改变主要涉及肺血管收缩反应、持续的肺动脉压升高、肺血管重构等方面[10]。研究表明[11],高原低氧可刺激肺血管收缩和肺血管抵抗增加,导致肺血管重构和平滑肌细胞增殖增加,而肺动脉平滑肌细胞的过度增殖和肺血管重构是HAPH最重要的病理机制[12]。故抑制肺动脉平滑肌过度增殖和逆转肺血管重构是预防和治疗HAPH的重要靶标。PCNA是细胞增殖的分子标志物之一,是一种核蛋白和DNA聚合酶的辅因子,静息期细胞很少表达PCNA,其主要在细胞周期的S期被检测到[13-14];同时CDK4和CyclinD1是细胞增殖过程中G0/G1期向S期转化的关键调控因子,而且其可激活细胞周期进程中重要的转录因子[15]。本研究发现SPM可明显降低大鼠肺组织中PCNA、CDK4以及CyclinD1的mRNA表达水平,从而抑制细胞的增殖过程,提示SPM可能具有抑制肺动脉平滑肌细胞过度增殖的作用。
尽管目前启动肺血管重构的分子和细胞机制尚不清楚,但前期研究已经表明,RhoA/ROCK信号通路可直接影响细胞的增殖、凋亡、收缩和运动,从而在人类肺动脉高压的病理进程中发挥重要作用[16-17],而且已有研究表明,ROCK特异性抑制剂可通过抑制肺动脉平滑肌细胞过度增殖、改善内皮细胞功能紊乱和炎细胞浸润而抑制肺动脉重构、改善肺动脉血流分布,从而降低肺动脉压[18-20]。RhoA是一种小型单体G蛋白,属于调节细胞生长、分化和生存的Ras超家族蛋白;ROCK则为分子量约160 kDa的丝氨酸/苏安酸激酶,其有两种亚型,分别是ROCK1和ROCK2,且上述因子均可在血管平滑肌细胞内表达[19]。本研究结果显示,SPM可明显降低RhoA、ROCK1和ROCK2在肺组织中的mRNA表达水平,提示SPM可能对RhoA/ROCK信号通路过度激活具有一定的抑制作用。
综上所述,甘西鼠尾草对大鼠HAPH具有一定的预防作用,其机制可能与抑制肺动脉平滑肌细胞过度增殖和RhoA/ROCK信号通路过度激活有关。对其发挥作用的具体成分和深入的作用机制尚待进一步的研究确定。
致谢:感谢青海大学医学院高原医学研究中心在本研究中所给予的大力支持和帮助!

