黑茶曲霉属和散囊菌属真菌产胞外水解酶能力的比较分析
李若曦,方洪枫,王国红,杨民和,2
(1.福建师范大学生命科学学院,福建 福州 350108;2.工业微生物教育部工程研究中心,福建 福州 350108)
【研究意义】黑茶制作过程中的渥堆工艺是形成黑茶独特品质的关键步骤[1]。在渥堆过程中,茶叶化学成分在微生物酶促作用和湿热作用下发生一系列变化[2-3]。其中,微生物发酵过程中产生的水解酶起主导作用,从而促使黑茶在许多方面有别于绿茶、青茶和红茶,表现为甘、醇、香等品质。这些品质是由于在黑茶发酵过程中微生物分泌的胞外酶作用于茶叶的大分子碳水化合物、蛋白质和单萜烯配糖体,分别分解成小分子糖、氨基酸和单萜烯醇化合物所带来的[4]。另外,茶叶中的多酚化合物经微生物分泌的氧化酶作用转化为茶黄素、茶红素和茶褐素,使得黑茶茶汤拥有独特的红褐底色[5]。
【前人研究进展】普洱茶、茯砖茶、藏茶和六堡茶是我国黑茶产品的代表。黑茶发酵相关微生物的研究在普洱茶和茯砖茶中较多[6]。参与普洱茶发酵的微生物主要以黑曲霉(Aspergillus niger)为主[7],而茯砖茶中主要以冠突散囊菌(Eurotium cristatus)为主[8],其他的黑茶发酵微生物也主要以曲霉属(Aspergillus)和散囊菌属(Eurotium)真菌为主[9]。这些真菌在茶叶发酵过程中的生化代谢作用及其酶协同催化机制,已经引起茶业界的广泛关注[6,10]。真菌利用茶叶作为培养基质产生多酚氧化酶、单宁酶和纤维素酶等酶类有较多的报道[11-14]。其中,以对黑茶发酵相关的优势真菌如黑曲霉和冠突散囊菌的胞外酶研究较多。曲霉属真菌,包括黑曲霉,是产生和分泌蛋白酶、糖苷酶和脂肪酶的重要工业微生物[15]。鉴别平板检测条件下,冠突散囊菌可以呈现果胶酶、淀粉酶、脂肪酶和蛋白酶活性[12],而在液体发酵条件下,冠突散囊菌检测到纤维素酶、多酚氧化酶、漆酶和蛋白酶[16]。近年来,采用组学技术对茶叶发酵过程中微生物群落和蛋白的动态变化作了初步分析[10,17-19],从更为宏观的角度揭示了蛋白和生物酶在茶叶发酵中的作用。【本研究切入点】这些研究大多分析单一菌株的水解酶活性和自然条件下发酵茶的蛋白质组学特征,缺乏茶叶发酵过程中微生物胞外水解酶的系统分析,以及黑曲霉和冠突散囊菌产酶特性的比较。鉴于此,本研究挑选分离自中国不同产地黑茶中曲霉属和散囊菌属的9个菌株,分析和比较不同菌株产生胞外水解酶的能力。【拟解决的关键问题】探究菌株之间产生胞外水解酶的差异,为综合利用不同菌株创制人工混合菌种提供理论依据。
1 材料与方法
1.1 试验材料
供试9个真菌菌株为FZ-2、LP-5、LP-9、PE-1、PE-3、XP-5、YA、JX和PE。菌株FZ-2、PE-1、LP-5、PE、YA和JX为散囊菌属真菌,菌株PE-3、LP-9和XP-5为曲霉属真菌。菌株由福建师范大学生命科学学院微生物实验室保存于DG18斜面培养基中。其中,FZ-2分离自湖南产茯砖茶,LP-5和LP-9分离自广西六堡茶,PE-1、PE-3、XP-5和PE分离自云南产普洱茶,YA和JX分离自四川产藏茶。供试9个菌株接种于DG18琼脂培养基,置于28℃恒温培养箱中培养7 d。
1.2 试验方法
1.2.1 菌株产胞外水解酶鉴别平板检测 参照郑丽等[20]和杨金梅等[18]的方法,采用固体培养基平板,分别检测纤维素酶、果胶酶、木聚糖酶、淀粉酶、单宁酶和蛋白酶等6种水解酶的活性。
1.2.2 真菌孢子悬浮液的制备 将菌株PE-1和PE-3分别接种到DG18琼脂培养基上活化,待菌落长满整个平板后,取10~15 mL无菌水倒入菌落表面,用接种针刮取菌落表面的孢子,用1~5 mL移液枪将孢子悬液移入带玻璃珠的无菌150 mL三角瓶中,充分振荡以分散孢子,调整孢子悬浮液浓度为3×107~ 4×107个/mL,备用。
1.2.3 绿茶固态发酵 称取10 g产自福建省宁德市的高山绿茶,放置于250 mL三角瓶中,加入10 mL蒸馏水,在115℃高压灭菌30 min。在超净工作台中,分别吸取1 mL不同菌株的孢子悬浮液加入茶叶固体发酵培养基中,充分晃动摇匀后,将该培养基置于28℃恒温培养箱中培养14 d。
1.2.4 粗酶液制备 绿茶发酵完成后,在三角瓶中加入50 mL 磷酸盐缓冲液(0.05 mol/L,pH 8.0),置于4℃、150 r/min摇床中浸提12 h。浸提液用8层纱布过滤,浸提液在4℃、10 000 r/min下离心10 min,除去沉淀,上清液即为粗酶液。
1.2.5 酶活性检测 采用DNS法分别测定纤维素酶、木聚糖酶、果胶酶和淀粉酶的活力[20];参照高琛等[13]的方法测定单宁酶活力;参照周景祥等[21]的方法测定蛋白酶活力。
1.3 数据分析
试验数据采用IBM SPSS Statistics 19软件进行分析与比较,并用Origin 85进行统计分析与作图。
2 结果与分析
2.1 鉴别平板检测法比较不同菌株产水解酶能力
2.1.1 纤维素酶活力比较 纤维素酶鉴别培养基检测结果见表1,菌株JX的d/D比值最大为1.93,与菌株LP-9相比差异不显著,但极显著大于其他菌株。散囊菌属的菌株在纤维素酶鉴别培养基上生长受到限制,菌落较小。3株曲霉属菌株生长较好,菌落扩展相对较快。供试9个菌株在纤维素酶鉴别平板上均能产生变色圈,初步判断这些菌株都有产生纤维素酶的能力。
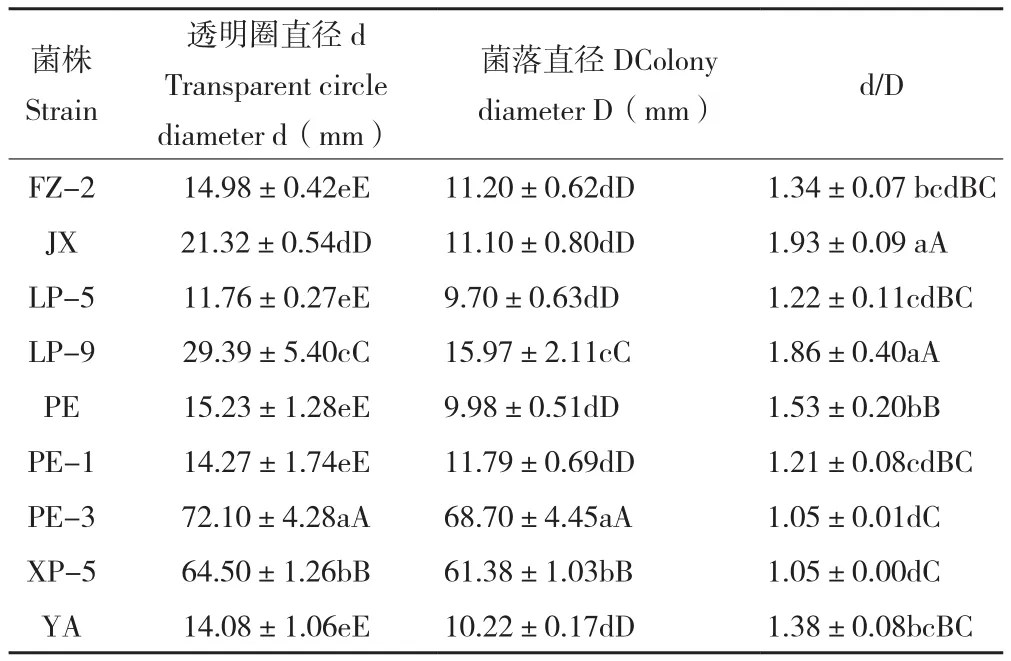
表1 不同菌株在纤维素酶鉴别培养基上产生的变色圈比较Table 1 Comparison of discoloration rings produced by different strains on cellulase plate
2.1.2 不同菌株产果胶酶能力比较 通过果胶酶鉴别培养基初步筛选出两株产果胶酶的菌株PE-3和XP-5。产果胶酶的菌株在果胶酶鉴别培养基上生长后,其菌落周围产生黄色水解圈;菌株PE-3和XP-5能够很好地使添加了溴酚蓝的果胶酶鉴别培养基由蓝变黄。其他7个菌株在果胶酶鉴别培养基上未见明显变色现象。
2.1.3 不同菌株产木聚糖酶能力比较 菌株在木聚糖酶鉴别培养基上生长后,如果有浅紫色变色圈产生,说明菌株能产生木聚糖酶。由表2可知,供试9个菌株均呈现颜色变化。其中,菌株PE-1在木聚糖酶鉴别培养基上生长的菌落最小,但其d/D比值最大、为1.23,极显著大于其他菌株。菌株PE生长状况较好,菌落直径为63.17,变色圈直径为70.17,说明其在木聚糖酶鉴别培养基上产酶能力和生长速度都较好。菌株LP-5、LP-9、PE-3和XP-5由于生长过程中分生孢子散落,产生许多小菌落和相应变色圈,无法准确测量其大小,需进一步通过其他方法测定其产木聚糖酶的能力。
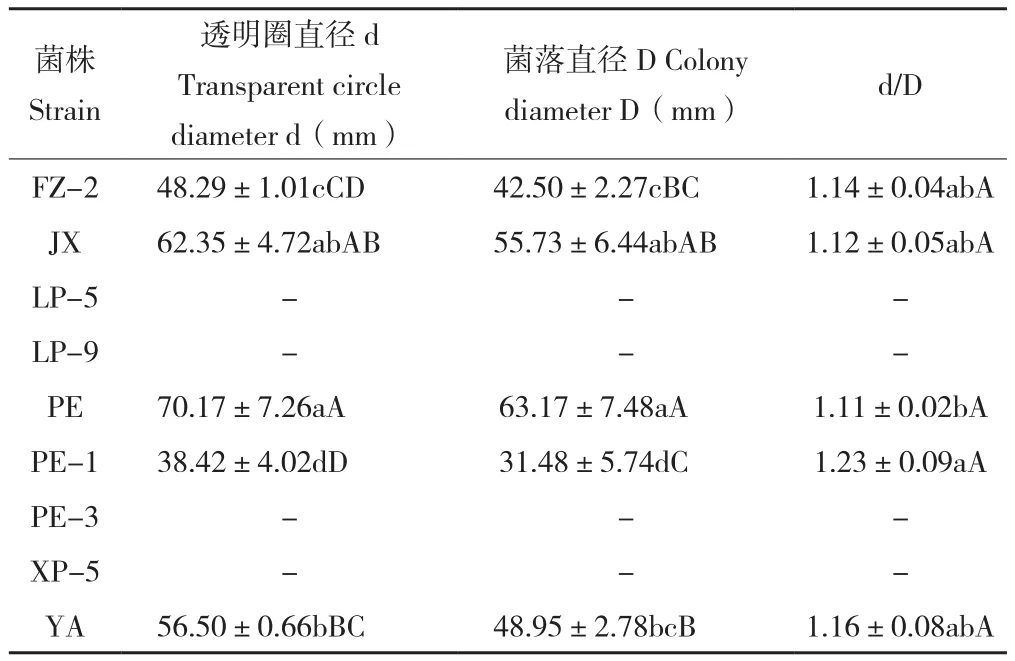
表2 不同菌株在木聚糖酶鉴别培养基上产生的变色圈比较Table 2 Comparison of discoloration rings produced by different strains on xylanase plate
2.1.4 不同菌株产淀粉酶能力的比较 采用淀粉酶鉴别平板筛选,从9株供试菌株中初步筛选出7个菌株呈现淀粉酶活性(表3)。其中,菌株LP-5、LP-9在淀粉酶鉴别平板上生长情况较好,菌落生长速度较快,说明这两株菌能很好地利用淀粉这一碳源;透明圈直径也较大,说明菌株产淀粉酶的能力较其他菌株强。这些菌株中,菌株PE的d/D比值最大,与菌株JX、PE-1和YA相比差异显著,与其他菌株相比差异不显著。

表3 不同菌株在淀粉酶鉴别培养基上产生的透明圈比较Table 3 Comparison of transparent areas produced by different strains on amylase plate
2.1.5 不同菌株产单宁酶能力的比较 9个菌株在单宁酶鉴别平板上均分泌单宁酶,但产单宁酶的能力较弱,d/D比值均小于1.20(表4)。其中,菌株PE-3和XP-5在单宁酶鉴别平板上生长较快,在菌落周围产生明显的透明圈,说明这两个菌株产单宁酶能力较强。但由于其生长过程中孢子散落,无法通过直接测量菌落直径来与其他菌株比较产单宁酶能力,之后可进一步通过其他方法来测定其产酶能力。菌株PE和JX的d/D比值最小,菌落直径和透明圈直径基本重合,但从培养基背面观察透明圈明显,推测可能产胞内单宁酶。
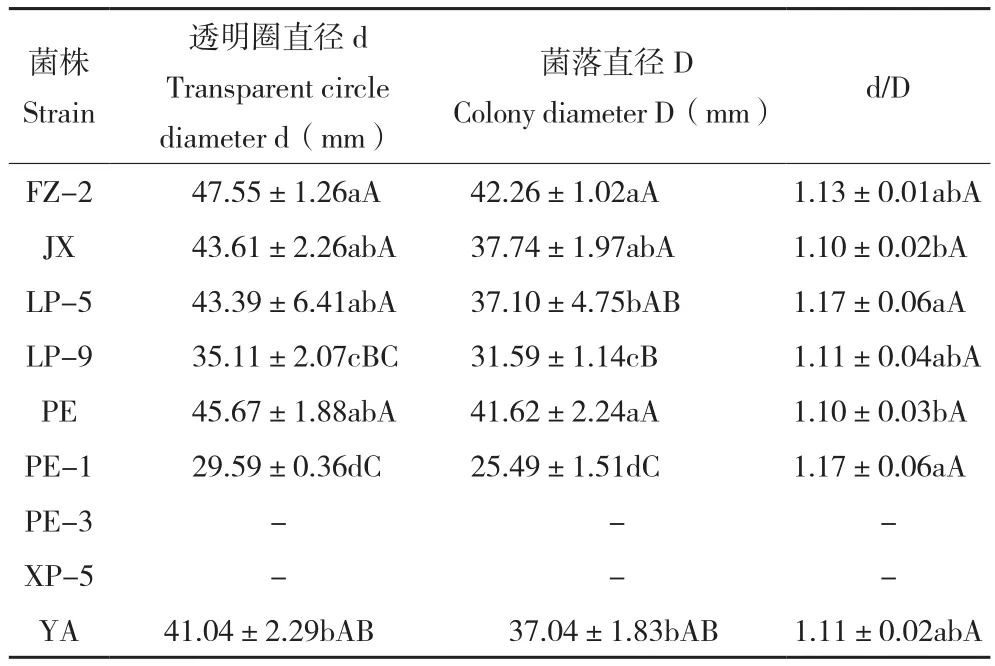
表4 不同菌株在单宁酶鉴别培养基上产生的透明圈比较Table 4 Comparison of transparent areas produced by different strains on tannase plate
2.1.6 不同菌株产蛋白酶能力的比较 9个菌株在蛋白酶鉴别培养基上生长较快,说明菌株能很好地利用干酪素。通过蛋白酶鉴别平板仅筛选到1株产蛋白酶的菌株LP-9,菌落面积较大,透明圈较大且清晰。除菌株LP-9外,其他菌株未观察到透明圈或透明圈不清晰。
2.2 酶活测定法比较不同菌株产水解酶能力
2.2.1 纤维素酶活力比较 菌株PE-1和PE-3的纤维素酶活力分别为3.09、6.84 U/mL(表5),菌株PE-3与菌株PE-1产纤维素酶活力存在极显著性差异;在相同的茶叶固体发酵条件下,菌株PE-3分泌的纤维素酶较多,菌株PE-3产纤维素酶能力极显著高于菌株PE-1。
2.2.2 果胶酶活力比较 酶活检测结果(表5)显示,菌株PE-3的果胶酶活力为12.51 U/mL,菌株PE-1则没有测定到吸光值,菌株PE-1与菌株PE-3产果胶酶活力存在极显著差异,说明在绿茶固体发酵的条件下,菌株PE-3分泌果胶酶,而菌株PE-1不分泌果胶酶。

表5 菌株PE-1和PE-3不同水解酶活力的比较Table 5 Comparison of different hydrolase activity of strains PE-1 and PE-3
2.2.3 木聚糖酶活力比较 菌株PE-1和PE-3的木聚糖酶活力分别为7.16、10.07 U/mL,菌株PE-3与菌株PE-1产木聚糖酶活力存在显著差异(表5),表明在茶叶固体发酵条件下,菌株PE-3分泌的木聚糖酶较多。
2.2.4 淀粉酶活力比较 菌株PE-1和PE-3的淀粉酶活力分别为13.53、33.81 U/mL(表5),菌株PE-3产淀粉酶的能力极显著高于菌株PE-1,表明菌株PE-3的淀粉酶分泌量明显多于菌株PE-1。在淀粉酶鉴别平板上,菌株PE-3没有观察到菌落周围有透明圈产生,而通过茶叶固体发酵后检测到淀粉酶的存在,并且高于菌株PE-1的产量。
2.2.5 蛋白酶活力比较 菌株PE-1和PE-3的蛋白酶活力分别为2.50、0.50 U/mL,菌株PE-1与菌株PE-3产蛋白酶活力存在极显著差异(表5)。但二者产蛋白酶酶活力都不强,与之前蛋白酶鉴别平板显示的结果基本一致。
2.2.6 单宁酶活力比较 以绿茶作为发酵培养基,菌株PE-1和PE-3菌丝生长旺盛,产孢能力强。菌株PE-1和PE-3的单宁酶酶活力分别为132.09、68.93 U/mL(表5)。表明在茶叶固体发酵条件下,菌株PE-1产单宁酶的能力极显著强于菌株PE-3。
3 讨论
鉴别平板检测和酶活性分析的结果显示,曲霉属菌株(PE-3、XP-5和LP-9)在分泌大分子碳水化合物水解酶(纤维素酶、果胶酶、木聚糖酶和淀粉酶)方面显著强于散囊菌属菌株;而散囊菌属菌株在分泌蛋白酶和单宁酶方面则显著强于曲霉属菌株。纤维素、木聚糖和果胶是茶叶细胞壁的主要成分,淀粉是茶叶细胞质的重要成分,在水解酶作用下分解为小分子糖类,是茶水甘、醇滋味的主要贡献者,也为茶叶发酵微生物提供碳素能源[4,6]。茶多酚是茶叶的特征性成分,是茶水特殊风味和生理功能的主要来源[3-4]。单宁酶在水解茶单宁,将茶叶中的酯型儿茶素水解转化为非酯型儿茶素方面发挥重要作用[13]。而蛋白酶分解茶叶蛋白质产生的氨基酸,是茶水“鲜”味的主要来源[4]。已有的研究大多分析单一菌株纯培养条件下的产酶能力,如丁婷等[11]、陈桂梅等[12]、颜正飞等[16]和杨金梅等[18]研究不同冠突散囊菌菌株的胞外水解酶,或研究普洱茶自然发酵过程中茶叶样品中的水解酶活性[14,15,20,22-23],难于体现不同微生物产酶能力的差异。在相同的培养条件下,曲霉属和散囊菌属的真菌产生的水解酶存在明显差异,对底物有一定的选择性,可能导致这两个属的真菌在利用培养基质方面存在差异。
在绿茶固态发酵条件下,菌株PE-1产生纤维素酶、木聚糖酶、淀粉酶、蛋白酶和单宁酶等5种水解酶,菌株PE-3产生本研究测试的全部6种水解酶。菌株PE-1在鉴别平板上没有检测到果胶酶和蛋白酶活性,固态发酵条件下没有检测到果胶酶活性。菌株PE-3在鉴别平板上没有检测到淀粉酶和蛋白酶活性,而在酶活测定条件下检测到所有6种水解酶活性。因此,不同的培养基质和培养条件明显影响真菌水解酶的产生和表达。在黑茶相关微生物酶活性检测试验中,已有的研究大多采用特定诱导底物和鉴别平板法检测[11-13,16,18];或以茶水作为诱导物,诱导微生物水解酶的产生[16]。鉴别平板法侧重于酶活性的定性分析,灵敏度不够,容易产生误差[24]。茶水诱导在液体发酵条件下进行,与茶叶固态发酵条件也存在明显差异。近年来,蛋白组分析技术应用于茶叶发酵过程中酶蛋白分析的研究逐渐增多[10,18-19]。蛋白组学分析可以从宏观上了解微生物发酵过程中群体的酶活性表达情况,但难以说明不同微生物具体的产酶能力。采用鉴别平板检测和酶活性分析相结合,以茶叶作为固态发酵基质,更加接近于生产实际;通过比较分析,可以更具体地说明菌株PE-1和PE-3的产酶能力和差异。
自然条件下,黑茶渥堆在混合菌的作用下完成[7-8,10,17]。混和菌发酵可以充分利用不同菌株的协同作用,提高微生物对发酵基质的利用效率;有些微生物代谢产物的产生在纯菌发酵条件下难以实现,必须通过混合菌种的发酵才能完成[25-26]。菌株PE-1和PE-3是分离自普洱茶的真菌,菌株PE-1经初步鉴定为冠突散囊菌,而菌株PE-3鉴定为黑曲霉,分别代表我国黑茶产品中两种与黑茶品质和风味关系密切的优势真菌[6-7]。黑曲霉PE-3产生的大分子碳水化合物水解酶(纤维素酶、果胶酶、淀粉酶和木聚糖酶)酶活显著高于冠突散囊菌;而冠突散囊菌PE-1分泌的蛋白酶和单宁酶活则显著高于黑曲霉。黑曲霉和冠突散囊菌在茶叶发酵条件下胞外水解酶的种类和酶活的差异,暗示不同属的真菌在利用有机质方面有选择性,可能存在水解酶的协同催化作用。深入研究菌株PE-1和PE-3胞外酶活性和产酶条件,通过优化培养条件创制混合人工菌种,可为黑茶加工和标准化生产提供指导。
4 结论
从我国黑茶产品中分离的曲霉属和散囊菌属菌株,同一菌株可以分泌多种胞外水解酶,多个菌株也可以产生同一种水解酶,不同菌株产生胞外水解酶能力存在显著差异。在茶叶发酵过程中,曲霉属和散囊菌属菌株分泌的水解酶具有对茶叶不同成分的选择性,水解酶的协同作用可能影响菌株对茶叶成分的生物转化和利用效率,从而影响黑茶的风味和品质。

