白藜芦醇在胰岛素抵抗、糖尿病中的研究进展
赵 航 马慧娟 树林一 张运佳 宋光耀
白藜芦醇是一种多酚类的植物抗毒素,能够在一定程度上调节代谢,改善胰岛素抵抗和相关代谢异常(包括血脂异常、高血糖和高胰岛素血症)。大量证据支持白藜芦醇通过多种机制来发挥对胰岛素抵抗、2型糖尿病及并发症的有益作用。本文综述了白藜芦醇的作用机制以及在胰岛素抵抗和2型糖尿病中的作用。
一、肥胖、胰岛素抵抗、糖尿病
近年来,肥胖人群的数量在世界范围内迅速增加,2005年有33.0%成人超重或肥胖,预计到2030年将增加到57.8%(超重者21.6亿人,肥胖者11.2亿人)。肥胖和相关代谢紊乱是2型糖尿病和心血管疾病的主要危险因素,2型糖尿病患者人数预计从2013~2035年将增加55%,达到5.919亿人[1]。代谢紊乱在脂肪组织、肌肉、肝脏和肠道等胰岛素敏感的组织非常明显,并且有共同的前提,即胰岛素抵抗。
胰岛素是由胰腺β细胞分泌的一种激素,具有多种代谢功能,包括调节碳水化合物、蛋白质和脂质代谢。在胰岛素抵抗存在的条件下,β细胞通过增加胰岛素分泌来维持葡萄糖稳态。如果β细胞不能分泌过多胰岛素,血糖水平将会增加,最初表现为葡萄糖耐量异常。随着β细胞功能障碍的进展,血糖浓度进一步升高,最终导致2型糖尿病。早期诊断胰岛素抵抗对预防2型糖尿病及其并发症如血管病变、心血管疾病、肾功能衰竭、神经病变等至关重要。最近研究表明,多酚类化合物白藜芦醇能够减轻胰岛素抵抗,氧化应激和血脂异常等相关代谢紊乱。
二、白藜芦醇
白藜芦醇是一种多酚类植物抗毒素,首先从开花植物藜芦的根中提取,现在70多种水果、植物中发现,如葡萄皮、花生、大豆、石榴,主要是反式异构体形式存在。与白酒比较,红葡萄酒中的白藜芦醇浓度大约高10倍。日本虎杖中白藜芦醇含量最高[2]。白藜芦醇是饮食的重要成分,此外许多膳食补充剂含有白藜芦醇。法国人日常饮食中常有高脂肪高胆固醇,但心血管疾病的发生率较低。白藜芦醇作为对“法国悖论”的解释,引起了广泛关注,越来越多的研究证明白藜芦醇能够抗炎、抗氧化,防止神经系统功能紊乱和认知功能减退,预防心血管系统疾病,治疗癌症,保肝等,同时在代谢综合征、糖尿病等代谢方面的作用也得到逐步证实[3]。
三、药代动力学和代谢
白藜芦醇的肠道不完全吸收及代谢清除作用,造成了其口服的生物利用度较低,从而影响了白藜芦醇的健康效应。天然白藜芦醇(非代谢形式)口服给药后0.5~1.5h在血液中达到第1个峰值,6h达到第2个峰值,证实了其肠道二次循环,并且表明天然白藜芦醇具有较低的生物利用度。Ortuno等研究发现葡萄汁和葡萄酒中白藜芦醇的生物利用度是片剂的6倍。尽管白藜芦醇的生物利用度较低,但体内实验证明了其有效性。白藜芦醇代谢物在肠道内去结合和重吸收后,肝肠循环也可能促进了其功效。在人和动物模型中,白藜芦醇在肝脏中迅速代谢,并与血浆中的脂蛋白和白蛋白结合,从而促进其被细胞摄取。
四、剂量和不良反应
白藜芦醇以剂量依赖性方式发挥生物学作用。推荐的白藜芦醇每日用量主要依据是动物和人的剂量换算。这些剂量在人身上尚未得到充分验证。根据动物研究的粗略估计,每日需要剂量5~100mg/kg可以达到一定的生物效应,而其最大耐受剂量还未确定[2]。研究证明0.3g/kg的白藜芦醇对大鼠没有有害作用[4]。白藜芦醇在低剂量5~20μmol/L时保护心脏免受活性氧(reactive oxygen species,ROS)损伤,而在较高剂量时,可能起到促氧化的作用[5]。
据报道,大鼠摄入大剂量白藜芦醇[3g/(kg·d)]可导致不良反应,如肝毒性和肾毒性[6]。人类研究表明,在0.7~1.0g/(kg·d)范围内的白藜芦醇,耐受性良好,未发现毒性作用[7]。目前的临床试验已经证实,人体对白藜芦醇有良好的耐受性,短期研究报道有轻微的不良反应(如呕吐、恶心和腹泻)[2]。
五、白藜芦醇对代谢的影响
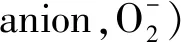
2.白藜芦醇改善了胰岛素抵抗:研究表明白藜芦醇改善了高脂血症小鼠、肥胖的Zucker大鼠的胰岛素作用[10]。对离体细胞的研究表明,白藜芦醇在缺乏胰岛素的情况下具有刺激葡萄糖摄取的能力,白藜芦醇能够刺激葡糖糖转运蛋白4(glucose transporter 4,GLUT4)的表达,并通过上调雌激素受体-α,通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白酶B(protein kinase B,AKT)途径来增加葡萄糖摄取。白藜芦醇改善胰岛素抵抗的机制涉及氧化应激减少和AKT磷酸化显着增加。白藜芦醇处理后显着增加了AMP依赖的蛋白激酶(AMP-activated protein kinase AMPK)、eNOS和AKT的磷酸化。Penumathsa等研究表明白藜芦醇介导的GLUT4易位和葡萄糖摄取可能是通过小窝蛋白引起的AMPK/NO/AKT途径介导,这不依赖于胰岛素信号的级联反应。白藜芦醇对沉默信息调节因子(silent information regulator type,SIRT)1和AMPK的激活在改善胰岛素作用中起重要作用。在Sun等的一项研究中显示SIRT1可以抑制蛋白酪氨酸磷酸酶(protein tyrosine phosphatase-1B,PTP1B)水平。PTP1B作为胰岛素信号转导途径重要的负性调节因子。白藜芦醇在体内和体外抑制PTP1B。在肝脏中,白藜芦醇降低乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)和脂肪酸合酶(fatty acid synthase,FAS)表达,并增加肉毒碱棕榈酰转移酶-1(carnitine palmitoyltransterase-1,CPT-1)活性。这些作用导致肝脏脂质沉积的减少和脂肪变性的改善。
高果糖饮食的摄入促进了胰岛素抵抗和2型糖尿病的发展[11]。Babacanoglu等发现给予白藜芦醇,使高果糖玉米糖浆引起的高血脂、高胰岛素血脂及其血管性胰岛素抵抗和内皮功能障碍恢复正常。Cheng等[12]也报道,给予白藜芦醇干预高果糖动物模型,通过磷酸化AMPK和AKT显著降低了ROS水平。用0.5g/kg的白藜芦醇干预高果糖饮食喂养的大鼠6个月,炎性标志物明显减少并逆转了脂肪组织中的胰岛素抵抗。Andrade等的研究结果表明,白藜芦醇能够使高果糖饮食喂养的小鼠身体脂肪含量、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和肝酶水平降低。
3.保护β细胞:白藜芦醇对胰腺的保护作用可能通过各种机制起作用。用白藜芦醇干预db/db小鼠后,胰岛的功能和结构得到恢复,ROS水平降低,减轻了胰岛纤维化和退行性损伤。一种机制是白藜芦醇能够抑制细胞因子。Lee等研究显示,将分离的大鼠胰腺细胞暴露于细胞因子下,导致NO产生增加和诱导型NOS表达增加。白藜芦醇干预后,抵消了这些有害影响。白藜芦醇可以防止β细胞死亡的其他机制可能是其降血脂特性。β细胞的长期暴露于极低密度脂蛋白(very low density lipoprotein,VLDL)、低密度脂蛋白(low density lipoprotein,LDL)和一些饱和游离脂肪酸,如棕榈酸引起高毒性并表现出促凋亡作用,而高密度脂蛋白(high density lipoprotein,HDL)和不饱和游离脂肪酸,如油酸是保护性的,并减少由葡萄糖或饱和脂肪酸引起的β细胞凋亡。胰岛淀粉样多肽(islet amyloid polypeptide,IAPP)通常与胰岛素一起产生和分泌,并可能抑制葡萄糖依赖性胰岛素分泌,且诱导β细胞死亡。研究表明,白藜芦醇可防止IAPP淀粉样蛋白的聚集并抑制毒性作用[13]。
胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)在控制血脂蛋白和脂质代谢、肠乳糜微粒分泌、高甘油三酯血症、肝VLDL产生、肝脂肪变性和胰岛素抵抗中发挥作用[14]。GLP-1作用于β细胞的确切机制尚不完全清楚,但研究表明,胰腺和十二指肠同源异型盒1(pancreatic and duodenal homeobox 1,PDX-1),AKT和蛋白激酶 A (protein kinase A,PKA)通路在这方面发挥了重要作用。用高脂/高糖培养基培养的人β细胞,白藜芦醇处理后显示出PDX1表达增加,PDX1是胰腺β细胞成熟发展中的重要转录因子。白藜芦醇还能够通过抑制β细胞中的磷酸二酯酶(PDE)来改善β细胞功能。Dao等[15]报道,用白藜芦醇(60mg/kg)治疗2型糖尿病小鼠5周糖耐量异常恢复正常,门静脉胰岛素和GLP-1水平显着增加,并增加肠中的活性GLP-1。
4.减少脂质生成:研究表明白藜芦醇具有潜在的抗脂质形成的作用,可能涉及细胞因子、脂肪细胞生命周期、脂肪积累、脂质合成、ROS、线粒体生物发生以及参与成脂肪途径的因子基因表达[16]。一些研究表明,低剂量的白藜芦醇显着降低了白色脂肪组织的肥大,减轻了肥胖大鼠的腹部肥胖以及脂肪肝。2型糖尿病大鼠用白藜芦醇治疗(5mg/kg和10mg/kg,1个月)显着降低脂肪组织中的抵抗素表达[17]。
白藜芦醇治疗的大鼠和小鼠以类似于热量限制的方式降低体脂含量。经过白藜芦醇处理的离体大鼠脂肪细胞的体外研究显示腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)含量和TG积累减少。白藜芦醇治疗诱导的脂肪细胞TG积聚减少可能有助于减少全身肥胖[9]。白藜芦醇还可以通过降低脂肪细胞特异性酶和调节线粒体功能的转录因子表达减少脂肪形成。据报道,白藜芦醇在成熟的3T3-L1前脂肪细胞中增加SIRT3、线粒体偶联蛋白(uncoupling protein,UCP)1和线粒体融合蛋白2的表达。SIRT3表达与UCP1有关,UCP1存在于线粒体中并介导热生成。
脂蛋白脂肪酶(lipoprteinlipase,LPL)作为一种重要的循环酶,其在乳糜微粒和其它脂蛋白中水解TG以释放FFA和甘油,其目的在于组织储存或β-氧化。它是控制组织中脂质积累的主要脂肪酶。啮齿动物的实验表明白藜芦醇降低脂肪组织的LPL活化和回肠和肝脏的LPL水平[18]。ACC,FAS和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)基因是脂肪生成的主要调节因子。Qiao等的研究结果表明,显示白藜芦醇显着降低脂肪组织中的ACC,FAS和PPARγ mRNA水平。
5.刺激脂肪酸氧化:β-氧化和FA摄取之间的不平衡可导致胰岛素抵抗。在肌肉组织胰岛素抵抗中,FA摄取速率大于β-氧化,导致脂质积累,随后出现肥胖表型。胰岛素抵抗的肥胖患者的线粒体含量、功能和氧化能力较正常人下降[19]。给予白藜芦醇后恢复了骨骼肌和C2C12肌细胞的线粒体功能,并且显着降低了脂质产物的含量,增加了肌肉脂质氧化能力。Jeon等表明,给予高脂饮食的apoE缺陷小鼠白藜芦醇后,与对照组比较,β-氧化的显着增强和TG合成下降。白藜芦醇诱导的线粒体含量增加可以改善肝脏脂质代谢,尤其是线粒体β-氧化,并且通过增加线粒体发生来增加肝脏和骨骼肌中的FA消耗[20]。CPT-1是β-氧化中的调节酶,催化肉毒碱形成长链酰基肉碱并激活FA,转移到线粒体进行氧化。 啮齿动物实验表明,白藜芦醇显着增加不同组织中CPT-1活性和mRNA水平,这可以部分解释白藜芦醇的人体降脂特性。
6.抑制LDL氧化:越来越多的证据表明,氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)与空腹血糖、糖化血红蛋白、胰岛素和HOMA-IR呈正相关,与脂联素呈负相关[21]。在健康受试者中,ox-LDL水平与胰岛素抵抗及其葡萄糖摄取受损和胰岛素水平降低,血浆TG水平升高和HDL水平降低有关。ox-LDL能够通过激活CD36干扰胰岛素信号转导途径[22]。已经有文献报道白藜芦醇可以通过预防脂氧合酶的活性显着抑制氧化LDL的修饰,并防止LDL中发生多不饱和脂肪酸氧化,剂量依赖性地抑制血管壁中ox-LDL的摄取。白藜芦醇可以提高维生素E的清除率,并保留脂蛋白的内源性维生素E含量。其3个酚羟基的亲脂性赋予了白藜芦醇抑制脂蛋白和不饱和脂肪酸氧化的能力。
7.恢复血脂和脂蛋白浓度:体内和体外研究表明白藜芦醇的抗糖尿病作用可能是由于血清TG、LDL和VLDL降低,LDL氧化减少,内皮平滑肌细胞增殖增加和外周细胞炎症通路抑制等。一项有关胰岛素抵抗仓鼠的研究发现载脂蛋白(apolipoprotein,apo)B降解减少,肝脏VLDL-apoB产量增加。肝脏VLDL过度产生与胰岛素抵抗呈正相关[23]。Dash等研究表明,人类用白藜芦醇治疗14天后,apoB-48和apoB-100产生率分别降低了22%和27%。白藜芦醇能够降低血浆TG、TC和FFA水平以及肝脏总脂质含量,可能是通过降低胆固醇合成中限速酶HMG-CoA还原酶活性来介导。
逆向胆固醇转运(reverse cholesterol transport,RCT)是指过量的胆固醇从外周组织转移到肝脏,然后转化为胆汁酸的过程,胆固醇酯转运蛋白(cholesterol ester transfer protein,CETP)被认为是RCT途径中最重要的酶之一。增加CETP的活性导致LDL升高和HDL降低。白藜芦醇治疗可以减少胆固醇酯从HDL向VLDL/LDL的转移并增加RCT。白藜芦醇刺激J744巨噬细胞中ATP结合盒转运蛋白(ATP binding cassette transporter,ABCA1)的表达以及肝X受体-α(liver X receptor-α,LXR-α)和ABCA1的mRNA水平。通过激活PPARγ,白藜芦醇可以阻止由巨噬细胞中晚期糖基化终产物引起的胆固醇积累。有研究显示白藜芦醇显着降低2型糖尿病大鼠肝脏和肾脏晚期糖基化终产物受体的表达[24]。
8.调节肠道菌群:肠道微生物在营养代谢、维生素合成、消化和免疫功能等多种生理功能中发挥作用。最近的研究提出,肠道菌群的多样性和组成变化与胰岛素抵抗、肥胖和2型糖尿病等代谢紊乱相关。白藜芦醇可增加动物模型肠道中的乳酸杆菌和双歧杆菌,二者能够降低血糖、脂肪量、炎性细胞因子,改善胰岛素抵抗。有研究证实梭菌XI、乳酸球菌、氢气细菌与高脂饮食诱导的胰岛素抵抗和肥胖之间存在关系。白藜芦醇通过使这些细菌恢复正常水平来改善葡萄糖耐受不良和脂肪沉积[10]。Jung等[25]认为,这种代谢作用可能由mTORC1信号通路介导。白藜芦醇在胃肠道的抗炎特性、抗氧化作用保护肠道屏障功能[26]。高脂饮食喂养的小鼠给予三甲胺N-氧化物(trimethylamine N-oxide,TMAO)可改变胰岛素信号转导、糖原合成、糖原异生基因表达和肝脏葡萄糖转运。白藜芦醇干预后,可通过调节胃肠道菌群来减少肠道微生物三甲胺产生从而抑制TMAO合成[27]。口服白藜芦醇可显著降低某些肠道酶如β-葡萄糖苷酶、β-半乳糖苷酶、β-葡萄糖醛酸酶,黏蛋白酶和硝基还原酶水平,而这些酶与血糖升高相关。白藜芦醇具有较低的生物利用度,到达大肠时,成为肠道微生物生态系统的调节者。因此,白藜芦醇可能通过调节肠道微生物的组成来改善肥胖和胰岛素抵抗[21]。
综上所述,白藜芦醇廉价、易获得性以及在调节代谢方面的作用,使得其在肥胖、胰岛素抵抗、2型糖尿病上成为有潜力的膳食补充剂或药物,但其有效剂量和剂型仍然需要开展更深入的研究来确定。

