先天性巨结肠与RET基因的相关研究进展
王 慧 姜 茜
RET蛋白是由RET原癌基因编码的一种跨膜蛋白,属于酪氨酸激酶受体,RET蛋白在肠神经系统发育过程中发挥重要作用。胚胎发育时期多种因素共同作用导致肠神经嵴细胞在肠道中的迁移、增殖和分化发生异常,致使远端肠道神经节细胞缺如,导致HSCR的发生。本文就RET基因的结构、功能及其调控网络的异常表达对HSCR的影响等近期研究进展进行综述。
一、RET原癌基因
1.RET的分子的结构:RET原癌基因位于10号染色体长臂,全长60000,由21个外显子组成,编码一种含有1114个氨基酸的酪氨酸激酶受体超家族蛋白[1,2]。RET蛋白包含3个结构域:细胞外配体结合结构域(extracellular regions)、跨膜结构域(transmembrane domain, TMD)以及细胞内的酪氨酸激酶(tyrosine kinase, TK) 结构域(图1)。不同结构域内的碱基突变导致的HSCR的机制有所不同(表1)。RET基因的3′-端的可变剪接形成3种转录本,分别被命名为RET51、RET43和RET9[3]。其中RET51和RET9为主要形式,在各物种间高度保守。RET51和 RET9 相关的信号复合物并不完全相同,表明不同RET亚型介导的生理功能也不尽相同。

图1 RET基因的结构示意图及突变位置
2.RET蛋白的表达和激活:RET原癌基因编码跨膜酪氨酸激酶受体,在人体大部分组织中均有表达,RET蛋白与相应配体如GDNF(glial cell line-derived neurotrophic factor)等结合,促进受体二聚化,激活下游信号通路,进而刺激细胞增殖、分化和迁移。相关功能研究显示,RET蛋白的磷酸化及其受体-配体复合物的形成是RET信号通路转导中的重要步骤。RET蛋白的磷酸化即其活化形式,发挥生物学功能。人体内有4种配体可诱导其活化,分别是GDNF、artemin(ARTN)、persephin(PSPN)和 neurturin (NRTN),统称为GDNF配体家族(GDNF family ligands, GFLs)[4]。
二、先天性巨结肠
肠神经嵴细胞在胎儿期5~12周时由神经嵴细胞(neural crest cell,NCC)移行种植于整个肠道。如NCC在肠道内移行、种植过程发生异常引起远端肠道缺乏神经节细胞,即可导致先天性巨结肠(Hirschsprung disease, HSCR)。HSCR是最常见的小儿消化道畸形,属于典型的肠神经系统(enteric nervous system, ENS)发育异常疾病。HSCR在活产婴儿中的平均发生率约1/5000,存在明显种族差异,亚洲人群发病率最高,为1/3571。中国属高发生率国家,男性与女性发生率之比为(2~4)∶1[5]。
1.先天性巨结肠的分类:按照肠道缺失神经节细胞的长度可将HSCR分为3种类型,即短段型(short-segment hirschsprung disease, S-HSCR)、长段型(long-segment hirschsprung disease, L-HSCR)以及全结肠型巨结肠(total colonic aganglionosis, TCA),另有罕见的累积全肠型巨结肠[6]。此外,按照有无合并其他畸形以及染色体异常,可将HSCR分为单纯型和综合征型两种[5],后者最常见合并21三体畸形,另有18%患儿同时存在其他器官系统先天畸形,如胃肠道畸形、唇腭裂、泌尿生殖道畸形、先天性心脏病以及颅面部畸形等[7]。根据患者其他家族成员中有无HSCR患者,可分为家族型和散发型HSCR两种[8]。
2.先天性巨结肠的相关基因:遗传学研究表明与HSCR相关的易感基因主要来自ENS发育过程中两条主要的信号通路及与其相关的转录因子[2]:RET、GDNF、NRTN、PSPN、EDNRB、EDN3、ECE1、NTF3、NTRK3、SOX10、PHOX2B、L1CAM、ZFHX1B、KIAA1279、TCF4、PROK1、PROKR1、PROKR2、GFRA1、NRG1、NRG3、SEMA3A、SEMA3C和SEMA3D[5,6]。但这些基因异常只能解释部分HSCR患者的发病原因,且大多为综合征型或临床表现较为严重的患者。随着高通量测序和基因分型技术的广泛应用,全基因组关联分析研究(GWAS)被逐渐运用在包括先天性巨结肠在内的各种复杂疾病易感基因的发掘上,越来越多的HSCR潜在易感基因被发现,如最近Zhao等[9]报道的VAMP5和MCC基因多态性与中国南方儿童HSCR之间有一定的相关性。此外,基因相互作用也在逐渐进入研究者的视野,如RET基因编码区罕见突变与NRG1基因内常见变异的共同作用,修饰基因NRG3、MAPK10、ZEB2、SOX2等的调控作用等[5]。
三、RET基因与先天性巨结肠的关系
目前HSCR患者检出的已知致病性突变中约有80%来自RET基因,其中含有大量功能失活(loss-of-function, LOF)突变和新发突变(de novo mutations, DNMs),且靶向外显子测序和全外显子组测序(whole exome sequencing, WES)结果均显示RET基因的有害性变异在HSCR患者中呈明显富集现象[4,10,11]。虽有研究提示环境因素在疾病促发中也可能发挥一定作用,如HSCR的发生与患者母亲怀孕期间的BMI值增高及胎儿早产均有一定关系,但遗传因素在HSCR的发病中依然占据重要地位[12]。与HSCR可能相关的致病性基因有24个,但以RET基因为主。利用 CRISPR/Cas9 基因编辑技术在离体细胞模型中修正患者所携带的突变后,可明显恢复肠神经嵴细胞的正常功能,进一步说明RET基因突变在HSCR发病中的重要致病作用[13]。RET基因突变导致RET蛋白表达定位异常、糖基化或磷酸化水平异常,以及一些其他基因或调节因素如miRNA或基因的甲基化调控异常导致RET表达降低时,都将影响RET蛋白在细胞内的功能,进一步影响细胞的增殖分化和迁移,从而导致HSCR的发生[6,14~16]。
1.RET蛋白在肠神经系统发育中的作用:RET蛋白及其信号通路参与调节细胞的增殖、迁移和分化。RET基因表达异常将导致ENCCs在肠道内异常定植,甚至可促进ENCCs的凋亡引起HSCR的发生。既往动物模型实验表明RET蛋白表达降低可导致小鼠结肠内的肠神经元细胞广泛死亡,当基因表达量低于30%时即表现出明显的无神经节细胞缺陷表型,表明HSCR的发生、发展与RET基因的表达水平或功能活性存在明显剂量依赖效应[17]。
2.RET基因编码区变异:编码区(coding sequences, CDS)突变主要包括同义突变、无义突变、移码突变和错义突变等。其中同义突变虽然没有改变基因编码的氨基酸,如RET基因的c135G>A(p.A45A)、c2307 T>G(p.L769L) 和c1296 G>A(p.A432A),但等位基因的分布和HSCR的发生、发展及严重程度密切相关[18]。无义突变导致RET基因编码的RET蛋白提前终止,形成的截短蛋白对功能影响较大。HSCR患者中的RET基因突变以错义突变为主,突变后多数导致RET蛋白在细胞内定位发生改变,或影响RET蛋白的糖基化、磷酸化,进而不同程度地影响RET蛋白活性[14]。不同位置的RET基因突变导致的RET蛋白功能改变不一(表1)。RET基因的 c.341G> A(p.R114H)突变在中国6%~7%的HSCR患儿中被发现,但在高加索人群中并未发现这一变异,推测为中国人群的创始者突变(founder mutation)[19]。

表1 不同位置RET突变影响蛋白质功能的主要机制
某些RET基因的LOF突变在HSCR患者发病过程中属于必要不充分条件[6]。如单独的RET基因编码区突变可能并不足以导致HSCR发生,需累积其他微效基因[20]。RET基因编码区突变在合并内含子变异时,可显著增加患病风险。2017年开展的一项跨种族全基因组Meta分析结果显示,RET基因编码区错义突变p.Asp489Asn (rs9282834)与增强子rs2435357的风险等位基因共存时,其患病风险的OR值从1.1增加至16.7[16]。随着测序技术的成熟,更多的RET基因罕见突变在HSCR患者中被发现,其中近5年发现的RET新发突变详见表2。
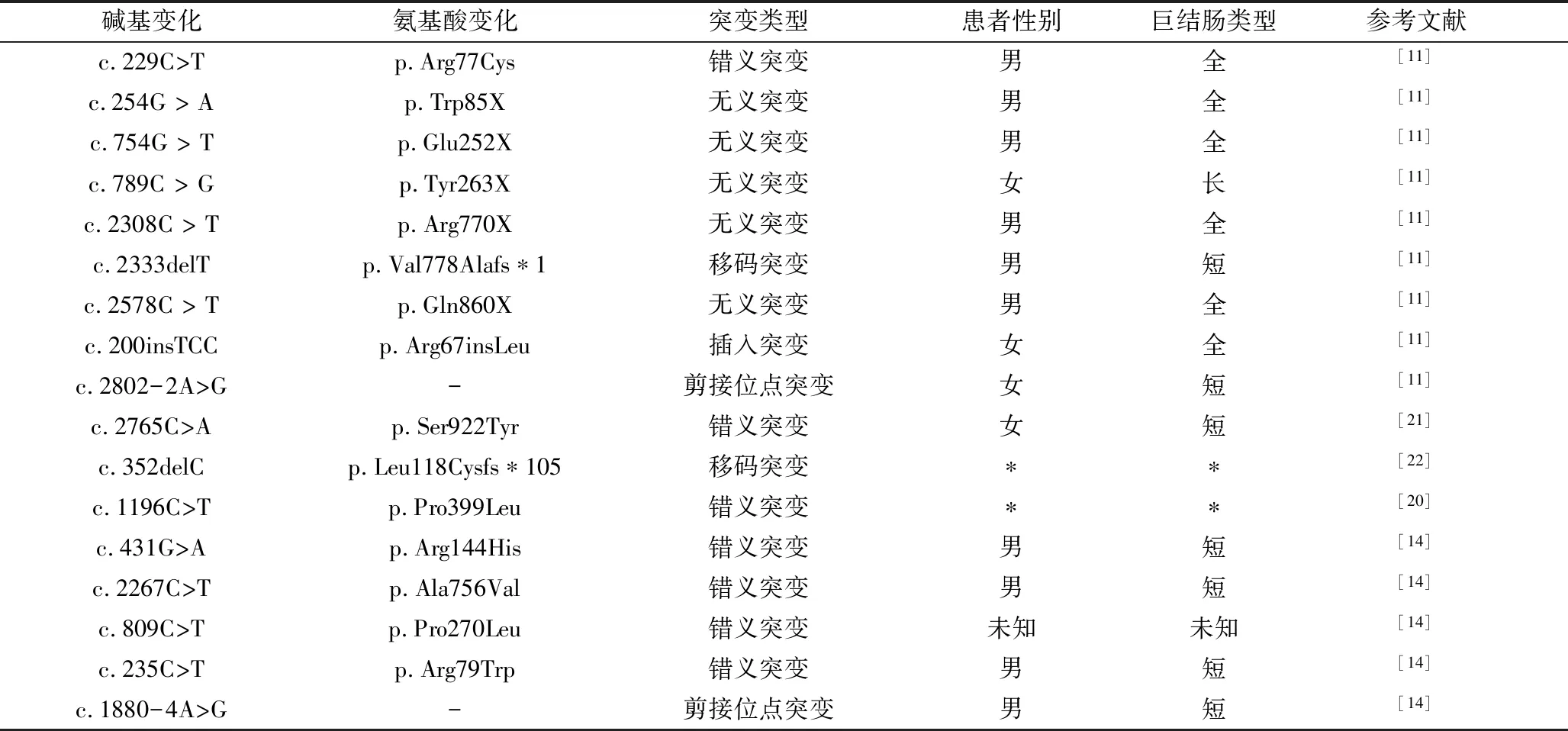
表2 近5年报道的先天性巨结肠患儿的RET基因新发突变
3.RET基因的甲基化与HSCR:自20世纪90年代以来,CpG岛甲基化水平对基因表达的影响已经引起人们的广泛重视。RET基因启动子区富含5′-CG-3′序列,其表达受DNA甲基化的高度调控。研究表明维甲酸可通过调节RET基因启动子区5′-CG-3′富含区的DNA甲基化水平来调控RET基因的表达。另有研究证实RET基因启动子区的CpG岛甲基化程度可能是指示结肠癌患者预后的一个重要标志,表明RET基因的表达受其启动子区CpG岛甲基化的调控,推测这一机制有可能在HSCR疾病发生中也发挥一定作用[21]。
4.RET基因与其他基因之间的相互作用:RET蛋白的表达不足或功能异常都将影响ENCCs在肠道内的增殖、迁移和分化。很多基因可通过复杂的网络作用干扰RET信号通路,进而导致HSCR的发生。如Nrg1可干扰GDNF对神经元分化的诱导作用,且GDNF能通过下调其受体ERBB2基因的表达水平来负向调控Nrg1信号传导[22];另外一些基因则可通过直接调控降低RET基因的表达导致HSCR的发生,如先天性中枢性低通气综合征(congenital central hypoventilation syndrome , CCHS) 中,PHOX2B基因变体降低了RET基因启动子的反式激活作用,从而导致RET基因的表达下降致使患者出现HSCR的表型[23]。近期研究表明L1cam作为SOX10的修饰基因可调控SOX10的表达,后者可直接参与调控RET基因的表达,因此L1cam也被列为HSCR的候选基因之一[6,22]。
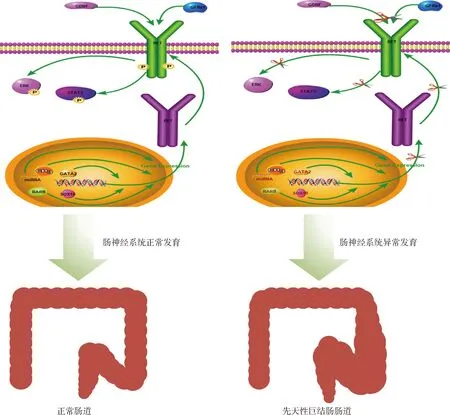
图2 HSCR发生模式图
5.miNRA对RET的调控作用:MiRNA是小的非编码RNA,研究表明,miRNA通过与靶基因互补结合触发后者mRNA的降解或抑制其翻译来调控靶基因的表达。目前研究表明,miR-218-1 可通过调控RET和PLAG1基因异常表达导致HSCR的发生。进一步分析显示,在HSCR患者的狭窄段肠组织中5种miRNA(hsa-miR-142-3p、hsa-miR-142-5p、hsa-miR-146b-5p、hsa-miR-369-3p和hsa-miR-429)表达水平显著上调(P<0.05),而hsa-miR-885-3p则明显下调。这些差异表达的miRNA均参与RET信号通路的调控[15]。此外,lncRNA在HSCR发生中的作用也被逐渐发现,但其具体机制有待于进一步研究。
6.基因调控网络(gene regulatory network, GRN)异常与HSCR:基因表达调控是生物个体发育的重要基础,因此基因在生物个体发育过程中的作用应该作为GRN的一部分来看待,而不是孤立地研究基因的功能。2016年经体外实验、胎鼠实验及人类胎儿肠道样本表达的研究表明,RET基因的3个顺式调控原件(cis-regulatory elements,CREs)中的风险等位基因组合可协同降低RET基因的表达,同时调节RET基因相应转录因子的表达致使RET基因的GRN失常[6]。该研究还发现,分别与RET-7、RET-5.5、RET+3相结合的转录因子RARB、GATA2、SOX10在胎鼠体内的表达具有时空特性,且每一种转录因子的作用时间各不相同。RARB表达水平降低时引起的RET基因表达降低程度不如SOX10和GATA2明显,提示RARB可能还有其他可替代的未知转录因子在体内发生作用。该项研究还表明,SOX10基因表达量的轻微下降就可导致RET基因表达明显减少,表明SOX10在RET基因中的转录调节作用最强。在人类胎儿肠道样本的检测中还发现,不同的CRE组合虽然造成一定程度的RET基因及其转录因子SOX10和GATA2的降低,但在RET信号转导通路中GDNF和GFRA1组分的表达却明显增加,表明胚胎发育期人类肠道中可能还有其他转录因子或增强子在RET基因的GRN中发挥作用。
7.RET基因的嵌合体变异:近年来研究表明,越来越多的遗传性疾病的发生、发展与嵌合体变异密切相关。2014年Jesus 和Haase分别在两个先天性巨结肠家系中的非巨结肠患者中检测出嵌合体突变。同年,Moore和Zaahl等通过对56个石蜡包埋肠组织标本RET基因两个snp的基因型分析认为,RET基因的体细胞突变可能存在于无神经节细胞的肠组织中。2017年本课题组的最新研究显示,在9例HSCR患儿中检出RET基因突变,其中对8例患者父母有DNA样本的家庭做了进一步Sanger测序检测,在其中2个家庭患者父母外周血样本中检出与先证者相同位点的较小的突变峰,表明这两个家庭的亲本属于嵌合体变异[11]。进一步深度测序发现另外6个家系中两个患儿体内多组织RET突变等位基因频率各不相同且显著偏离50%。由此可见,这两个患儿的突变不是发生在受精卵结合前,而应是由胚胎发育早期合子形成后的变异造成的;另有两个家庭的亲本DNA中发现了极低水平的突变等位基因(频率为1%~4%)。因此既往HSCR患者中RET基因嵌合体变异的频率和程度存在被严重低估的可能。对于新发突变(尤其是严重突变)携带者所在家庭,应采用具有足够敏感度的深度测序来验证其父母或患者自身是否存在嵌合体变异,从而为疾病再发风险评估以及患者后代临床表型的严重程度预测提供更加可信的依据。
综上所述,HSCR是典型的多个基因共同参与的复杂人类遗传病,同时与环境因素如孕母的肥胖、胎儿早产等也有一定关系[12]。RET基因在肠神经嵴细胞的发育过程中占据重要作用,当 RET蛋白在细胞内的定位发生改变,或其糖基化、磷酸化水平出现异常时,将导致RET功能失常并进一步影响ENCCs在肠道内的定植,最终引起相关表型。MiRNA、RET基因内含子、增强子区域及SOX10、RARB、GATA2、PHOX2B等转录调控基因因子也可调节RET的表达,这些元件功能出现异常时也可引起HSCR临床表型。随着基因检测技术和相关功能研究手段的发展,越来越多的罕见突变在HSCR患者中被鉴定,使人们对HSCR的发病机制有了更深入的了解,这对HSCR的临床治疗、遗传咨询以及肠神经系统发育的研究都将具有重大意义。

