胃肠道间质瘤磁共振表现与肿瘤危险度分级的相关性研究
冯江峰 赵振华 王 挺 黄亚男
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶组织来源肿瘤,占全部胃肠道恶性肿瘤的1%~3%,免疫组化通常为CD117、CD34或DOG-1表达阳性[1]。目前主要依靠病理及免疫组化进行确诊及危险程度分级。其生物学行为具有潜在恶性,预后与其危险度分级密切相关,危险度分级越高,预后越差,因此,术前经影像学检查正确诊断及评估危险度具有重要的临床价值。目前GIST的CT表现与危险度分级相关性报道较多,而MRI表现与肿瘤病理危险度相关的研究很少。本研究收集笔者医院2015年4月~2017年11月收治的21例胃肠道间质瘤患者的临床病理及MRI检查资料,回顾性分析GIST的MRI表现,并与肿瘤危险程度分级对照,探讨MRI表现与肿瘤危险程度的相关性,对临床治疗及术前评估提供指导。
资料与方法
1.临床资料:收集2015年4月~2017年11月间经术后病理及免疫组化确诊的21例GIST,所有患者术前均行MRI扫描,其中男性13例,女性8例,患者年龄47~86岁,平均年龄63.6±10.9岁,中位年龄62岁。主要临床表现为腹部不适7例,消化道出血3例,反酸嗳气3例,无症状8例。
2.仪器与方法:行磁共振检查前所有患者均已签署知情同意书。采用西门子公司 3.0T超导型磁共振扫描仪(magnetom verio siemens,德国Erlangen公司)和12通道相控阵表面线圈,扫描序列包括横断位T2加权扰相自旋回波(TR/TE 1370/81ms,层厚6mm,层间距1.2mm,矩阵207×320,带宽22kHz),同反相位序列(TR254.00ms,同相位TE2.46ms,反相位TE6.15ms)。弥散加权成像(TR/TE 7400/73ms,层厚6mm,层间距1.2mm,b值0s/mm2,600s/mm2,矩阵99×146,带宽180kHz)。稳态自由呼吸,多反转T1成像,T1加权三维容积内插屏气激励脂肪抑制序列(TR/TE3.25/1.17ms,层厚5mm,层间距1mm,矩阵288×164,视野350×284mm,扫描30层)。
3.图像处理:将MRI不同序列的图像上传到PACS系统,经两位MRI腹部影像诊断专家对图像进行分析、测量、描述,包括病变部位、生长方式、肿瘤最大径、形态、边界、信号特征等内容。ADC测量时,感兴趣区(ROI)选择尽量避开囊变、坏死、出血区,ADC值各病灶均测量3次取平均值。
4.病理诊断标准:参考2017版中国胃肠道间质瘤病理诊断共识[2]:极低度恶性风险:肿瘤发生于任何部位,病灶直径<2cm,有丝分裂率5/50HP(高倍镜视野)以下;低度恶性风险:肿瘤发生于任何部位,病灶直径2~5cm,有丝分裂率5/50HP以下;中度恶性风险:肿瘤发生于任何部位,病灶直径<2cm,有丝分裂率(6~10)/50HP,或肿瘤原发于胃,病灶直径2~5cm、有丝分裂率5/50HP以上,或者病灶直径5~10cm、有丝分裂率5/50HP以下;高度恶性风险:病灶直径2~5cm 、有丝分裂率5/50HP以上且非胃原发,或病灶直径2~5cm、有丝分裂率5/50HP以下且非胃原发,或直径10cm以上、有丝分裂率及部位不限,或不论大小及部位、有丝分裂率10/50HP以上,或不论大小及核分裂率,而肿瘤出现破裂。
5.统计学方法:应用SPSS 19.0 统计学软件对数据进行统计分析,比较不同危险度组GIST的临床及MRI表现,计量资料采用单因素方差分析,计数资料采用R×C方差分析,将GIST患者的临床及MR 征象与GIST危险度分级进行相关性分析分析,采用Kruskal-wallis检验及Spearman相关性分析,相关系数|R|<0.4为弱相关,0.4<|R|<0.6为中等相关,0.6<|R|<0.8为强相关,|R|>0.8为极强相关,以P<0.05为差异有统计学意义。
结 果
1.GIST的临床资料及MRI征象:本组21例GIST中,高度危险8例,中度危险5例,低度危险7例,极低危险1例,由于极低危组病例数少,将其并入低危组分析。患者年龄≤50岁3例,51~70岁13例,>70岁5例。男性13例,女性8例。发生于胃部16例,小肠5例。肿瘤直径≤5.0cm 8例,5.0~10.0cm 8例,≥10.0cm 5例。肿瘤腔外生长14例,腔内生长3例,腔内外混合生长4例。肿瘤形态类圆形10例,分叶或不规则11例。边界清晰15例,边界模糊6例,与肿瘤侵犯周围组织有关(图1~图3)。GIST的磁共振表现,一般呈等长T1WI 长T2WI软组织信号,可呈类圆形或不规则形,肿瘤向腔内、腔外或跨壁腔内外生长,肿瘤较大时信号可不均匀,其内可见大小不等的坏死、出血或囊变灶,呈混杂信号,肿瘤弥散受限,DWI上表现为高信号。
2.GIST临床资料、MRI征象与肿瘤危险度分级的关系:性别、年龄、生长部位、生长方式及T1、T2信号特点无统计学意义(P>0.05)。肿瘤直径、形态、边界及ADC值有统计学意义(P<0.05,表1)。将有统计学意义的因素行Spearman相关性分析,肿瘤直径、形态、边界与肿瘤危险度之间呈正相关(相关系数Rs分别为0.865、0.765、0.640),ADC值与肿瘤危险度之间呈负相关(相关系数Rs=-0.776,表2)。
讨 论
GIST是最常见的消化道间叶源性肿瘤,可发生于消化道的任何部位,还可以发生于胃肠外的网膜、肠系膜和后腹膜,最常见于胃50%~75%,小肠20%~35%,结直肠和食管较少。本组21例发生于胃16例,占76%,小肠5例,占24%,与文献报道相符[3]。GIST多见于中老年,以50~60岁以上居多,男性发生率略高于女性,整体发生率约(10~20)/1000000[4]。临床表现取决于肿瘤发生的部位、直径等因素,主要有上腹部不适、腹痛或胃肠道出血等,也有相当一部分病例表现为无明显不适,而在偶然情况下发现[5]。
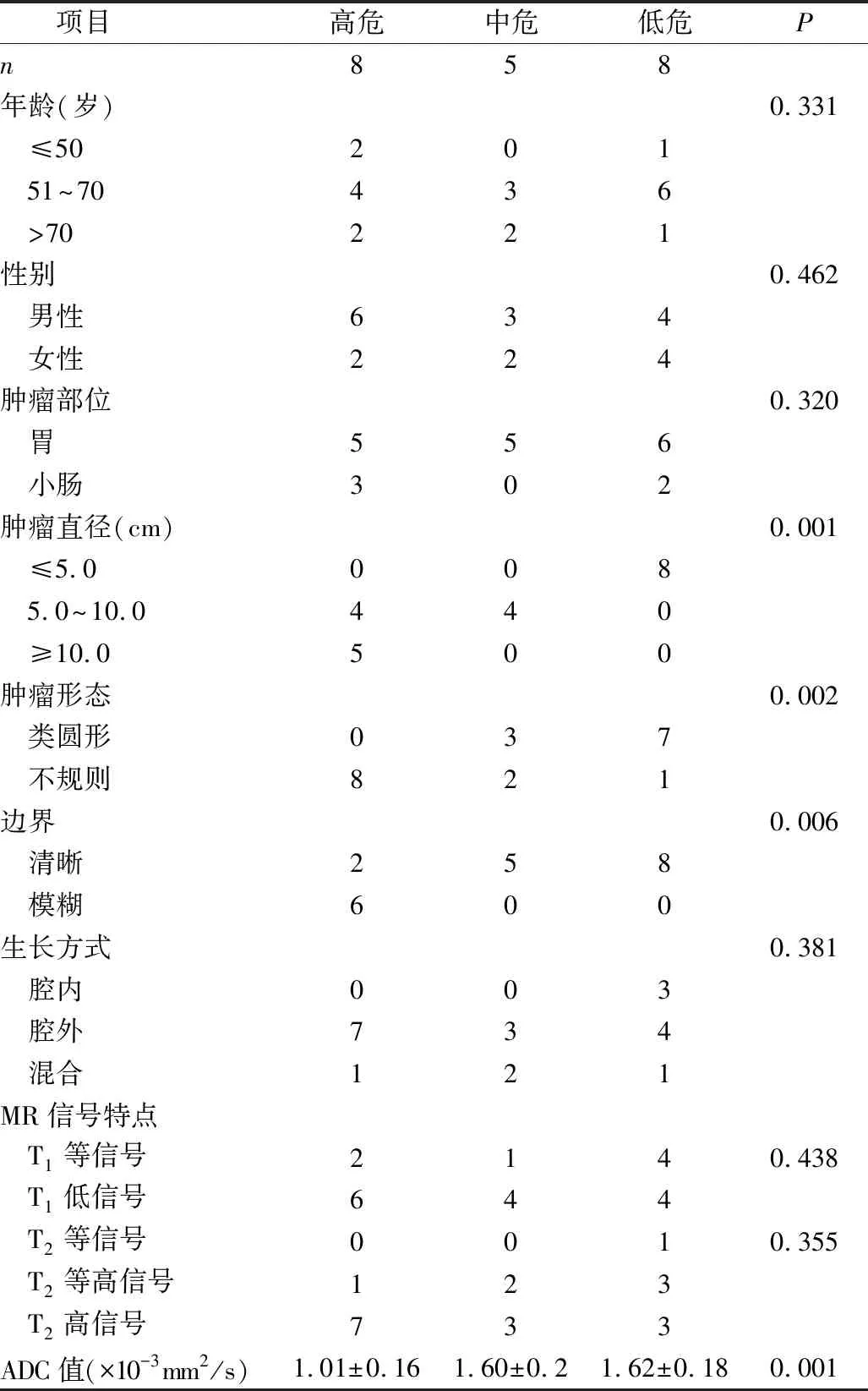
表1 GISTs临床、MRI表现与病理分级

表2 相关系数
在影像检查方面,3.0TMRI具有的高软组织分辨率及空间分辨率,在肿瘤检出及诊断分级方面的优势越来越被人们认识。GIST的磁共振表现,一般呈等长T1WI 长T2WI软组织信号,可呈类圆形或不规则形,肿瘤可向腔内、腔外或跨壁腔内外生长,其中以向腔外生长者较多,相邻胃壁或肠壁无增厚,一般不会侵及临近组织;肿块较大时信号多不均匀,其内可见大小不等的坏死或囊变灶,呈混杂信号,肿瘤弥散受限,DWI上表现为高信号。尽管磁共振T1WI、T2WI信号特点并不能判断肿瘤危险度分级,但其在测量肿瘤最大径、多方位成像观察肿瘤全貌、肿瘤边界及轮廓的显示等方面的优势明显强于CT等检查。
本研究21例GIST,肿瘤最大径从2~20cm不等,其中>5cm的12例,高危组8例(占66.7%),中危组4例(占33.3%)。肿瘤直径与危险程度分级差异有统计学意义。Ulusan等[6]对30例GIST的回顾性研究发现>5cm的肿瘤,术后病理为高度危险性的频率增加。Yang等[7]亦对间质瘤的最大径进行统计分析显示,最大径≥5cm对判断高危间质瘤有重要意义,这可能与GIST的血小板转化生长因子和c-kit 基因突变导致了细胞过度分裂从而引起肿瘤体积的不断增长有关。此外,当肿瘤呈不规则生长时,更倾向于恶性,病理危险度分级更高,本研究8例高危组病例均呈不规则或分叶状生长,统计结果显示肿瘤形态与危险程度分级差异有统计学意义。而这有赖于MRI多方位成像,可以相对较为全面的了解肿块全貌,对恶性程度的预测提供有利依据。
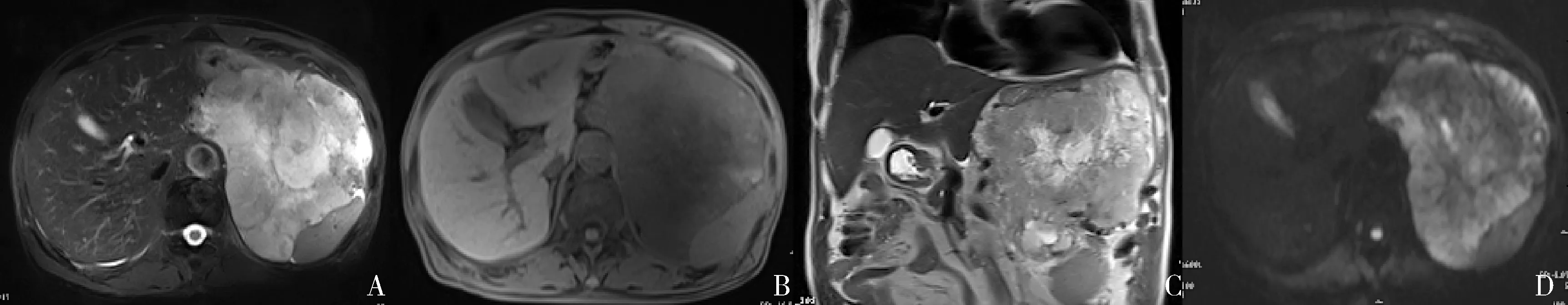
图1 高度危险组间质瘤
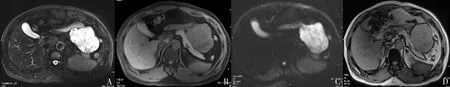
图2 中度危险组间质瘤
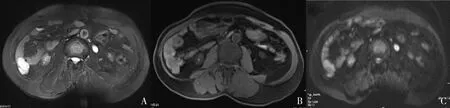
图3 小肠低危组间质瘤
Tateishi 等[8]报道肿瘤腔外生长且轮廓不清楚是预测胃间质瘤恶性风险最具有典型意义,本研究8例高危组病例,5例表现为与周围组织轮廓不清,在磁共振同反相位上表现为周围脂肪间隙中断或模糊,而MRI对肿瘤边界、轮廓的显示方面明显优于CT,13例中低危险组病例均表现为边界清晰,不侵犯周围脏器,差异有统计学意义;但在生长方式上,研究结果显示其与危险度分级差异无统计学意义。孙烨等[9]发现高危组与较低危险组GIST在发生部位上差异有统计学意义,也有学者认为肿瘤发生的部位是一个独立风险因素,胃GIST恶性概率要低于其他部位[3]。本研究未发现肿瘤生长部位与肿瘤的危险程度存在相关性,可能与病例数相对较少有关。将上述肿瘤直径、形态、边界与肿瘤危险度分级作Spearman相关性分析,结果显示,肿瘤直径与危险度之间呈极强的正相关,其原因可能是GIST的危险度分级指标中已经包含了肿瘤直径;而肿瘤形态及边界与危险度之间呈强相关,且形态比边界更容易说明肿瘤的良恶性。
MRI可在准确测量肿瘤最大径、多方位观察肿瘤全貌、显示边界及轮廓等方面预测肿瘤危险度,更大的优点在于其可以进行功能成像。目前功能磁共振成像(functional MRI, fMRI)应用于肿瘤的主要有DWI 及MRS 两种技术,其理论上可以从分子水平、病理、生理学角度对肿瘤的发生、发展及危险程度进行预测,从而提供一种无创、活体评价间质瘤危险度的方法,而不仅局限于以往的形态学诊断[10]。DWI正是目前能在活体上进行水分子扩散测量与成像的唯一方法,通过在体内无创性评价水分子运动情况,从微观分子水平反映组织、器官的病理生理情况,常采用表观弥散系数(apparent diffusion coefficient,ADC)来表示,当肿瘤细胞繁殖越旺盛、密度越高,生物膜结构对水分子弥散的限制作用越明显,ADC值越低。
研究证实肿瘤的ADC值与细胞信号通路中cyclin D1、HIF-1、VEGF、增殖细胞核抗原Ki-67等指标具有相关性,文献也报道ADC值与肿瘤的细胞密度及恶性程度有很大的相关性,恶性程度较高的肿瘤其细胞密度较高、核质比增高和细胞外水分减少,导致水扩散受限,ADC值减低[11,12]。本组研究高危组ADC值(1.01±0.16)×10-3mm2/s,中危组ADC值(1.60±0.20)×10-3mm2/s,低危组ADC值(1.62±0.18)×10-3mm2/s,Spearman相关性分析显示,肿瘤ADC值与危险度之间差异有统计学意义,且两者之间呈显著负相关(相关系数Rs=-0.776),即ADC值越小,肿瘤更倾向于恶性,反之,更倾向于良性,与上述文献报道一致,这也为术前评估GIST危险度分级提供另一种方法,ADC值亦可作为肿瘤危险度评估的定量依据。
综上所述,MRI具有的良好的组织分辨率,无电离辐射,无创以及fMRI功能成像等特点,对GIST的直径、生长部位、边界、形态及ADC值等作出客观准确的评估,可较好的预测肿瘤的危险度分级,在判断其恶性风险度的价值上依次为直径>ADC值>形态>边界。另外,随着近几年MRI技术和设备的发展,MRI空间和时间分辨率也大大提高,从而极大地减少了胃肠道的运动伪影,使MR作为常规检查预测肿瘤危险度成为可能,为临床术前评估GIST患者的病情,进一步治疗提供更有价值的信息。

