NLRP3/caspase-1/IL-1β信号通路在HK-2细胞高糖缺氧复氧损伤中的作用
肖业达 黄亚医 黄 婷 汪华新 赵 博 王雅枫
肾缺血再灌注损伤是临床上最为常见的病理生理现象,其可发生于严重的创伤、休克和感染等情况[1]。而大宗临床研究表明:糖尿病患者肾缺血再灌注损伤发生率更高,预后更差[2]。因此糖尿病肾缺血再灌注损伤的发生机制及其防治策略成为亟待解决的临床热点之一。
寡聚化结构域样受体(nod-like receptor, NLRs)是在宿主先天性免疫应答调节中起关键作用的细胞内特异性蛋白,可以识别胞质内的病原相关分子。炎性复合体概念最早由Tschopp于2002年提出,炎性复合体结构包括凋亡相关斑点样蛋白,半胱天冬酶1前体(pro-caspase-1)和一种NLRs。其中NLRP3是目前结构功能研究最多的炎性体。当NLRP3被激活后,可以使pro-caspase 1裂解为有活性的cleaved-caspase-1,从而进一步促进炎性因子前体成熟,转化为有活性的IL-1β和IL-18[3]。研究表明NLRP3/caspase-1/IL-1β信号通路在肾缺血再灌注损伤中发挥了重要作用[4,5]。同时相关研究表明NLRP3参与了糖尿病肾病的发生和进展[6,7]。而该信号通路在糖尿病肾脏缺血再灌注损伤的研究中尚未见报道。因此,本研究通过建立HK-2细胞高糖缺氧复氧模型,观察NLRP3/caspase-1/IL-1β信号通路在HK-2细胞损伤中的变化。
材料与方法
1.材料:人肾小管上皮细胞HK-2购自美国ATCC公司,DMEM低糖培养基购自美国Hyclone公司,CCK-8细胞增殖及细胞毒性检测试剂盒,caspase-1活性检测试剂盒购自上海碧云天生物技术有限公司,超氧化物歧化酶(SOD)试剂盒,活性氧(ROS)试剂盒购自南京建成生物工程研究所,IL-1β酶联免疫吸附测定试剂盒购自武汉伊莱瑞特生物科技有限公司,NLRP3抗体购自美国Nous公司,NLRP3抑制剂BAY11-7085购自中国上海蓝木化工有限公司。
2.细胞培养及分组:HK-2细胞用含10%胎牛血清(FBS)、100U/ml青霉素和0.1g/L链霉素的DMEM低糖培养基(葡萄糖浓度5.5mmol/L),置于37℃、5%CO2细胞培养箱。当细胞生长到70%~80%,用含乙二胺四乙酸(EDTA)的胰酶消化细胞,吹打并传代。采用数字表法将HK-2细胞随机分为低糖组(NG组)、低糖缺氧复氧组(NHR组)、高糖组(HG组)、高糖缺氧复氧组(HHR组)和高糖缺氧复氧+NLRP3抑制剂BAY11-7085组(HHR-BAY)。高糖模型的建立:HK-2细胞铺板用无血清低糖DMEM培养基同步化24h后加入高糖(葡萄糖终浓度30mmol/L)培养72h。高糖缺氧复氧模型的建立:HHR组高糖(30mmol/L)培养72h后进行缺氧4h,复氧2h处理。HHR-BAY组予以NLRP3抑制剂BAY11-7085 5μmol/L与高糖同时作用72h后缺氧复氧[8]。
3.指标检测:(1)根据试剂说明书,酶标仪测定细胞CCK-8、SOD。(2)ELISA法检测IL-1β和caspase-1。(3)免疫荧光检测NLRP3:PBS浸洗爬好细胞的玻片3min×3次;4%多聚甲醛固定;0.5%Triton X-100室温通透20min;血清室温封闭30min;滴加一抗(NLRP3:1∶50),4℃孵育过夜;加荧光二抗(1∶100),湿盒中室温孵育1h;滴加DAPI避光孵育5min,进行染核;用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。(4)免疫印迹法检测NLRP3:冰上裂解细胞,蛋白定量,电泳后转移到PVDF膜,5%脱脂奶粉封闭2h,加入NLRP3一抗(1∶200)过夜,TBST洗涤3次,10分钟/次,加入二抗,室温孵育2h,TBST洗涤3次,10分钟/次,发光液将PVDF膜显色,暗室曝光,扫描灰度值,分析结果。(5)采用DCHF-DA活性氧检测试剂盒测定细胞内ROS水平。将HK-2细胞接种于6孔板,当细胞生长贴壁80%时更换无血清培养基同步化后按实验分组处理后,根据说明书进行操作,用酶标仪检测485/525nm下的荧光强度。测定结果以荧光强度/毫克蛋白表示。

结 果
1.SOD活性:与低糖组比较,高糖组和低糖缺氧复氧组细胞存活率显著降低,ROS含量升高,SOD活性降低(P<0.05);与高糖组比较,高糖缺氧复氧组ROS含量明显升高,细胞存活率,SOD活性明显降低(P<0.05);并且与低糖缺氧复氧组比较,高糖缺氧复氧组ROS含量进一步明显升高,细胞存活率,SOD活性进一步明显降低(P<0.05);与高糖缺氧复氧组比较,高糖缺氧复氧-BAY组ROS含量明显降低,细胞存活率,SOD活性明显升高(P<0.05),见表1。
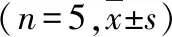
表1 5组细胞细胞存活率、SOD活性、ROS水平的比较
2.caspase-1活性:与低糖组比较,高糖组和低糖缺氧复氧组caspase-1活性,IL-1β含量均升高(P<0.05);与高糖组比较,高糖缺氧复氧组caspase-1活性,IL-1β含量均升高(P<0.05);与低糖缺氧复氧组比较,高糖缺氧复氧组IL-1β含量,caspase-1活性升高更为显著(P<0.05);与高糖缺氧复氧组比较,高糖缺氧复氧-BAY组caspase-1,IL-1β均显著降低(P<0.05),见表2。
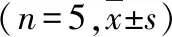
表2 5组细胞caspase-1活性,IL-1β水平的比较
3.Western blot法检测:与低糖组比较,高糖组和低糖缺氧复氧组NLRP3蛋白表达均升高(P<0.05);与高糖组比较,高糖缺氧复氧组NLRP3蛋白表达含量均升高(P<0.05);与低糖缺氧复氧组比较,高糖缺氧复氧组NLRP3蛋白表达升高更为显著(P<0.05);与高糖缺氧复氧组比较,高糖缺氧复氧-BAY组NLRP3蛋白表达显著降低(P<0.05),详见图1。

图1 各组细胞NLRP3蛋白表达水平
免疫荧光检测结果显示高糖刺激与缺氧复氧均可以诱导NLRP3蛋白表达,与低糖缺氧复氧组比较,高糖缺氧复氧组NLRP3表达升高,而NLRP3抑制剂BAY11-7082可在高糖缺氧复氧条件下抑制NLRP3表达,详见图2。

图2 各组细胞NLRP3蛋白免疫荧光结果(×200)
讨 论
缺血导致的低灌注和脓毒血症是人类急性肾损伤的最常见原因[9]。肾脏接受心排出血液量的25%,因此无论是体循环还是肾循环的衰竭都将会对肾灌注造成严重影响,导致缺血再灌注损伤[10]。肾缺血再灌注损伤可导致肾脏细胞广泛或局部的氧供失衡及代谢物排出障碍,这种代谢失衡会导致肾小管上皮细胞损伤[11]。
糖尿病可以增加机体氧化应激水平,导致活性氧自由基水平增高,而活性氧的增多又可进一步导致机体更为严重的氧化应激反应,形成恶性循环[12]。研究表明,高糖会导致肾间质细胞和上皮细胞的活性氧自由基水平上升,使机体处于高氧化应激和强炎性反应状态[13,14]。而慢性氧化应激可以消除麻醉预处理和缺血预处理对缺血再灌注损伤的保护作用[15,16]。故氧化应激反应诱导的细胞信号通路激活对糖尿病肾缺血再灌注损伤的作用机制是临床研究的热点。
大量报道表明糖尿病患者肾脏缺血再灌注损伤明显加重[17]。高血糖可以加重细胞氧化应激损伤,细胞在高糖环境下缺氧复氧损伤的易感性增加[8,18]。本研究采取高糖刺激HK-2细胞72h,缺氧4h复氧2h模拟糖尿病缺血性肾损伤[19]。结果显示,高糖刺激72h后,HK-2细胞CCK-8结果显示细胞活性显著下降。再进行缺氧(4h)复氧(2h)处理,CCK-8结果显示高糖缺氧复氧致细胞损伤较低糖缺氧复氧明显进一步加重,显示了细胞对高糖状态下缺氧复氧损伤的易感性。同时高糖刺激下细胞氧化应激水平显著上升,表现为ROS大量生成,SOD活性下降。同时在缺氧复氧处理后,高糖组较低糖组氧化应激水平进一步显著上升。证实了高糖合并缺氧复氧会进一步破坏细胞氧化/还原平衡,刺激细胞氧化应激水平上升,导致更为严重的损伤。笔者由此推测:细胞氧化还原调节系统失衡是导致高糖缺氧复氧致细胞损伤加重的重要作用机制之一。
NLRP3的激活参与了多种疾病的发生、发展,包括代谢综合征和肾脏疾病[20,21]。大量研究表明钾离子外流,溶酶体破裂和ROS均可以激活NLRP3,其中细胞内ROS的生成是激活NLRP3的关键因素[22]。NLRP-3激活致caspase-1/IL-1β活化,而IL-1β在肾缺血再灌注病理进程中发挥了重要作用[23]。本研究免疫荧光和Western blot法检测蛋白结果显示,NLRP3/caspase-1/IL-1β信号轴在高糖或低糖缺氧复氧条件下显著上调,并且在高糖缺氧复氧条件下进一步显著上调。说明NLRP3在糖尿病缺血性急性肾损伤机制中发挥了关键作用。
为进一步探讨NLRP3/caspase-1/IL-1β信号通路是否参与高糖缺氧复氧诱导HK-2细胞损伤的过程,本研究观察了NLRP3抑制剂BAY11-7082对高糖缺氧复氧对细胞损伤作用的影响。BAY11-7082可抑制NLRP3激活,进而阻断其下游信号通路的转导,从而抑制其相应的生理病理效应[8,24]。研究结果显示BAY11-7082可有效抑制高糖缺氧复氧损伤HK-2细胞的过程,显著提高细胞存活率,减少NLRP3蛋白的表达及caspase-1活性和IL-1β含量,抑制氧化应激水平。为深入阐明抑制NLRP-3/caspase-1/IL-1β信号通路的激活可能是降低氧化应激反应的关键之一提供了实验证据。
综上所述,高糖缺氧复氧致HK-2细胞氧化应激反应增强,NLRP-3/caspase-1/IL-1β信号通路上调,可能是高糖缺氧复氧导致细胞损伤恶化的重要机制,为将来预防治疗围术期糖尿病肾缺血再灌注损伤提供新的靶点。

