MDR1基因多态性与胃癌顺铂化疗疗效的相关性
韩忠诚 苏 莹 陆佳伟 冯燕艳 柳 江
胃癌是导致全球癌症患者死亡的第2大常见癌症,具有高发生率和高病死率的特征[1]。迄今为止,顺铂被认为是治疗胃癌的最常见化疗药物之一,其原理是通过生成DNA加合物阻碍DNA复制从而抑制癌细胞的增殖,手术切除后辅助顺铂化疗的治疗方法能够使患者具有更长的存活时间。然而,胃癌患者的化疗耐药现象依然导致患者的差预后,而化疗耐药的主要原因是药物流入和流出细胞膜受到影响[2,3]。P-glycoprotein蛋白是由MDR1基因编码的一种影响多药耐药性发展的膜结合转运蛋白,是胃肠道抵御口服毒素的首要防线,在癌症治疗过程中能够减少多种化疗药物的胞间浓度从而导致化疗耐药[4]。研究表明,MDR1基因的多态性能够影响P-glycoprotein的表达水平及功能,且被证实其C3435T基因型的多态性明显影响采用5-FU、奥沙利铂、多西他赛药物化疗的胃癌患者的生存预后[5~7]。但MDR1基因多态性对顺铂化疗胃癌患者的预后影响鲜见报道,因此,本研究以顺铂治疗的胃癌患者为研究对象,检测MDR1基因C3435T位点的3种单核苷酸多态性(SNPs),结合患者的临床病例特征,探讨MDR1基因多态性与顺铂化疗疗效的关系,为胃癌患者的化疗提供更多的临床依据。
材料与方法
1.样本资料:收集2013年3月~2015年3月于笔者医院经病理学确诊的胃癌患者共102例。纳入标准:①没有放化疗史;②ECOG行为状态评分范围在0~2分;③化疗前血常规、肾功能、肝功能都在正常值范围内;④KPS评分≥60分。所有胃癌患者在化疗前均签署化疗知情同意书,患者的临床和病理学特征统计见表2。
2.化疗方案及疗效评估:所有患者采用顺铂化疗,浓度为20mg/m2,静脉滴注4天后撤掉,并于25天后再次静脉滴注4天,重复4个周期。根据世界卫生组织临床实体肿瘤评估标准RECIST对2周期化疗后的患者进行疗效评估,具体分为完全缓解(CR)、部分缓解(PR)、进展(PD)和稳定(SD)。
3.MDR1基因多态性检测:采用含有EDTA的离心管收集化疗前患者的2ml外周静脉血,并置于-20℃保存。采用德国Invisorb公司生产的血液DNA提取试剂盒提取患者血淋巴细胞的基因组DNA,并利用PCR联合RFLP技术检测MDR1基因的单核苷酸多态性。PCR扩增的上游引物:5′-TGCTGGTCCTGAAGTTGATCTGTGAAC-3′,下游引物:5′-ACATTAGGCAGTGACTCGATGAAGGCA-3′。采用日本东洋纺公司的KOD高保真酶PCR试剂盒,20μl反应体系包括:40ng基因组DNA、10×反应缓冲液2μl、2mmol/L dNTPs 2μl、25mmol/L MgSO4、上下游引物各0.5μl、KOD高保真酶0.5μl、灭菌双蒸水补齐体系至20μl。PCR扩增后,采用美国Omega公司的核酸纯化试剂盒回收DNA片段,并送至生工生物工程(上海)股份有限公司测序。MDR1基因的C3435T位点存在3种基因型,分别为C/C、C/T和T/T,根据测序结果对每个患者的MDR1基因型进行统计。
4.统计学方法:采用SPSS 17.0统计学软件进行统计分析,MDR1各基因型频率与顺铂疗效和患者临床特征之间的关系采用χ2检验分析。采用Kaplan-Meier方法计算患者的总生存时间(OS)和无进展生存时间(PFS),并用Log-rank和COX回归方法对胃癌患者进行单因素和多因素预后分析,以P<0.05为差异有统计学意义。
结 果
1.MDR1基因的遗传平衡检验:根据测序结果统计102例胃癌患者MDR1 C3435T的3种基因型频率,并采用Hardy-Weinberg定律进行遗传平衡检验。102例胃癌患者中,C/C基因型40例(39.2%),C/T基因型29例(28.4%),T/T基因型33例(32.4%),所有患者达到遗传平衡,具有群体代表性(χ2=1.656,P=0.224)。
2.MDR1基因C3435T多态性与患者临床资料和顺铂化疗疗效的关系:如表1所示,102例胃癌患者经顺铂化疗4个周期后,CR患者5例(4.9%),PR患者36例(35.3%),SD患者41例(40.2%),PD患者20例(19.5%)。采用χ2检验检测患者的临床特征、化疗疗效与MDR1基因型的关系,结果显示C/C基因型患者的化疗有效率(CR+PR)显著高于C/T及T/T基因型(χ2=31.142,P=0.000),而MDR1基因多态性与患者年龄、性别、分化程度、TNM分期等因素之间无明显相关。
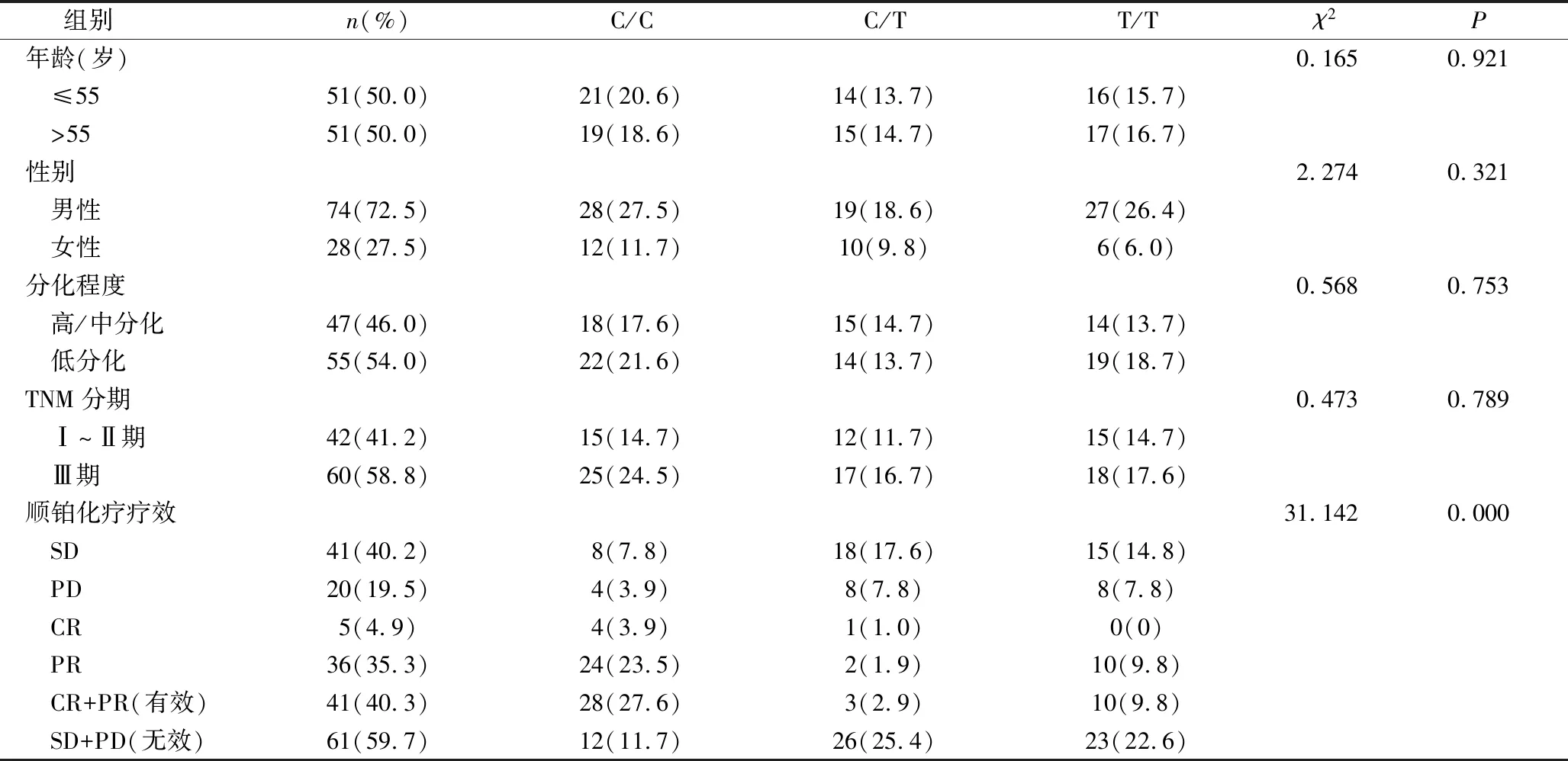
表1 胃癌患者的MDR1基因多态性与临床病理资料及化疗疗效的关系[n(%)]
3.MDR1基因C3435T多态性对顺铂化疗患者的PFS和OS的影响:对102例化疗后的胃癌患者进行40个月的随访,如图1所示,C/C基因型患者的PFS和OS生存时间显著高于C/T和T/T基因型患者(PFS:P=0.046; OS:P=0.011)。通过Log-rank和COX多因素回归模型分析影响患者PFS和OS的预后因素,结果发现MDR1基因的多态性(PFS: HR=3.488,P=0.005; OS: HR=2.418,P=0.035)和TNM分期(PFS: HR=7.914,P=0.015; OS: HR=1.925,P=0.010)是影响顺铂化疗胃癌患者PFS和OS的独立预后因素;细胞分化程度影响顺铂化疗胃癌患者的PFS和OS生存时间,但不是独立预后因素;年龄和性别因素与患者的PFS和OS无明显相关,见表2和表3。
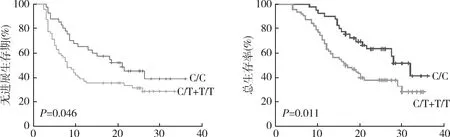
图1 MDR1基因C3435T多态性与胃癌患者PFS和OS的关系
讨 论
MDR1基因多态性被认为能够增强化疗药物从肿瘤细胞中流出,导致血浆浓度降低,从而影响化疗效果。 以往的研究发现,MDR1基因C3435T位点的多态性影响多种疾病的治疗效果,如急性髓性白血病、药物反应性癫痫、多发性骨髓瘤、乳腺癌和肺癌等[8~11]。与C/C基因型相比,MDR1基因C3435T位点的T/T基因型人群血浆中的MDR1表达水平明显降低,而血浆中的地高辛浓度则显著增加[12]。李英等[13]发现,MDR1基因C3435T位点的C/C基因型患者在经过经5-FU/OXA化疗后,其化疗疗效显著高于C/T和T/T基因型的胃癌患者,这些研究结论提示MDR1基因多态性对化疗药物的敏感度。
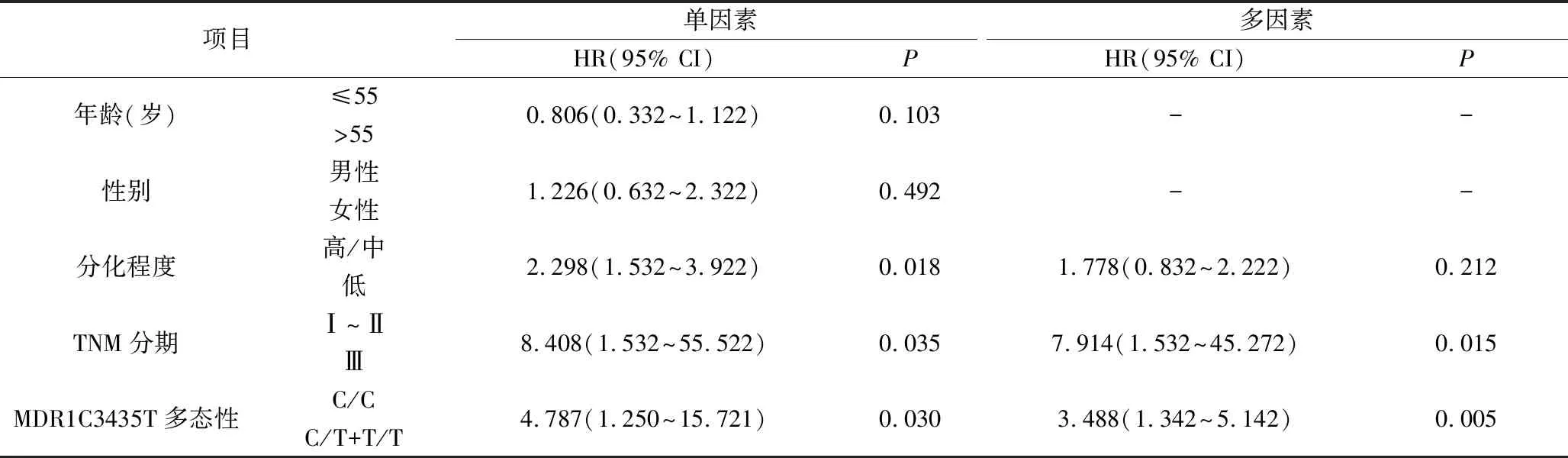
表2 影响顺铂化疗的胃癌患者PFS的独立预后因素分析
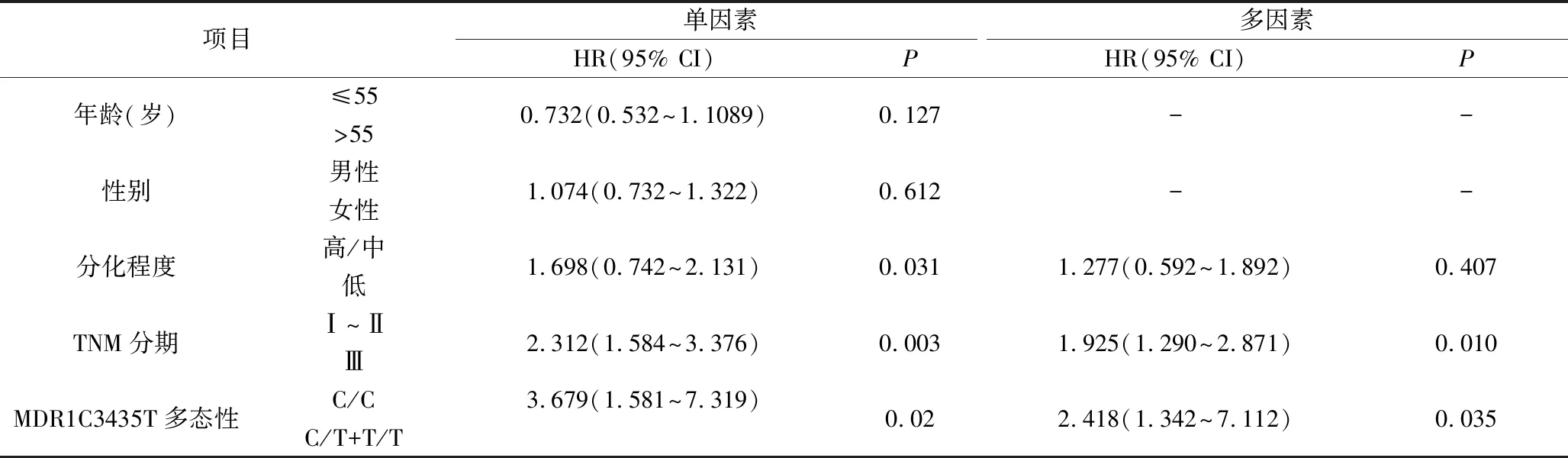
表4 影响顺铂化疗的胃癌患者OS的独立预后因素分析
顺铂药物能够通过与细胞核内DNA形成加和物从而损伤DNA链并导致细胞死亡,而MDR1基因多态性影响顺铂药物治疗胃癌的相关研究鲜有报道,本研究通过检测102例经顺铂化疗的胃癌患者血液基因组中MDR1基因的多态性,发现MDR1 C3435T位点C/C基因型患者对顺铂具有更好的反应程度,其化疗疗效明显高于C/T和T/T患者,这与李英等[15]的研究结果相似。以往研究发现,具有MDR1 C3435位点的C/C基因型个体相比C/T和T/T个体拥有更长的总生存时间(OS)和无进展生存时间(PFS)[14,15]。本研究结果证实接受顺铂化疗的胃癌患者其C/C基因型个体的OS和PFS较C/T和T/T患者显著增加,而C/T和T/T患者则无明显差异,这与Li等[16]研究结果一致。为了发现影响顺铂化疗的胃癌患者生存的独立预后因素,本研究分别采用Log-rank和COX多因素回归模型分析患者的临床资料,结果发现MDR1基因多态性、TNM分期及胃癌细胞分化程度均能影响患者的OS和PFS;MDR1基因多态性和TNM分期是顺铂化疗的胃癌患者的独立预后因素,提示两者能够直接影响胃癌患者的生存预后,证明MDR1基因的多态性对于个体化癌症化疗的应用具有重要的预后价值。
尽管本研究及其他一些报道证实MDR1基因的C/C基因型对癌症化疗疗效及预后具有显著的预后作用,但仍有一些报道发现其不影响癌症患者的预后甚至导致患者的差预后。Johnatty等[15]发现,用紫杉烷/卡铂治疗的卵巢癌患者中MDR1 C3435T多态性与PFS和OS之间没有关联,而具有MDR1的C/C基因型的多发性骨髓瘤和淋巴细胞白血病的患者拥有更短的生存时间[8,10]。导致这些有争议的结果的可能原因包括所研究人群的遗传背景,化疗方案的变化,肿瘤部位和肿瘤分期,以及样本量较少等因素。
综上所述,本研究发现MDR1基因的C3435T位点的多态性与接受顺铂化疗的102例胃癌患者的临床预后有关,具体表现为C/C基因型患者的化疗疗效增加和OS和PFS生存期延长,更进一步通过Log-rank和COX多因素回归模型证实MDR1基因多态性是经顺铂化疗的胃癌患者的独立预后因素,为胃癌的个体化治疗提供一定的理论依据。

