低产尿素与高级醇黄酒酵母菌株的筛选、鉴定与发酵
吴丹丽,李高磊,王明月,陈晓涵,李余动*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
中国黄酒是世界上最古老的谷物酒之一,它是以稻米、黍米、小米等为主要原料,通过浸渍、蒸煮、加曲、发酵、压榨、煎酒、贮存、勾兑而成的低度酿造酒。黄酒营养价值超过了有“液体面包”之称的啤酒和营养丰富的葡萄酒,被誉为“液体蛋糕”[1]。据检测,黄酒中的主要成分除乙醇和水之外,还有丰富的氨基酸、多糖、维生素以及20多种人体所必需的微量元素等[2]。然而,随着人民生活水平的提高以及酒类产品出口的需要,黄酒中较为突出的氨基甲酸乙酯(ethyl carbamate,EC)含量超标[3]问题一直困扰着黄酒发酵工业。EC是发酵食品和酒饮料的伴随产物,具有遗传毒性和致癌性。经酒类饮品摄入的EC对健康构成潜在风险,国际癌症研究机构已经将EC列为人类可能致癌物质(2A类)[4]。黄酒中90%的EC由尿素和乙醇反应生成[5],而尿素主要由精氨酸经酵母细胞内的精氨酸-尿酶路径分解产生[6]。因此,菌株的产尿素能力可以作为低EC含量黄酒发酵的重要指标之一。另一方面,高级醇作为黄酒的重要风味物质之一,能够赋予黄酒酒体特殊的香气[7],若黄酒中高级醇含量偏少,则会使酒味淡薄且酒体不丰满,但是黄酒中高级醇含量过高时,会造成“上头”作用[8],对人体产生一定的危害,并随其分子质量的增加,毒性也相应的增加。因此,控制黄酒中高级醇的含量也尤为重要。
本研究利用菌株的低产尿素及高级醇能力来筛选菌株,通过生理生化与分子手段鉴定菌株的分类地位,并在黄酒发酵模拟条件下比较菌株的发酵性能及黄酒成分,从而筛选出低产尿素和低产高级醇的优良菌株。本研究所筛选菌株的工业化应用有助于减少黄酒中EC和高级醇的含量,提高黄酒的品质。
1 材料与方法
1.1 材料与试剂
酿酒酵母菌株AW001、D2、IJ、J-16-2、N85,由浙江工商大学微生物学实验室提供。
YPD培养基:酵母提取物1%、葡萄糖2%、蛋白胨2%、水100 mL,115 ℃高压灭菌20 min;精氨酸利用检测培养基:葡萄糖2%,精氨酸10 mmol/L,无氮源基础培养基0.17 g/L,115 ℃高压灭菌20 min;尿素利用检测培养基:葡萄糖2%,尿素10 mmol/L,无氮源基础培养基0.17 g/L,115 ℃高压灭菌20 min;其他生理生化鉴定用培养基根据文献[9]的方法制备。
酵母基因组提取试剂盒 美国BioTek公司。
1.2 仪器与设备
721型可见分光光度计 上海菁华科技仪器有限公司;核酸电泳仪 美国Bio-Rad公司;高速冷冻离心机 德国Sigma公司;Biometra型聚合酶链式反应(polymerase chain reaction,PCR)仪 北京东方安诺生化科技有限公司;JS-680B型电泳图像分析仪 上海培青科技有限公司;LightCycler 480实时荧光定量PCR仪美国罗氏公司;电热恒温培养箱 浙江省嘉兴市新勝电器厂。
1.3 方法
1.3.1 产尿素能力测定[10]
用灭菌的竹签从甘油管中挑取少许接种到已灭菌的YPD液体培养基中,30 ℃、200 r/min培养过夜,取200 μL菌液接种至另一瓶YPD液体培养基中二次活化,然后进行平板划线,挑取单菌落划试管斜面待用。从4 ℃冰箱中保存的试管斜面上挑取适量菌体接种于YPD液体培养基,30 ℃、200 r/min过夜培养,菌液供后续实验使用。
量取配制好的精氨酸利用检测培养基以及尿素利用检测培养基100 mL分装至250 mL三角瓶中,灭菌。待冷却后,分别接入活化酵母(接种量为1×107cell/mL),30 ℃、200 r/min进行培养。每隔4 h取样,持续48 h,共取样12 次。所取样品均进行OD600nm的测定,48 h的终发酵液进行尿素含量的测定,每隔12 h在精氨酸利用培养基中取样,送至江南大学实验平台测定其中精氨酸的含量变化。
1.3.2 黄酒发酵模拟及理化指标测定[11]
黄酒发酵过程:取100 g大米,在室温中浸渍2~3 d,经常压蒸煮冷却后,分装至1 L的三角瓶中,添加10%的麦曲、170 g水,并将经活化后的酵母菌按1×107cell/mL的接种量接种至熟米饭中,前酵于30 ℃静置发酵5 d,随后将摇瓶置于15 ℃继续静置发酵,15 d后结束后酵,取发酵液检测理化指标。
理化指标测定:按照GB/T 13662—2008《黄酒》中方法进行测定;酵母计数:采用血球计数板;挥发性成分的测定:参照参考文献[12]进行;尿素氮含量的测定:采用血尿素氮试剂盒测定。
1.3.3 酵母菌的分子鉴定与定量PCR
1.3.3.1 酵母菌的常规鉴定及基因组提取
酵母菌的生理生化特征性实验根据文献的方法进行[13]。采用酵母菌基因组提取试剂盒提取基因组,放置于-20 ℃保存,待下一步分子鉴定。
1.3.3.2 PCR扩增[14-15]
以提取的酵母菌基因组D N A作为模版,r D N A-I T S序列扩增所采用的通用引物为I T S 1(5′- TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。反应体系(50 μL)为:RNase-Free Water 22 μL,2×Es Taq MasterMix 25 μL,Forward Primer(20 μmol/L)1.0 μL,Reverse Primer(20 μmol/L)1.0 μL,Template DNA 1 μL。反应条件:94 ℃预变性5 min,94 ℃变性1 min,56 ℃退火30 s,循环30 次,72 ℃延伸2 min,72 ℃终延伸10 min。PCR产物进行琼脂糖凝胶电泳,DL2000 DNA Marker作为参照标准,凝胶成像仪观察记录结果。
1.3.3.3 菌株系统进化分析
将测序所得结果进行BLAST同源序列,得到与此序列相近的已知酵母菌株。随后采用MEGA 6.0软件构建进化树[16]。
1.3.3.4 相对定量PCR验证[17-18]
采用TakaRa公司的产品SYBR®Premix ExTaq™染料法对目的基因进行相对定量实验,实验用到的内参基因为18S rRNA基因,对照组为实验室已有的BY4741菌株。利用NCBI网站查找CAR2的核酸序列,然后继续用该网站的Primer BLAST设计实时定量PCR引物,后利用Primer Premier 5软件对设计的引物进行评分,得到评分较高的引物送公司合成。引物合成后,先用普通PCR实验来初步验证引物的特异性,再按照SYBR染料试剂说明和所使用仪器LightCycler 480 System设计实时定量PCR体系和参数(表1)。
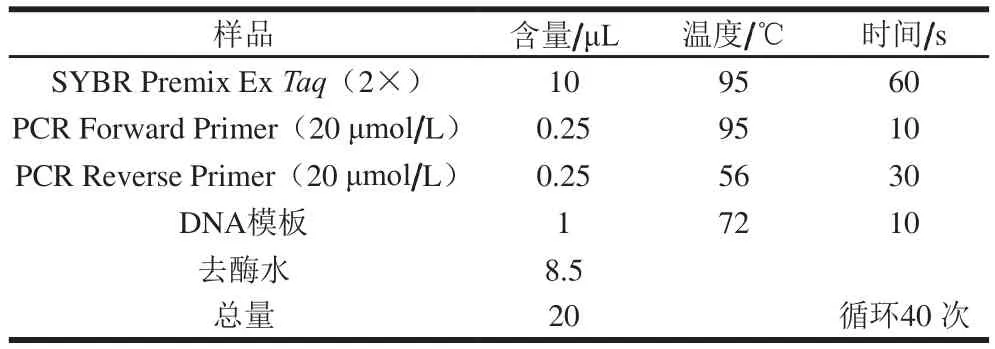
表1 LightCycler 480 System仪器参数设置和实时定量PCR体系Table 1 LightCycler 480 System parameter setting and qPCR system
1.4 数据统计分析
一般实验数据进行3 次测定,不同培养条件下菌株的生长差异分析(t-test)及结果作图都由Origain Pro 9.0完成。
2 结果与分析
2.1 酵母菌株产尿素能力比较
2.1.1 精氨酸利用检测培养基
黄酒中的尿素主要是由精氨酸代谢产生,因此本研究首先通过精氨酸为唯一氮源的培养基比较不同酵母菌株的产尿素能力[19]。由图1A可以看出,在添加精氨酸的培养基中菌株的生长速率由快至慢依次为IJ、D2、N85、J-16-2、AW001。当到达48 h时,各菌株的OD600nm值基本处于一致。约30 h时,IJ、D2、N85三株菌的对数生长期基本结束,菌株的生长开始进入稳定期,而此时菌株J-16-2、AW001两株菌的生长依然处于对数生长期,因48 h时5 株菌的OD600nm值基本相同,所以大致可以推测48 h后J-16-2、AW001该两株菌的最终OD600nm值较IJ、D2、N85高,即J-16-2、AW001在精氨酸利用培养基中生长状况比IJ、D2、N85良好。
从图1B可看出,菌株IJ发酵产生的尿素最多,而菌株AW001的最终发酵液中尿素含量在该5 株菌中最低。菌株在生长繁殖以及进行乙醇发酵的过程中,合成的大量尿素除了满足自身需要之外,多余的尿素被分泌到体外,从而使酒样中的尿素含量增加。酵母菌细胞内的精氨酸酶活力也会随之提高[17],通过精氨酸酶-尿酶途径分解精氨酸,进一步加速了尿素的生成,影响黄酒的品质。
图1C为精氨酸培养基中不同黄酒酵母对精氨酸的利用量测定。在0~12 h中,各菌株对精氨酸的利用量基本一致且均非常少;在12~24 h中,菌株对精氨酸的利用量开始增加,发酵液中精氨酸的含量开始减少,其中以菌株IJ的利用量最大;在24~36 h中,菌株D2、IJ、N85发酵液中的精氨酸含量开始大幅度降低,但是菌株AW001、J-16-2发酵液中精氨酸含量降低程度相对较少;在36 h时,各菌株发酵液中精氨酸的含量呈现较大的差异性,其中以J-16-2发酵液中的含量最高,菌株IJ发酵液中的含量最低;在36~48 h中,菌株J-16-2的发酵液中精氨酸的含量大幅度降低,在48 h时,各菌株发酵液中精氨酸的含量差异较为明显,精氨酸含量由多至少依次为AW001、J-16-2、N85、D2、IJ,与尿素含量正好相反,此结果与尿素测定结果相一致。
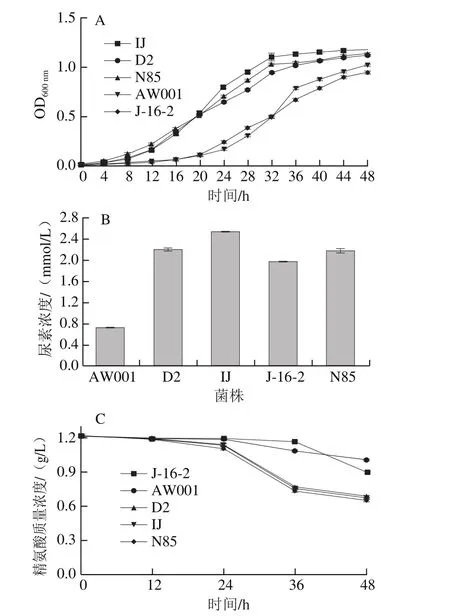
图1 酵母菌株在精氨酸利用培养基中的生长状况(A)、产尿素含量(B)以及精氨酸利用情况(C)Fig. 1 Growth curves of yeast strains (A), urea production (B) and arginine utilization (C) on medium containing arginine as sole nitrogen source
2.1.2 尿素利用检测培养基
为考察酵母菌株对尿素的利用能力,通过以尿素为唯一氮源的培养基检测酵母菌的生长情况。从图2A可以看出,在添加尿素的培养基中菌株的生长速率由快至慢依次为IJ、D2、J-16-2、AW001、N85,当到达48 h时,菌株IJ、D2、J-16-2、AW001的OD600nm值基本处于一致,而N85的OD600nm值相对较低,说明菌株N85在尿素培养基中生长状况略差于菌株IJ、D2、J-16-2、AW001。从图2B可以看出,菌株J-16-2最终发酵液中尿素含量最高,表明其对尿素的利用能力最差,随后依次是N85、D2、AW001、IJ,但5 个菌株间差异不显著。酵母生长状况与尿素利用情况无明显关联,也说明黄酒发酵液中的尿素含量主要受黄酒酵母菌株对精氨酸代谢的影响。
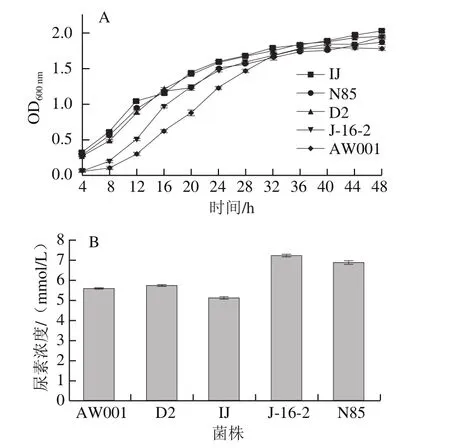
图2 酵母菌株在尿素利用培养基中的生长状况(A)以及产尿素含量(B)Fig. 2 Growth curves of yeast strains (A) and urea production (B) on medium containing urea as sole nitrogen source
2.2 精氨酸代谢基因CAR2拷贝数分析
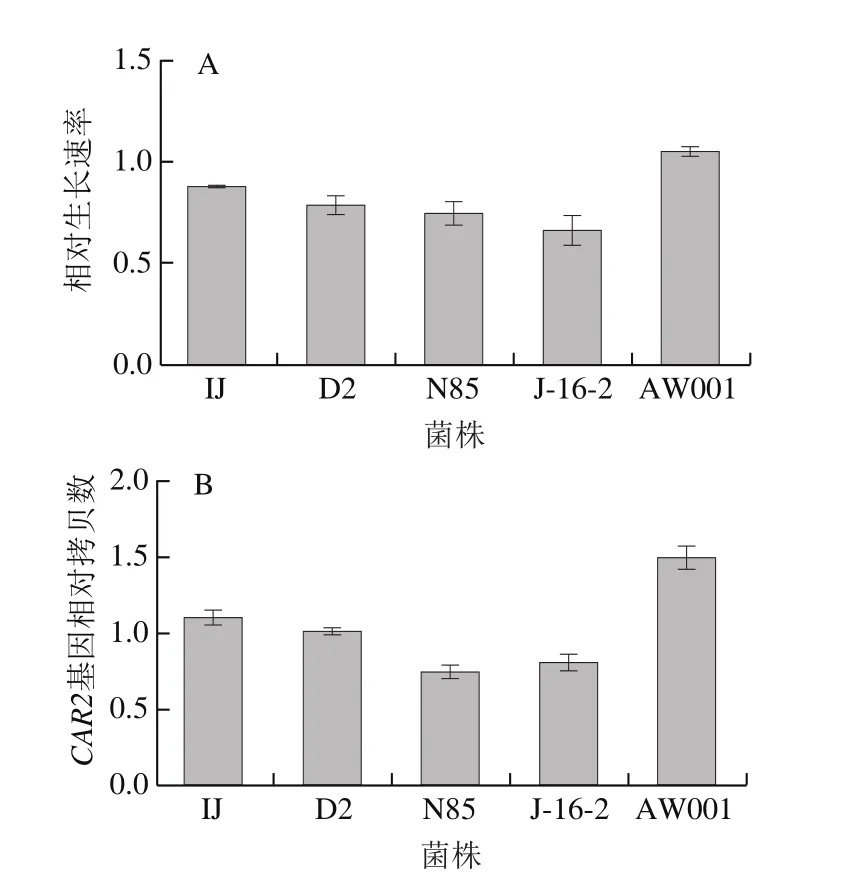
图3 酵母菌株在精氨酸利用培养基中的对数期生长速率(A)与CAR2基因相对拷贝数(B)Fig. 3 Relative growth rates of yeast strains in the logarithmic phase on medium containing arginine as sole nitrogen source (A) and copy number of CAR2 gene (B)
精氨酸的代谢与CAR2基因拷贝数有关,CAR2基因编辑L-鸟氨酸转氨酶,参与精氨酸分解代谢的第2步酶促反应过程。据文献报道[20],在精氨酸利用培养基中,酵母菌的相对生长速率与CAR2基因的拷贝数有一定的关系,即CAR2基因的拷贝数越多其生长速率越快。以BY4741菌为对照,利用实时定量PCR技术对这5 株菌做了CAR2基因拷贝数验证。图3A为5 株菌在对数期的生长速率,可以看到AW001在对数期生长速度最快,其次是IJ、D2、N85、J-16-2。图3B为不同菌株中CAR2基因的拷贝数结果,其中AW001的CAR2基因拷贝数最多,而其在精氨酸培养基中的生长速率也最快,这一结果与文献报道一致,CAR2基因拷贝数越多对精氨酸利用能力越强。因此CAR2基因的拷贝数分析结果进一步说明AW001对精氨酸的利用能力较强。
2.3 黄酒发酵高级醇含量分析
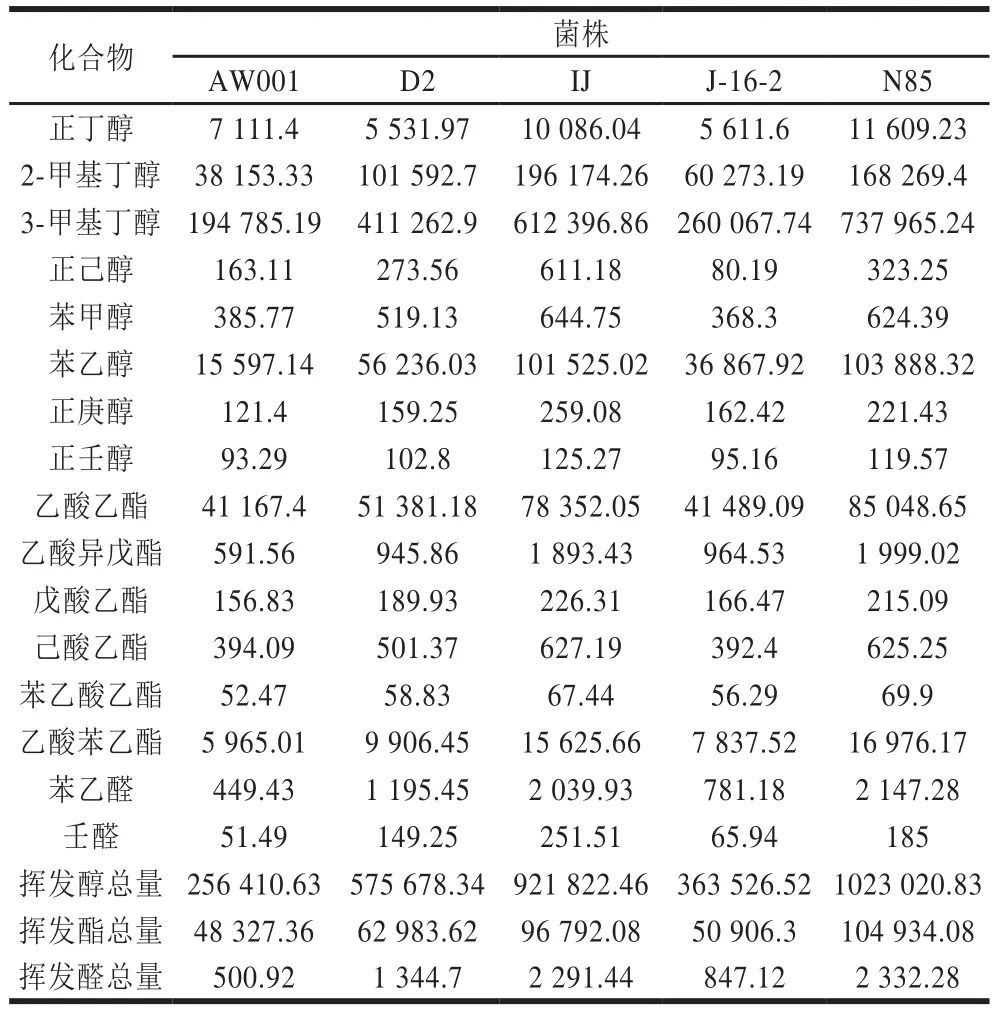
表2 不同酵母菌株发酵产物中的主要挥发性成分含量Table 2 Concentrations of main volatile fl avor compounds in rice wines fermented with yeast strains μg/L
黄酒中的主要成分是水、乙醇和糖分,三者约占总量的96%~97%,其他微量组分仅占3%~4%,但是这些微量组分却决定了黄酒的风味特征及品质的差异[12,21],其中包括醇类、醛类、酯类等。黄酒中的高级醇是重要的风味物质,能赋予酒体醇香味,衬托酯香。但是当其含量过高时致醉性增强,会使人头痛、恶心(俗称“上头”),对人体有毒害的作用,还会产生不和谐的味道,影响酒体品质。因此有必要控制黄酒中高级醇的含量[22]。如表2所示,本研究测定的醇类物质主要包括:3-甲基丁醇、2-甲基丁醇、正丁醇(刺激臭,带有涩味)、苯乙醇(似玫瑰香,持久性强,微带苦味),它们在黄酒中含量远高于其他挥发性醇类。通过比较不同酵母菌株发酵产生的挥发性醇类总量,菌株AW001及J-16-2发酵的黄酒样品中高级醇含量远低于其他的菌株,因此菌株AW001和J-16-2在此方面的发酵性能更优良。
2.4 黄酒发酵理化指标分析
如表3所示,菌株AW001以及J-16-2所发酵黄酒的乙醇体积分数比其他3 株菌均高,且此两株菌最终的总糖含量也较高,表明该两株菌的乙醇发酵能力更强,对糖类物质的利用率远大于其他3 株菌。GB/T 13662—2008中对各种类型黄酒中总酸的要求基本都在2.5~8.0 g/L之间,适量的酸对于黄酒的品质有积极的促进作用,由表3可知,5 株菌发酵的黄酒样品中总酸的含量均达到国家标准[23]。酵母菌能够利用氨基酸态氮进一步代谢生成高级醇,此外,还可以与糖发生美拉德反应,增加黄酒的色泽,菌株AW001及J-16-2中氨基酸态氮的含量高于其他菌株。此外,黄酒的风味、品质还受到挥发性醇类、酯类、醛类等的影响,其含量测定结果如表2所示。综上所述,菌株AW001以及J-16-2完全符合黄酒相关国家标准要求,且在乙醇、氨基酸态氮等方面有明显的优势[24]。
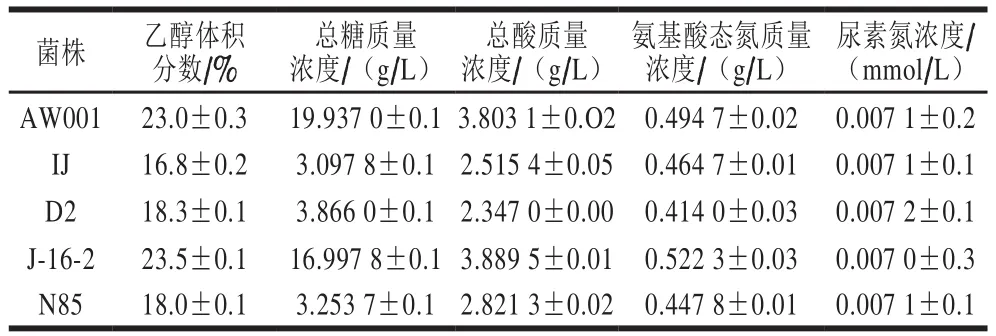
表3 酵母菌株发酵产物的理化指标Table 3 Physicochemical indexes of rice wines fermented with yeast strains
2.5 酵母菌株鉴定
2.5.1 生理生化实验
对酵母菌进行生理生化鉴定[25],如表4所示,在糖发酵实验中,5 株酵母菌均能利用葡萄糖、麦芽糖以及蔗糖进行发酵,然而均不能利用乳糖与可溶性淀粉。在碳源同化实验中,D-葡萄糖、蔗糖、麦芽糖、D-半乳糖以及棉籽糖均能被5 株菌所利用,但是乳糖、菊糖、D-木糖、L-阿拉伯糖、鼠李糖、D-纤维二糖、山梨糖、淀粉、肌醇及柠檬酸均不能被5 株菌所利用。氮源同化实验结果显示硫酸铵与硝酸铵均能被5 株菌所利用,柠檬酸钠只能被菌株AW001所同化,却不能被其他4 株所利用,硝酸钾与醋酸钠均不能被5 株菌使用。5 株菌的生长过程均不能产类淀粉类化合物以及脂类物质。在无维生素培养基上,该5 株菌均能生长。
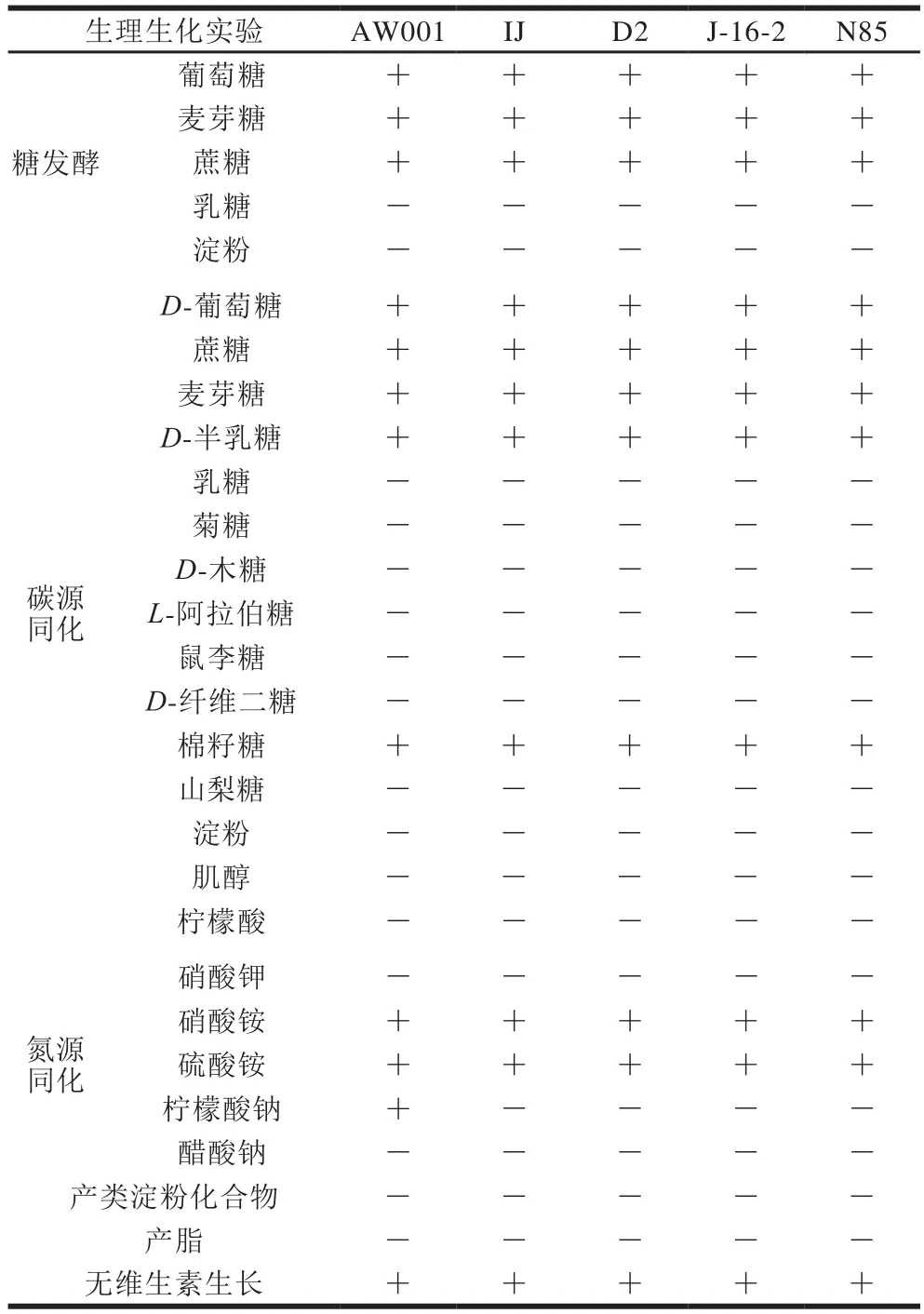
表4 菌株的生理生化鉴定结果Table 4 Physiological and biochemical identification of yeast strains
2.5.2 分子鉴定
酵母的ITS序列位于26S和5.8S及5.8S和18S rDNA基因之间,属于高度可变的区域,适用于亲缘关系较近的菌株间的分类研究[26]。因此,本实验将所提取的酵母菌株的基因组,利用ITS1以及ITS4作为引物对菌株进行PCR扩增,以DL2000的DNA Marker作为标准,通过图4可以看出,所有菌株的PCR扩增产物条带迁移均一,所扩增的片段大小约为800 bp,与ITS目标序列长度一致。
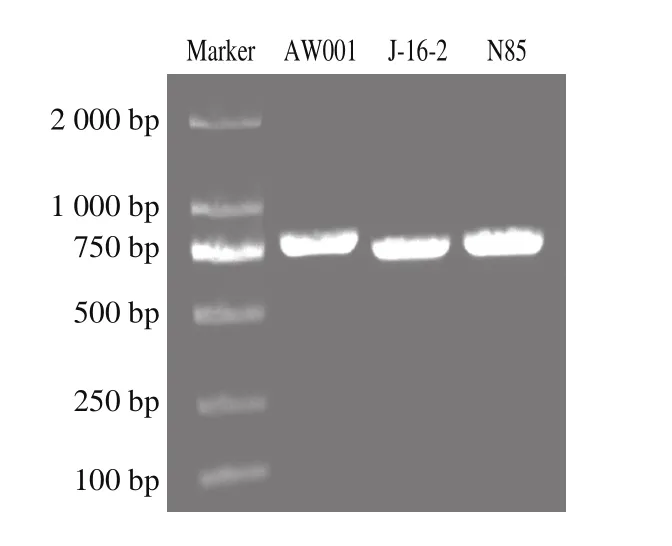
图4 酵母菌基因组ITS 区段PCR扩增图谱Fig. 4 Electrophotogram of PCR-amplified ITS from yeast
PCR扩增产物经测序后,得到菌株的rDNA ITS片段序列,并将获得的序列进行BLAST分析获得与其同源的其他酵母菌株的ITS序列。通过多序列比对,利用MEGA软件构建进化树。从图5可以看出,菌株AW001、J-16-2以及N85与酵母属中的Saccharomyces bayanus进化关系较远,而与Saccharomyces cerevisiae的遗传距离较近。菌株AW001与S. cerevisiae YJM1304聚集在同一分支上,其碱基差异率为0.003,在ITS水平上可以鉴定为S. cerevisiae;菌株N85与S. cerevisiae CBS405聚集在同一分支上,碱基差异率为0.001,在ITS水平上同样也可以鉴定为S. cerevisiae;而菌株J-16-2与S. cerevisiae YJM271聚集在同一分支上,碱基差异率为0.021。因此在ITS水平上可将这3 株酵母菌鉴定为酿酒酵母(S. cerevisiae)。

图5 基于rDNA ITS序列的进化树Fig. 5 Phylogenetic tree based on rDNA ITS sequence alignment
3 结 论
酿酒酵母菌株性能的优劣对于发酵酒的品质起到关键性作用[27]。本研究对实验室已分离的5 株酵母菌株进行低产尿素以及高级醇筛选,随后进行菌株的鉴定及模拟黄酒发酵实验。在低产尿素实验中,菌株AW001和J-16-2利用精氨酸产生尿素的能力弱于菌株D2、IJ以及N85,因此能够有助于控制黄酒中EC的含量。另通过测定黄酒发酵样品中醇类物质的含量筛选出产高级醇较少的菌株AW001和J-16-2,有助于解决高级醇“上头”问题。综合实验室模拟黄酒发酵的各个指标数据,菌株AW001和J-16-2除产生的乙醇高于其他3 株菌外,其他指标也均符合国标要求。因此本研究筛选出性能较好的酵母菌株AW001和J-16-2将有进一步开发利用的价值。

