酶法提取对玉米皮阿拉伯木聚糖组成及分子质量分布的影响
谷春梅,尹佳玉,姜 雷
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
玉米皮是玉米淀粉和玉米蛋白质加工的副产物,也被称为玉米纤维,产量占玉米干质量的14%[1]。目前,很多企业只将其用作饲料或废弃,造成很大的资源浪费。玉米皮作为清洁易得的农产品下脚料,是开发食品组分的丰富资源[2]。专家学者已对玉米皮中的功能性成分进行了大量的研究工作,但对于酶法提取阿拉伯木聚糖(arabinoxylan,AX)的研究较少[3-7]。
玉米皮细胞含有大量的纤维素、半纤维素、较多的酚酸以及少量的蛋白质。AX是玉米皮半纤维素杂木聚糖中的主要多糖。AX的基本结构是以(1→4)-β-D-吡喃木糖残基聚合而成的线型主链。侧链主要通过C(O)-2或C(O)-3键连接阿拉伯呋喃糖基或通过C(O)-2和C(O)-3同时连接阿拉伯呋喃糖基。玉米皮AX的另一结构特点是其分子上连接大量的酸性基团,其中直接与主链连接的是醋酸,与阿拉伯呋喃糖基连接的是对羟基桂皮酸、阿魏酸。这些活性基团可参与重要的化学反应[8-10]。
谷物麸皮中AX的提取方法有多种,其中化学试剂提取法提取率高,但由于此方法中使用大量的酸和碱,存在提取物的食用安全性低、对活性基团保留率低、价格高、环境污染重、对设备要求高等问题,仅适用于实验室进行小规模实验[11-12];而生物技术特别是酶法提取技术则因其条件温和、绿色无污染、能最大限度地回收有效成分,代表了AX加工技术的发展方向[13-15]。
本研究以鲜玉米麸皮为原料,采用酶法提取玉米皮AX,用食品工业中常用的4种木聚糖酶Grindmyl Powerbake 950、Pentopan mono BG、Viscozyme L及Amano HC 90提取不同时间,研究提取物的提取率、单糖组成及分子质量分布,筛选出1 种对玉米皮中AX提取效果较好的商业木聚糖酶,并确定其最适添加量,以期为玉米加工副产物的综合利用及玉米皮AX的分离纯化提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜玉米麸皮(为鲜榨玉米汁副产物) 吉林天景食品有限公司;桦木木聚糖、D-(+)-半乳糖、D-(+)-木糖及D-(+)-葡萄糖 美国Sigma公司;阿洛糖 美国Miragen公司;L-(+)-阿拉伯糖、D-(+)-甘露糖及L-(+)-鼠李糖 德国Dr. Ehrenstorfer GmbH公司;其他试剂均为分析纯。
酶制属Aspergillus aculeatus菌株生产,其中包括阿拉伯聚糖酶、纤维素酶、β-葡聚糖酶、半纤维素酶和剂:Grindmyl Powerbake 950(简称G,由细菌发酵,是一种纯化的内切β-1,4-木聚糖酶) 丹尼斯克(中国)有限公司;Pentopan mono BG(简称P,由米曲霉菌Aspergillus oryzae经深层发酵制得,是一种纯化的内切β-1,4-木聚糖酶)和Viscozyme L(简称V,由曲霉木聚糖酶等发酵制得) 诺维信(中国)生物技术有限公司;Amano HC 90(简称HC,由黑曲霉Aspergillus niger菌株生产,除含有木聚糖酶外,还含有纤维素酶、β-糖苷酶、果胶酶等) 天野酶制剂(江苏)有限公司。
1.2 仪器与设备
GC-14C型气相色谱仪 日本岛津公司;高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)仪 美国怀雅特公司;十二联平行发酵系统 汇能达生物工程设备有限公司;旋转蒸发仪 上海青浦沪西仪器厂;3K15型高速冷冻离心机美国Sigma公司。
1.3 方法
1.3.1 鲜玉米麸皮的前处理
参照胡叶碧的方法,略作改动[16]。
鲜玉米麸皮经自来水冲洗至水澄清,在电热鼓风干燥箱中,90 ℃烘干。将烘干的鲜玉米麸皮粉碎,过20 目筛网,并在121 ℃高压灭菌20 min,于-20 ℃冰箱保存。
上述鲜玉米麸皮中加入0.05 mol/L,pH值为6.5的磷酸缓冲液(1∶7,g/mL),室温条件下溶胀18 h,放置水浴锅中,将温度调节至75 ℃,以鲜玉米麸皮计加入淀粉酶(10 µL/g),搅拌反应1 h,将温度调节至60 ℃,以鲜玉米麸皮计加入高转化率糖化酶(4 µL/g),搅拌反应30 min,以鲜玉米麸皮计加入碱性蛋白酶(100 µL/g),搅拌反应4 h,100 ℃水浴中加热10 min灭酶,以去离子水边冲洗边抽滤,至去离子水清澈,将滤渣放入鼓风干燥箱中,70 ℃干燥,即得去淀粉去蛋白质鲜玉米麸皮(destarched and deproteinised fresh maize bran,DSDPB)。
1.3.2 木聚糖酶活力测定
采用胡叶碧等的方法[17]。
酶与缓冲液充分混匀(1∶100,g/mL),室温搅拌30 min,8 000 r/min离心20 min,上清液备用。
以桦树木聚糖为底物,酶与底物共3.5 mL,充分混匀,在酶的最适反应条件下(Grindmyl Powerbake 950在50 mmol/L pH 5.0的NaAc缓冲液中,最适温度为40 ℃;Pentopan mono BG在50 mmol/L pH 5.0的NaAC缓冲液中,最适温度为55 ℃;Amano HC 90在50 mmol/L pH 4.5的NaAC缓冲液中,最适温度为50 ℃;Viscozyme L在50 mmol/L pH 4.5的NaAc缓冲液中,最适温度为45 ℃),反应15 min,沸水浴中加热10 min灭酶,DNS法测定反应液中还原糖的含量,用标准木糖做标准曲线。以每分钟催化木聚糖生成1 µmol还原糖所需的酶量为1 个酶活力单位(U)。
1.3.3 鲜玉米麸皮中AX的酶法提取
参照蒋琦霞等的方法[18],略作改动。
将DSDPB与缓冲液以一定比例混合(1∶30,g/mL),以DSDPB计,分别加入200 U/g的4 种商业木聚糖酶,于十二联平行发酵系统中,分别在每种酶的最适条件下(同1.3.2节)搅拌反应1、4 h及24 h,100 ℃水浴中加热10 min灭酶,离心,上清液浓缩后,冷冻干燥,备用。AX提取率按如下公式计算:

1.3.4 单糖组成测定
参照Craeyveld[19]和Delcour[20]等的方法,略作改动。上述鲜玉米皮酶法提取物用2.5 mL,4.0 mol/L三氟乙酸在110 ℃水解60 min,水解液用NaBH4还原,用醋酸酐酯化,用于气相色谱法测定单糖组成。采用30 m Supelco SP-2380柱(内径0.25 mm,膜厚度0.2 μm)。
进样条件:载气,N2;进样量4.0 μL;进样温度280 ℃;检测温度280 ℃;程序升温:初始温度100 ℃,2 min;1 ℃/min升至110 ℃,维持1 min;5 ℃/min升至115 ℃;1 ℃/min升至118 ℃;25 ℃/min升至175 ℃;1 ℃/min升至220 ℃,维持5 min;10 ℃/min降至100 ℃,维持2 min。以β-D-阿洛糖为内标。内标法结合峰面积法计算单糖含量。AX含量以阿拉伯糖与木糖含量之和乘0.88计。
1.3.5 分子质量分布的测定
参照Escarnot等[21]的方法,略作改动。鲜玉米皮提取物溶于蒸馏水,经5 μm微孔滤膜过滤,取滤液进入HPSEC进行分析,进样量100 μL,洗脱温度55 ℃,洗脱液流速0.5 mL/min;采用Version 5.3.4.14ASTRA软件分析鲜玉米皮酶法提取物的重均分子质量(mw)及数均分子质量(mn)。
1.3.6 Amano HC 90最适添加量的确定
将DSDPB与缓冲液以一定比例混合(1∶30,g/mL),以DSDPB计,分别加入50、100、400、550、700、850、1 000、1 500、2 000 U/g Amano HC 90,于十二联平行发酵系统中,最适条件下4 h、100 ℃水浴中加热10 min灭酶,离心,上清液浓缩后,冷冻干燥,以提取率和提取物中AX含量为指标,确定Amano HC 90的添加量。
1.4 统计分析
采用至少2 次实验结果的 ±s表示,使用SPSS statistics version 17.0软件进行方差分析,P<0.05表示差异显著,有统计学意义,P<0.01表示差异极显著。
2 结果与分析
2.1 酶法提取物的组成
采用酶法提取玉米皮AX,其单糖组成主要是阿拉伯糖和木糖,此外还有少量的葡萄糖、半乳糖和甘露糖;其各单糖组分的含量受酶的种类的影响而产生变化。本研究采用4 种食品工业中常用的木聚糖酶提取鲜玉米皮中的AX,在各木聚糖酶的最适作用条件下提取1、4、24 h,提取物的组成如表1所示。

表1 不同种类酶提取玉米皮AX的相关指标Table 1 Effect of different xylanases on monosaccharide composition,purity and yield of araboxylan
由表1可知,采用4 种木聚糖酶提取玉米皮AX,1 h后提取率均明显增加(P<0.05)。对于G和HC,提取4~24 h时,提取率增加不明显。经4 种酶分别酶解玉米皮24 h所提取玉米皮AX提取率由高到低为V>HC>G>P,分别为(27.88±2.48)%、(17.37±2.74)%、(15.08±0.69)%、(2.00±0.00)%;提取物的单糖组成,对于P,提取1~24 h,提取物中AX质量分数从5.7%增加到21.89%;对于V,AX质量分数由30.51%增加到62.18%;对于G,提取物中AX质量分数由8.81%增加到44.21%;对于HC,AX质量分数从31.61%增加到78.63%。因此,采用HC提取,提取物中AX含量较高。
木聚糖酶是采用酶法提取AX的主要酶制剂。木聚糖酶是一类可以将木聚糖降解成低聚木糖或木糖的复合酶系,它能打破木聚糖主链,随机清除内部β-(1,4)-糖苷键。木聚糖酶的种类很多,且不同来源的木聚糖酶在结构和性质上也会有较大差别,因此采用不同的木聚糖酶在相同的工艺条件下处理玉米皮对AX的提取率和纯度会造成较大影响。从气相色谱分析结果看,V的提取率最大,而HC的提取物中AX含量最高,可能是受木聚糖酶特性的影响。
胡叶碧[16]采用酶法制备的粗玉米皮膳食纤维的主要组成单糖是木糖和阿拉伯糖,还有部分的甘露糖、半乳糖、葡萄糖以及少量的鼠李糖,在不溶性膳食纤维中AX质量分数为82.92%,水溶性膳食纤维中AX质量分数为45.90%。李勤勤等[22]采用酸碱处理得到的酸解产物和碱解产物的单糖组成主要是木糖和阿拉伯糖,还有少量的葡萄糖、半乳糖和甘露糖;其中经酸处理得到的AX质量分数为84.37%,经碱处理得到的AX质量分数为89%。过嫣丹[23]采用碱-过氧化氢法从玉米麸皮中提取AX质量分数为89.37%,其单糖组成阿拉伯糖、木糖、葡萄糖、半乳糖和鼠李糖。本研究采用酶法提取的玉米皮中AX的单糖组成(图1)与化学法的相比较,其主要差别在于含量较少的组分,比如甘露糖和鼠李糖,各单糖组分的比例变化较大;在本研究中采用不同种类酶提取的AX的各单糖组分的含量不同,这与胡叶碧的研究结果——木聚糖酶将膳食纤维中的不溶性成分降解为可溶性物质,在增加可溶性膳食纤维的同时也明显的改变了其化学组成的结论相一致。
评价AX结构特点的一个重要指标为木聚糖主链的平均取代度[24]。主链平均取代度可以反映AX的取代程度,即侧链阿拉伯糖含量的多少,其含量的不同说明其AX具有不同的功能特性。从表1可以看出,玉米皮经酶解后所得AX的Ara/Xyl由高到低为G>V>HC>P,比值分别为0.72、0.65、0.63、0.60,均无显著差异。可见得出采用木聚糖酶酶解玉米皮所得到的AX在主链上的取代方式无显著差异。
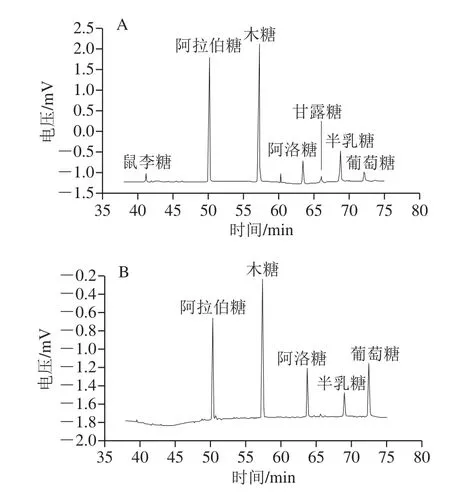
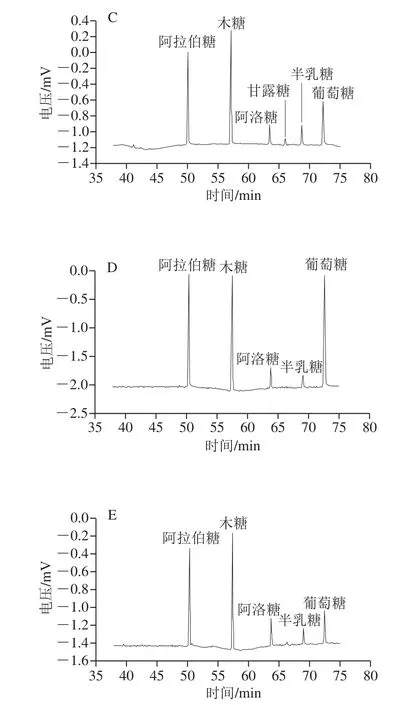
图1 不同种类酶提取玉米皮AX的单糖组成分析Fig. 1 Monosaccharide compositions of maize bran arabinoxylans extracted with different xylannases
目前,对于谷物中AX的提取主要集中于麦麸麸皮,科研人员对其不同的提取方法进行了广泛的研究[25-27]。与麦麸中AX分子结构相比,玉米皮中AX的分子上侧链的种类、数量、侧链的长度及取代方式较复杂,且分子上连接阿魏酸、醋酸及羟基桂皮酸等活性基团,会使分子间发生更为复杂的氧化交联,致使其提取率降低。目前针对玉米皮AX的提取主要集中在化学试剂提取法,宋琳琳等[28]采用正交设计的方法对玉米皮AX的碱提工艺进行优化,最高得率为24.57%。刘静等[29]采用碱-过氧化氢法从玉米麸皮中提取AX,其提取率最高为27.85%。本研究采用酶法提取玉米皮中的AX,提取率最高为17.37%,虽然其提取率较化学试剂提取法低,但酶法提取有成本低、操作安全、对环境友好的优点,同时也可通过协同其他方法来提高其提取率,说明酶法提取更适于工业生产。
2.2 酶法提取物的分子质量分布
木糖通过β-1,4糖苷键链接形成木聚糖,构成玉米皮AX的骨架,AX作为侧链连接在骨架上。木聚糖酶酶解玉米皮AX时将会作用于木聚糖骨架上任意位置的β-1,4-D-呋喃木糖键,从而得到分子质量不一的片段。
本研究对4 种食品工业中常用的木聚糖酶提取鲜玉米皮所得到的AX进行分子质量(mw、mn和mw/mn)分布的测定,结果如图2及表2所示。
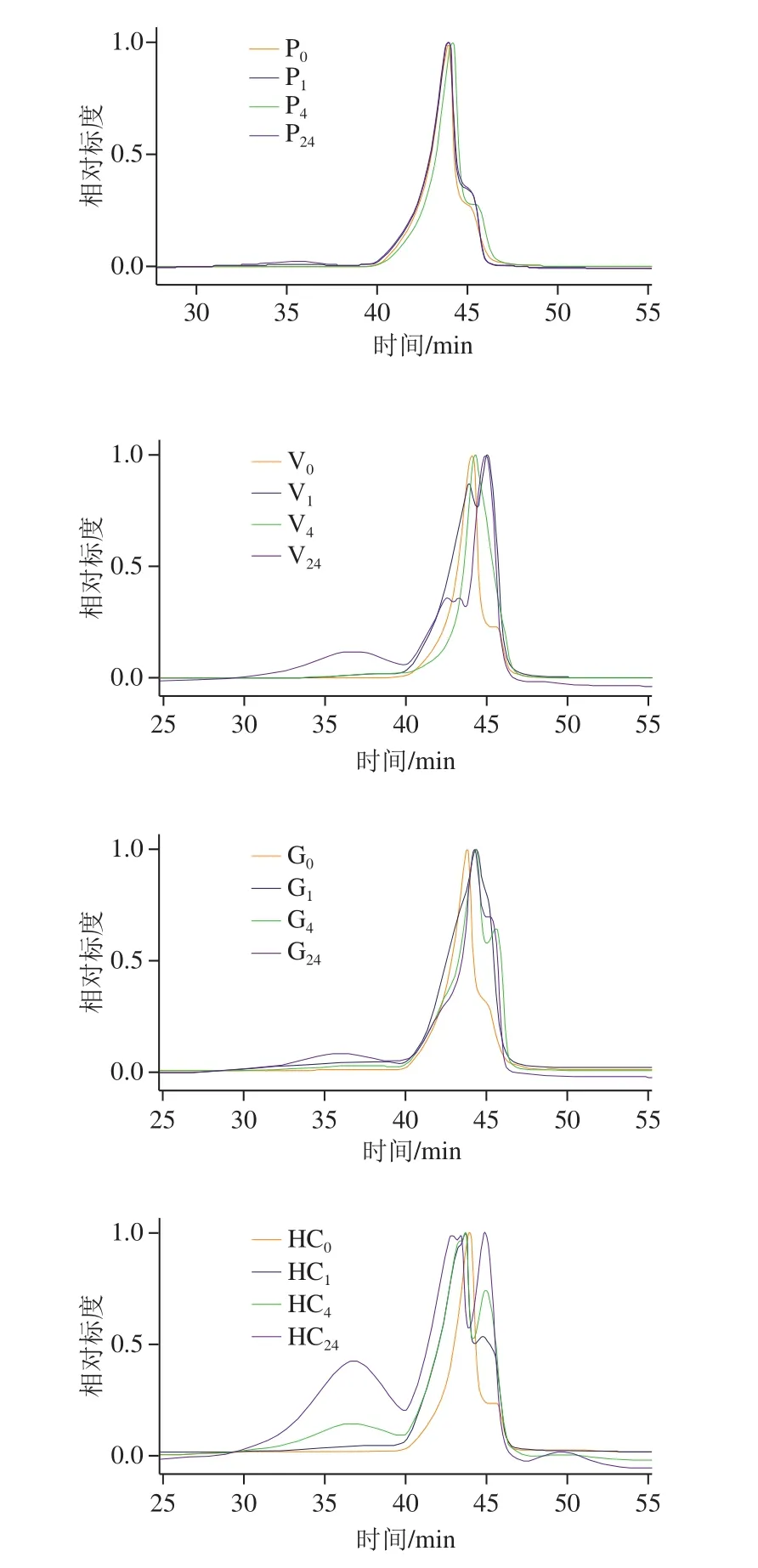
图2 玉米皮经不同种类酶提取不同时间所得AX的分子质量分布Fig. 2 HPSEC analysis of molecular mass distribution of araboxylans extracted with different xylannases
由图2可知,P、G、V及HC提取物HPSEC图谱有3 个峰,说明水解物分子质量主要有3 个分布范围。对于P,随着提取时间延长,3 个峰的高度变化很小,P提取物中各分子质量分布范围内的AX较少,这与2.1节结果一致;V随着提取时间的延长,水解物HPSEC图谱的第1个峰明显增大,说明随着提取时间的延长,玉米皮中大分子质量的AX增多;对于HC,随着提取时间的延长,提取物HPSEC图谱的第1个峰增大最为明显,表明采用HC提取得到的大分子质量的组分量最多。
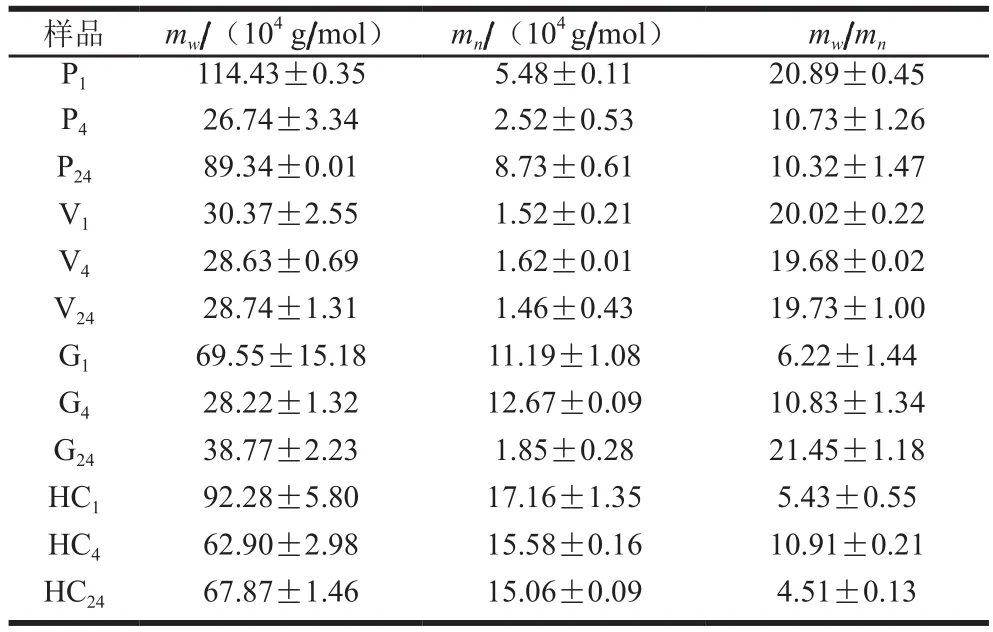
表2 不同种类酶提取玉米皮所得AX的分子质量分布Table 2 Effect of different xylannases on molecular mass distribution of araboxylan
由表2可知,在相同的提取时间,4 种食品工业中常用的木聚糖酶提取鲜玉米皮所得到AX的分子质量分布差异较大。将经酶处理与未经酶处理所得AX相比较,发现经V和G两种酶处理之后的相对分子质量分散系数显著高于未经酶处理的(P<0.01),分别为19.73±1.00和21.45±1.18,所得到的AX的mw较小,分别为(28.74±1.31)×104g/mol和(38.77±2.23)×104g/mol,说明经该酶处理之后所得AX分子质量分布不均匀,获得的高分子质量AX的种类在增加,两种酶的使用有利于低分子质量阿拉伯木聚糖的溶出;经P和HC处理之后,其相对分子质量分散系数显著低于未经酶处理的(P<0.01),分别为10.32±1.47和4.51±0.13,所得到AX的mw分别为(89.34±0.01)×104g/mol和(67.87±1.46)×104g/mol,说明其分子质量均匀程度增加,获得的低分子质量AX的种类在增加,两种酶的使用有利于高分子质量AX的溶出。由上可知,在经HC提取鲜玉米皮所得到的AX是高分子质量且分子质量分布均匀的AX。
多糖的性质与其分子质量大小、分子质量分布及其结构密切相关。过嫣丹[23]采用碱-过氧化氢法从玉米麸皮中提取AX,测得其相对分子质量为5.72×105。Buchanan等[30]采用碱法从玉米皮中提取高分子的水溶性AX,其相对分子质量在5×105以上。刘静等[29]采用碱-过氧化氢法从玉米麸皮中提取AX,在最佳提取条件下其相对分子质量为3.36×105。将本研究采用酶法提取得到的玉米皮AX的分子质量与化学法相比,其差异性与木聚糖酶的种类有关,且采用不同种类酶对玉米麸皮中AX进行提取,其分子质量分布与未加酶提取的相比较有所减小,这说明木聚糖酶将部分分子质量大的分子降解成了分子质量较小的分子,而分子质量减小程度的不同,则说明不同种类的木聚糖酶的降解能力不同。
综上,在木聚糖酶添加量相同的条件下,提取物的单糖组成及分子质量分布的差别主要受酶制剂中存在的其他酶活性如纤维素酶、β-葡聚糖酶等活性及其比例影响[21]。
2.3 Amano HC 90添加量对提取率和提取物中AX含量的影响
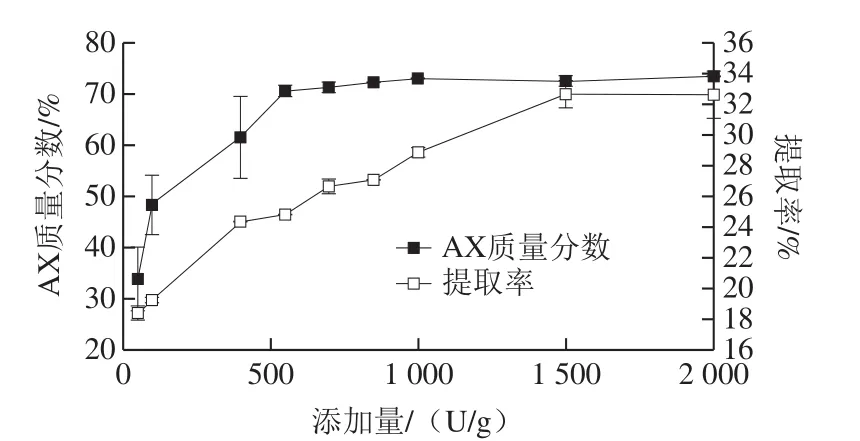
图3 Amano HC 90最适添加量对提取率和提取物中AX含量的影响Fig. 3 Effect of Amano HC 90 dosage on yield and purity of AX
从图3可以看出,随着Amano HC加酶量的增加,提取率和提取物中AX含量均增加,当加酶量增加到550 U/g时,提取物中AX含量不再增加;当加酶量增加至1 500 U/g时,提取率达到最大,此后不再增加。因此确定Amano HC的最适添加量为1 500 U/g。
3 结 论
本研究采用酶法提取玉米皮AX可得到较好的提取率和纯度,通过对4 种食品工业中常用的木聚糖酶酶解玉米皮的结果进行比较,得出结论如下:1)V的提取率最大,而HC的提取物中AX含量最高;2)采用HC提取得到的大分子质量的组分量最多,且重均分子质量和数均分子质量较大;3)Amano HC较适用于提取鲜玉米麸皮中较大分子质量的AX,其最适添加量为1 500 U/g。通过对酶法提取玉米AX的木聚糖酶进行筛选,为后期对酶法提取玉米皮AX进行工艺优化提供一定的基础。

