炒决明子主成分分析及其多肽降压活性
陈佩瑶,张月圆,王惠芸,陈祖君,王灵芝*
1.北京中医药大学 生命科学学院,北京 102488;2.中国医学科学院 阜外医院SICU,北京 100037
决明子为豆科植物决明CassiaobtusifoliaL.或小决明CassiatoraL.的干燥成熟种子,主产于浙江、安徽、广东及四川等地[1]。决明子性微寒,味咸、苦、甘,归大肠、肾、肝经;决明子具有药用、茶饮开发、养生开发价值,是中药临床和中药保健的重要药材[2]。决明子炒制品寒泻之性缓和,有平肝养肾、降血压、降血脂等功效[3]。
高血压是心血管疾病的主要危险因素之一,严重威胁着人类健康[4]。血管紧张素转化酶抑制剂(ACEI)是一线降压药物,但其不良反应明显,会引起口干、非剂量依赖性咳嗽、味觉失常、肾衰、先天性异常、低风险的血管神经性水肿甚至死亡[5],因此,寻找新型ACEI已成为近几年的热点。与ACEI相比,食源性降压肽具有安全性高,不良反应小[6-7]等特点,目前已从动植物中获得大量ACE抑制肽,Li等[8]从泥鳅蛋白水解物中获得四肽Ala-His-Leu-Leu,可使SHR(原发性高血压大鼠)血压降低22.1 mmHg。Lunow等[9]发现,鸡蛋清溶菌酶的酶解产物有很强的ACE抑制活性,获得了2个二肽Ala-Try和Try-Try,IC50分别是20、68 μmol·L-1;Jang等[10]发现,小平菇水提物能降低SHR血压50 mmHg,并从中分离到Arg-Leu-Pro-Ser-Glu-Phe-Asp-Leu-Ser-Ala-Phe-Leu-Arg-Ala和Arg-Leu-Ser-Gly-Gln-Thr-Ile-Glu-Val-Thr-Ser-Glu-Tyr-Leu-Phe-Arg-His。近据报道,薏苡仁[11]、麦芽[12]、蜈蚣[13]、醋豆[14-15]等中药中均富含ACE抑制肽。决明子为中医临床常用降压药物,决明子作为降压片主要药材收载于《卫生部药品标准》中药成方制剂第四册。《银海精微》记载:决明散主治肝肾阴亏、风热上扰、眼见黑花不散。肖伍华等[16]观察决明子临床治疗高血压病例,有效病例为92%。决明子30 g研末冲服,治疗高血压有效率达93.02%[17]。决明子蛋白质经内消化后产生的多肽组分是否具有降压活性尚未有相关报道,故本文对炒决明子蛋白质组成及其酶解物ACE抑制活性进行研究,为该药材降压肽的获得及其药效物质基础阐释提供理论依据。
1 材料
1.1 仪器
BT 224S型电子分析天平(德国Sartorius公司);FW100型高速万能粉碎机(天津市泰斯特仪器有限公司);TGL-20M型台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);DHG-9053A 型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);XW-80A漩涡混合仪(海门市其林贝尔仪器制造有限公司);KQ-300 VDE型双频数控超声波清洗器(昆山市超声仪器有限公司);SR-JX-4-13型高温电阻炉(北京市永光明医疗仪器厂);Epoch酶标仪(美国Bio-Tek公司);WXG-4型旋光仪(上海申光仪器仪表有限公司);PowerPac 3000电泳仪(美国Bio-Rad公司);TS-8脱色摇床(海门市其林贝尔仪器制造有限公司);全自动旋光仪(美国鲁道夫公司);Waters高效液相色谱仪。
1.2 试药
血管紧张素转化酶(ACE,批号9015-82-1,美国Sigma公司);马尿酰-组氨酰-亮氨酸(HHL,批号1001510772,美国Sigma公司);胃蛋白酶(批号01535535,美国Sigma公司);其他试剂均为分析纯。
炒决明子CassiatoraL.,批号17042403,产地广西,购于北京同仁堂药店,经北京中医药大学刘春生教授鉴定为豆科植物小决明子CassiatoraL.清炒制得。
2 方法
2.1 炒决明子主成分分析
根据2015版《中华人民共和国药典》,分别对炒决明子进行蛋白质含量、粗脂肪含量、水分和灰分的含量进行测定[1]。
2.1.1 蛋白质含量测定 精密称取样品,经浓硫酸消化后,在碱性条件下将铵盐转化为氨气,氨气随水蒸气蒸馏出来并被过量的硼酸溶液吸收,最后用质量浓度为0.01 mol·L-1的盐酸滴定。计算公式:
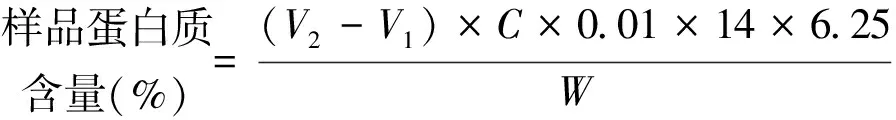
(1)
其中V2、V1分别为滴定样品和滴定空白消耗盐酸平均数(mL),C为酸标准液浓度(mol·L-1),14为氮的原子量,6.25为系数,W为样品克数。
2.1.2 粗脂肪含量测定 精密称取样品,加入已干燥至恒重的滤纸筒内,石油醚回流提取样品粗脂肪8 h后,烘干样品称质量。计算公式:
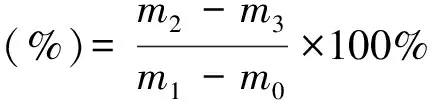
(2)
m0为滤纸筒质量,单位为克;m1为提取前样品和滤纸总质量,单位为克;m2为提取后样品和滤纸筒总质量,单位为克。
2.1.3 水分含量测定 精密称取供试品,在干燥至恒重的称量瓶中平铺均匀,精密称定后,开启瓶盖在105 ℃下干燥5 h,放冷30 min,精密称定,再于上述温度干燥1 h,再次放冷和称质量。根据减失的质量,计算供试品的含水量(%)。
2.1.4 灰分测定 精密称取供试品,置炽灼至恒重的坩埚中,称定质量,缓缓炽热,至完全碳化时,逐渐升高温度至500~600 ℃,使完全灰化并至恒质量,根据残渣质量,计算供试品总灰分含量。
2.1.5 淀粉含量测定 精密称取(2.5±0.05)g(m1)待测样品,用稀盐酸水解,在澄清和过滤后用旋光法测定总旋光度α1[18]。精密称取(5±0.1)g(m2)待测样品,用体积分数为40%的乙醇溶液萃取出可溶性糖和相对分子量低的多糖,滤液处理同上,测定旋光度值α2。两种方法测量结果的差值,乘以系数,即为样品的淀粉含量。计算公式:
(3)
α1为样品总旋光度值,单位为度;α2为样品中醇溶物质旋光度值,单位为度;m1为总测定样品的质量,单位为克;m2为醇溶测定样品的质量,单位为克;w1为测定样品中干物质的质量分数;300为豆类淀粉在589.3 nm波长测得的比旋度,单位为度。
2.2 决明子蛋白质的提取
2.2.1 总蛋白的提取 炒决明子粉碎后过40目筛子,石油醚脱脂,真空干燥,采用50 mmol·L-1KH2PO4-NaOH(pH=8.0)缓冲液抽提蛋白,固液比1∶10(w∶v),4 ℃磁力搅拌10 h,5000 r·min-1离心10 min,取上清液,加入硫酸铵至55%饱和度,离心收集沉淀,缓冲液溶解蛋白沉淀,双蒸水低温透析(截留分子量3.5 KDa)24 h,期间换水数次,冷冻干燥后备用[19]。Bicinchoninic acid(BCA)法[20]测定蛋白含量。
2.2.2 决明子蛋白质组分的抽提 采用顺序抽提法提取决明子清蛋白、球蛋白、醇溶蛋白和谷蛋白[21]。炒决明子经粉碎机粉碎后过40目筛,脱脂,依次采用双蒸水、0.5 mol·L-1氯化钠溶液、70%乙醇溶液(0.5%乙酸钠)、0.012 5 mol·L-1硼酸钠缓冲液(1%十二烷基硫酸钠、2%β-巯基乙醇)振荡抽提60 min,10 000 r·min-1离心15 min,重复2次,分别提取清、球、醇溶及谷蛋白组分。双蒸水低温透析24 h(截留分子量3.5 KDa),期间换水数次,然后冷冻干燥备用。
2.3 SDS-PAGE
采用垂直板不连续体系[22],将样品溶液与上样缓冲液混合,100 ℃变性5 min,冰浴10 min,取适量样品上样。设置浓缩胶恒定电压60 V,分离胶恒定电压120 V。考马斯亮蓝R-250染色3 h,置脱色液(水∶95%乙醇∶冰醋酸=17∶2∶1)中室温脱色,直至蛋白条带清晰,背景干净。
2.4 决明子小分子量多肽的制备
采用蛋白酶水解法制备决明子小分子多肽组分[23]。精确称取炒决明子原药材粉末、清、球、醇溶和谷蛋白冻干粉及蛋白提取残渣用胃蛋白酶水解,水解条件为:底物浓度2%,酶与底物浓度比1∶10,pH=2.0,温度37 ℃,时间48 h。水解后将样品95 ℃变性5 min,冰浴10 min,再经8000 r·min-14 ℃离心10 min,取上清液备用。
将备用的上清液转移至超滤管(截留分子量3 KD)5000 r·min-14 ℃离心30 min,收集滤过液,制备小分子肽(≤3 KD)[11,24],冷冻干燥后备用。采用Lowry法测定多肽浓度[25]
2.5 ACE抑制活性的测定
采用高效液相色谱法进行样品ACE抑制活性测定[23]。用硼酸缓冲液(0.1 mol·L-1硼酸,0.3 mol·L-1NaCl,pH=8.3)溶解样品。反应体系为:样品溶液10 μL、ACE(2 mU)20 μL和HHL(2 mM))20 μL。
采用C18色谱柱(250 mm×4.6 mm,5 μm,TIANHE)分析样品。洗脱条件:流动相A∶流动相B=25∶75[A:乙腈,B:超纯水(含0.05% TFA,v/v)],液相流速为1 mL·min-1,柱温箱的柱温为30 ℃,样品的进样量为10 μL,检测器于228 nm下进行检测,根据HA峰面积计算ACE抑制率。
ACE抑制率(%)=(A-B)/A×100%
(4)
A为空白对照组的HA峰面积,B为样品组的HA峰面积。
3 结果
3.1 决明子主要成分分析
决明子主要成分含量如下。淀粉含量最高,占总质量的(46.44±0.66)%,蛋白质含量为(22.08±0.04)%,粗脂肪为(14.07±0.14)%,水分和灰分含量分别为(6.67±0.06)%和(5.45±0.04)%,符合2015版《中华人民共和国药典》相关规定。
3.2 炒决明子蛋白组成分析
采用BCA法对水溶性总蛋白含量进行测定。水溶性蛋白占总蛋白含量的(4.52±0.17)%,含量较低。故采用顺序抽提法提取蛋白进行蛋白组分的分析。
采用凯氏定氮法对决明子清蛋白、球蛋白、醇溶蛋白、谷蛋白组分进行含量测定,结果见表1。清蛋白占总蛋白含量的(14.55±0.01)%,球蛋白占(14.87±0.03)%,醇溶蛋白和谷蛋白分别占(2.67±0.01)%和(21.04±0.03)%,残渣中仍剩余46.89%蛋白质。
四类蛋白组分经SDS-PAGE凝胶电泳后,得到的电泳图谱见图1。清蛋白条带丰富,主要分布在14、24、30、58 KD;球蛋白条带主要分布在14、20、30、40~50 KD;谷蛋白条带在24、30、62、100 KD均有分布。醇溶蛋白由于含量低,未检测出明显条带。
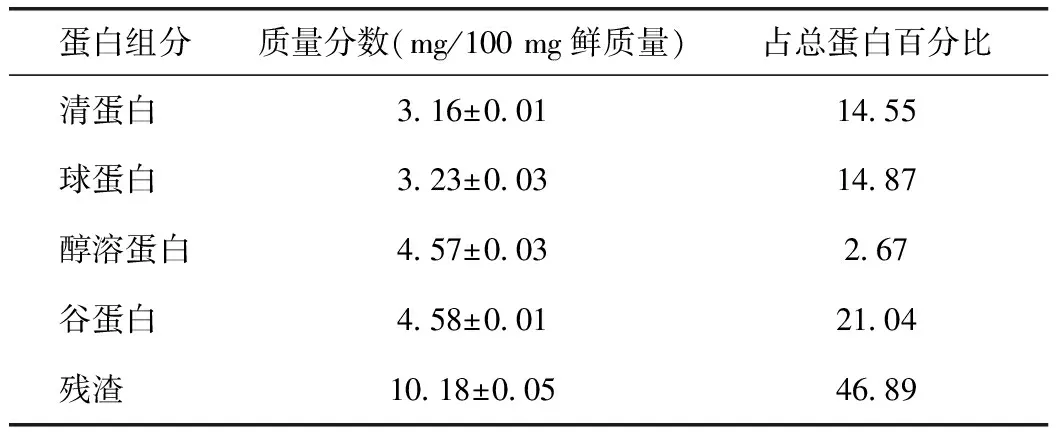
表1 炒决明子蛋白质组分分布 %

注:1.球蛋白;2.清蛋白;3.标准分子量;4.谷蛋白;5.醇溶蛋白。图1 炒决明子蛋白组分SDS-PAGE图谱
3.3 决明子小分子肽ACE抑制活性分析
采用高效液相法测定各蛋白源多肽组分的ACE抑制活性,见图2~3。图2a为对照品HHL的色谱图,保留时间为11.0 min。空白对照组(硼酸缓冲液)没有ACE抑制活性(见图2b);清、球、醇溶蛋白及谷蛋白酶解产物(3 KD,0.01 mg·mL-1)具有不同程度的ACE抑制活性。球蛋白酶解物的ACE抑制率为(38.44±1.54)%(见图2c),活性最高。清蛋白酶解物和醇溶蛋白酶解物的抑制率分别为(29.39±1.60)%(见图2e)和(30.48±1.91)%(见图2f),谷蛋白酶解物抑制率为(4.30±0.86)%(见图2g)。阳性药卡托普利(2×10-9mol·L-1)的抑制率为(46.47±1.08)%(见图2d)。残渣因含有大量硬蛋白,水解物所得ACE抑制率为(17.59±2.70)%。
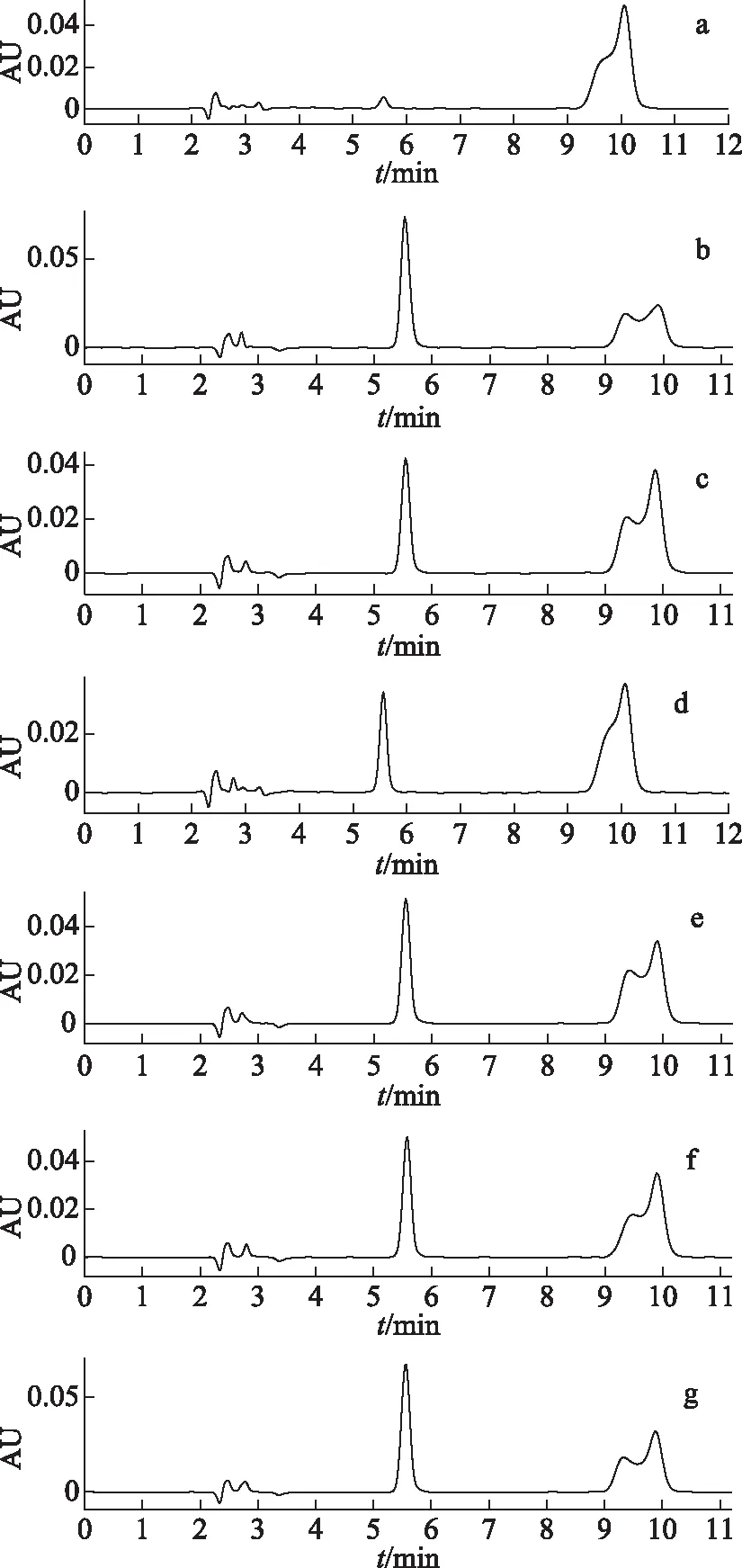
注:a.HHL;b.空白;c.球蛋白源小分子肽;d.卡托普利;e.清蛋白源小分子肽;f.醇溶蛋白源小分子肽;g.谷蛋白源小分子肽。图2 样品的RP-HPLC图

注:*代表不同样品间差异有统计学意义;*#代表该两组样品与只标*的其他样品的差异有统计学意义,标有*#两组样品间差异无统计学意义(P<0.05)。图3 各多肽组分ACE抑制率
4 讨论
决明子中水溶性和脂溶性苷类化合物具有降低SD大鼠血压和心率作用,且其功能的发挥与随体网状结构有关[26-27]。决明子水提物具有降低DBA/2J青光眼大鼠眼内压的作用,同时前房水乳酸脱氢酶水平降低[28]。李续娥等[29]报道,决明子蛋白质可显著降低血压,降压效果与决明子低聚糖、蒽醌苷和复方利血平无显著差异,然而持续性不如后两者。本研究通过顺序抽提法依次提取决明子四类蛋白组分,进而采用胃蛋白酶法获得小分子肽,结果表明,球蛋白酶解产物具有良好的ACE抑制活性。后续将采用不同的色谱方法对其进一步分离纯化,有望从中获得高效中药源降压药物,也为该药的临床用药提供了新的理论指导。

