稻米陈化中谷蛋白变化光谱解析及其对功能性质的影响
宁俊帆,郭玉宝,宋 睿,朱世民,董 鹏
安徽工程大学生物与食品工程学院,安徽 芜湖 241000
引 言
稻谷收获后即开始陈化,胚乳发生一系列理化和生化变化,导致颜色、气味、糊化特性及微观结构的改变[1],使食用品质劣变。在颜色上,陈米的胚乳表面整体光泽度下降,呈灰粉状且有白色沟纹,部分米粒边缘发黄甚至有咖啡色;在气味上,陈米会出现霉味和酸味等异味;在质构方面,陈米组织硬化,韧性低,质感脆,结构松散,按压易碎。陈米由于结构变得紧密,糊化中水分难以渗入,造成糊化时间延长且米饭黏性下降[2]。即使颜色和气味不变,糊化特性也会发生劣变。越来越多的研究表明,蛋白质的变化与糊化特性变化密切相关,但是蛋白质的氧化变化光谱表征较少。
研究表明,大米陈化后巯基氧化成二硫键,谷蛋白平均分子量增加[3]。陈化后清蛋白中α-螺旋减少,脂肪族氨基酸侧链被包埋;球蛋白与淀粉相互作用加强,谷蛋白与淀粉的结合减弱;醇溶蛋白反平行-β折叠结构增加,二硫键构型改变,酪氨酸残基更加暴露[4]。吴伟等[5]研究发现,米糠中游离脂肪酸氧化形成活性脂氧化物,导致谷蛋白氧化和功能性质改变。现有文献对大米陈化后谷蛋白结构变化的研究多集中在电泳表征分子量[6],巯基变化表征二硫键氧化[7],荧光光谱表征芳香族氨基酸残基微环境的变化[8]及红外光谱和圆二色光谱表征二级结构[9],对谷蛋白巯基氧化产物的表征研究较少。分子量的表征主要是通过电泳法,蛋白质常被加热变性,因此不能确定蛋白质的变性是在陈化期间发生,还是在电泳实验变性处理时发生的。已有报道缺乏对谷蛋白单独陈化产生的结构变化及其对功能性质的影响研究,特别是对与空气接触的富含蛋白的米粒外层中谷蛋白的结构变化研究未见报道。
米粒中蛋白分布不均,米粒外层蛋白含量高于胚乳内部,且大米陈化中米粒外层暴露于空气中,未见米粒外层中谷蛋白的拉曼和红外光谱研究。本实验选用富含蛋白的米粒外层米粉作为原料,采用Osborne法[10]顺序提取获得谷蛋白,表征谷蛋白在陈化前后的结构变化和功能性质变化[11],为阐明蛋白质在稻米陈化中的作用,控制陈化以减少粮食产后损失奠定基础。
1 实验部分
1.1 材料和试剂
大米,购于苏果超市,初始含水量14.08%±0.07%。
花生油,益海嘉里粮油股份有限公司;牛血清白蛋白(BR)、磷酸氢二钠、氢氧化钠、盐酸、十二烷基硫酸钠(SDS):分析纯,国药集团上海化学试剂有限公司;溴化钾:光谱纯,Merck KGaA Millipore Corporation。
1.2 仪器
稻谷精米检测机(JGMJ8090),上海嘉定粮油仪器有限公司;高速万能粉碎机(FW-100),天津泰斯特仪器有限公司;红外光谱分析仪(FT-IR200),美国Nicolet公司;激光共聚焦显微拉曼光谱仪(HR-800型),法国Jobin-Yvon公司;紫外分光光度计(UV-5800C),上海元析仪器有限公司;离心机(L-550),湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 大米储藏陈化及谷蛋白提取和陈化
大米储藏陈化:将新鲜大米分成两份,分别装入广口瓶中密封,一份在4 ℃下贮存保鲜,作为对照;另一份放置在37 ℃恒温培养箱中储藏12个月,获得陈米[12]。利用稻谷精米机对大米进行剥蚀碾磨,收集米粒外层15%米粉,过40目筛,装入自封口袋中在4 ℃下贮存备用。
谷蛋白提取[10]:称取40 g米粉,加160 mL正己烷在25 ℃脱脂1 h,抽滤,沉淀在室温挥发24 h,得脱脂米粉。取40 g脱脂米粉,先用蒸馏水和5% NaCl脱除清蛋白和球蛋白后,再用160 mL 0.1 mol·L-1的NaOH提取谷蛋白1 h,4 000 r·min-1离心10 min,取上清液重复提取1次。合并两次上清液静置6 h,4 000 r·min-1离心10 min,上清液先用1.0 mol·L-1的HCl调pH至6.0,再用0.1 mol·L-1HCl调pH至4.8,等电沉淀谷蛋白。静置沉淀6 h后,4 000 r·min-1离心10 min;沉淀用两倍蒸馏水洗涤,离心。洗涤后的沉淀用0.1 mol·L-1的NaOH调pH至7.0,离心,沉淀用2倍蒸馏水洗涤两次。所得沉淀冻干,得谷蛋白。分别以新米和陈米作为原料,通过上述方法获得新米谷蛋白和陈米谷蛋白。
新米谷蛋白的陈化:将上述新米谷蛋白分成两份,一份在37 ℃下储藏12个月(模拟大米储藏陈化条件),获得经陈化的新米谷蛋白(陈化谷蛋白);另一份在4 ℃下保存备用。
1.3.2 谷蛋白拉曼光谱分析
谷蛋白的拉曼光谱分析参照Guo[4]的方法,测定条件:激光波长514.5 nm,功率20 mW,到达样品的光斑直径约1 μm。测前,激光波长在520.7 nm处以单晶硅校正。扫描时间60 s,扫描波数范围200~4 000 cm-1,分辨率2 cm-1, 样品扫描速度120 cm-1·min-1,每1 cm-1记录数据。50×长焦镜头(LMP),在背散射方向收集拉曼信号,至少3个不同的样品点被测试并记录。所获得数据采用Omnic 8.0软件进行基线校正、平滑(nine-point Golay-Savitzky procedure)。因实际获得的拉曼光谱强度不仅与物质含量有关,还受到激光器强度、拉曼探头与样品相对距离、光纤传输效率、检测器量子效率等其他因素的影响。即使利用高性能拉曼光谱仪,并严格控制测试条件,也不能保证同一样品的拉曼强度在平行测定中不产生差异。因此以苯丙氨酸峰为基准进行归一化处理进行强度校正[4, 13]。
1.3.3 谷蛋白红外光谱分析
红外光谱分析采用溴化钾压片法[4]:将蛋白粉末与干燥的溴化钾按1∶100混合后研磨至足够细,在压片机上以10 T·cm-2压片,直至得到的压片均匀无裂痕呈半透明状。在红外光谱仪上扫描,波数400~4 000 cm-1,分辨率2 cm-1,扫描512次获得叠加谱,试验重复3次,谱图用Omnic 8.0分析。
1.3.4 谷蛋白功能性质的测定
(1)溶解性的测定
根据文献[14]:取4支试管,各称取0.010 g谷蛋白样品,分别加入pH值3,5,7和9的10 mmol·L-1PBS缓冲液1 mL,涡旋振荡3次,每次3 s,得到不同pH值下的1%蛋白悬液。将蛋白悬液于5 000 r·min-1下离心10 min,取上清液用考马斯亮蓝法测定蛋白质含量,用牛血清白蛋白作标准曲线。
(2)持水性和持油性的测定
参照文献[15],采用重量法测定:称取0.100 g谷蛋白样品于预先恒重的离心管m1中,加入5 mL蒸馏水(花生油),涡旋振荡3次,每次3 s,在40 ℃恒温水浴中保温30 min。将混合物在4 000 r·min-1下离心10 min,倾去上清液,称取离心管质量m2。通过公式:持水性(持油性)(mL·g-1)=(m2-m1-0.100)/0.100,计算样品的持水性和持油性。
(3)乳化性和乳化稳定性的测定
参照文献[5]用浊度法:称取0.015 g样品,分散于15 mL pH 7.4的10 mmol·L-1的PBS缓冲液中,得到1 mg·mL-1谷蛋白悬液,加入5 mL花生油,用高速分散均质机以10 000 r·min-1的速度均质2 min。立刻取出20 μL谷蛋白-花生油乳状液与5 mL 0.1% SDS溶液混合均匀,以0.1% SDS为空白,在500 nm处测定吸光度(记为A0)。剩下的谷蛋白-花生油乳状液静置30 min后,以同样的方法测定吸光度(记为A30)。则:乳化性(m2·g-1)=(2×2.303A0N)/(c×φ×10 000),乳化稳定性(min)=A0/(A0-A30)×30,其中N为稀释倍数取250(20 μL蛋白-花生油乳状液与5 mL 0.1% SDS混匀),c为蛋白质质量浓度(1 mg·mL-1),φ为油相所占的体积分数(0.25)。
(4)起泡性和泡沫稳定性的测定
参照文献[5]:取5个50 mL烧杯,各称取0.100 g谷蛋白;向烧杯中分别加入pH值为3,5,7,9和11的0.05 mol·L-1PBS缓冲液各10 mL,得到不同pH值下1%蛋白分散液,用高速分散均质机以10 000 r·min-1的速度均质30 s,连续4次共2 min,均质后的泡沫体积记为V0;静置30 min后再次记录泡沫体积V30。则:起泡性=(V0-10)/10×100%,泡沫稳定性=(V30-10)/(V0-10)×100%。
1.3.5 数据处理
数据采用SAS 8.01进行单因素方差分析及邓肯多重比较[16](Duncan’s Multiple Range Test),p<0.05。
2 结果与讨论
2.1 谷蛋白陈化变化的拉曼光谱分析
拉曼光谱适合研究同原子间形成的非极性键,能表现出氨基酸侧链所处微环境的变化,从而为蛋白质高级结构的变化提供信息。新米谷蛋白、陈米谷蛋白和陈化谷蛋白的拉曼光谱见图1,拉曼频率、官能团指认和归一化强度见表1。
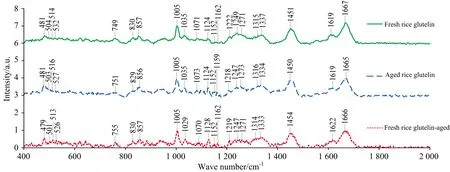
图1 陈化后谷蛋白拉曼光谱变化

表1 谷蛋白拉曼光谱特征峰指认
由表1可以看出,陈米谷蛋白和陈化谷蛋白在1 665/1 666 cm-1与1 218/1 219 cm-1处的拉曼光谱强度明显低于新米谷蛋白,此两峰分别归属于酰胺Ⅰ和酰胺Ⅲ带,说明陈米谷蛋白和陈化谷蛋白中α-螺旋明显减少[17]。在516,527,1 035,1 124,1 152,1 159,1 316和1 334 cm-1处,陈米谷蛋白和陈化谷蛋白的峰强度明显高于新米谷蛋白,这归属于含硫氨基酸残基的氧化产物——二硫键、亚砜和砜,表明陈化后谷蛋白中巯基发生氧化[17-18]。481,1 451和2 936 cm-1峰均归属C—H键,陈化前后谷蛋白峰的拉曼强度变化不明显。857/830 cm-1为酪氨酸的Fermi共振,陈化后谷蛋白峰的强度比明显增大,说明谷蛋白中酪氨酸残基更加暴露[17, 19]。749/751/755 cm-1为色氨酸吲哚环的拉曼峰位,陈化后强度提高说明谷蛋白色氨酸残基被埋藏[17-18]。O—H伸缩峰3 423 cm-1在陈化后显著增强,说明分子间键合程度升高,谷蛋白与淀粉分子结合更紧密[19]。实验结果,不管是陈米中的谷蛋白,还是新米谷蛋白被提取出来后再陈化,α-螺旋结构均明显减少,含硫氨基酸氧化,酪氨酸残基更深度暴露,色氨酸残基更深度埋藏,谷蛋白与淀粉分子之间结合更为紧密。这些拉曼光谱特征,有力地说明了陈化后谷蛋白含硫氨基酸氧化形成二硫键、亚砜和砜的存在,以及陈化谷蛋白比陈米谷蛋白氧化程度更高,为稻米陈化劣变中谷蛋白的氧化提供了光谱学依据。
2.2 谷蛋白陈化变化的红外光谱分析
红外光谱反映分子振动-转动能级,与振动过程中分子偶极矩的变化相关,反映分子内部的微观结构,可进一步说明蛋白质结构的变化。从图2和表2可以看出,陈米谷蛋白在1 153,1 078和1 026 cm-1处的吸收峰明显增强。1 153 cm-1为砜的特征吸收,1 078和1 027 cm-1为亚砜的特征吸收[20]。三处均表征含硫的氧化产物,说明陈化引起了含硫氨基酸残基的氧化,包括巯基氧化成二硫键、亚砜和砜等。谷蛋白在931 cm-1附近出现了较弱的吸收,此为糖环骨架的特征吸收峰[20],陈米谷蛋白的此吸收峰强度比新米谷蛋白大,表明陈化后谷蛋白存在糖基化趋势,与淀粉分子的结合更加紧密,可能影响了陈米的糊化特性[21]。
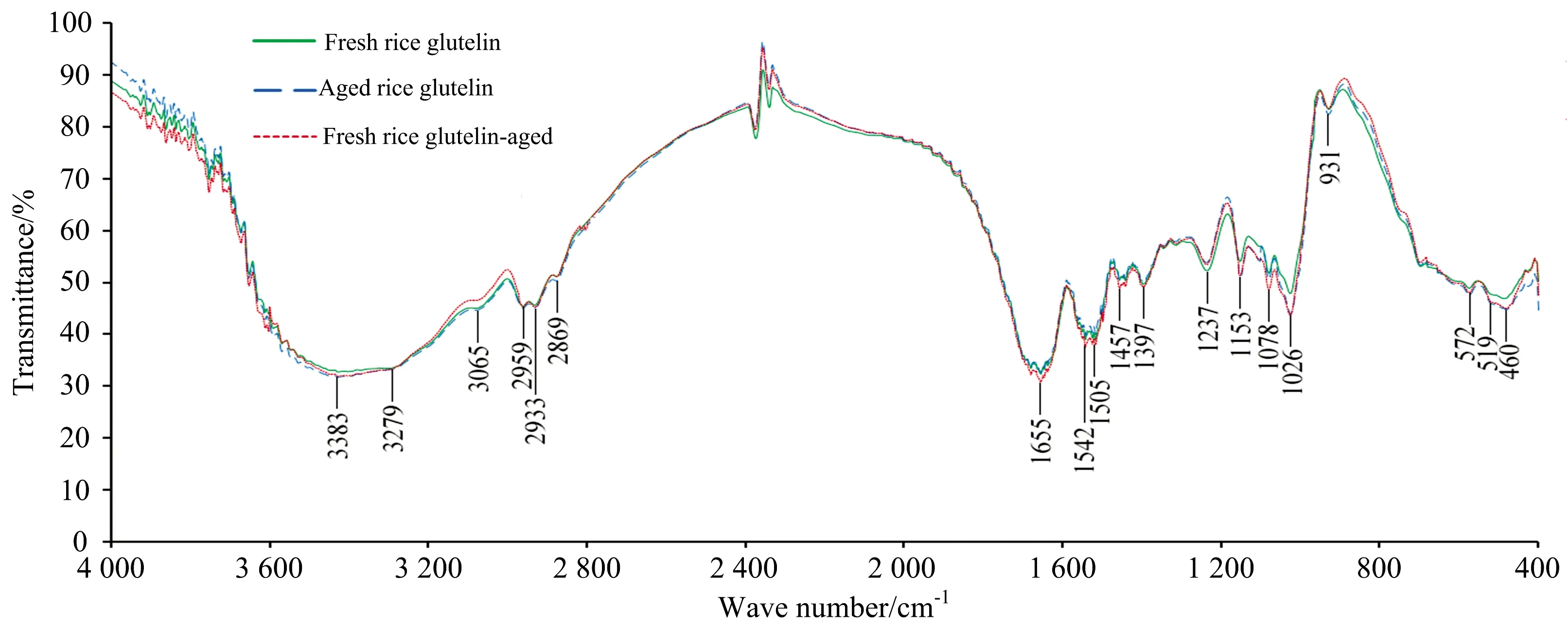
图2 陈化后谷蛋白红外光谱变化
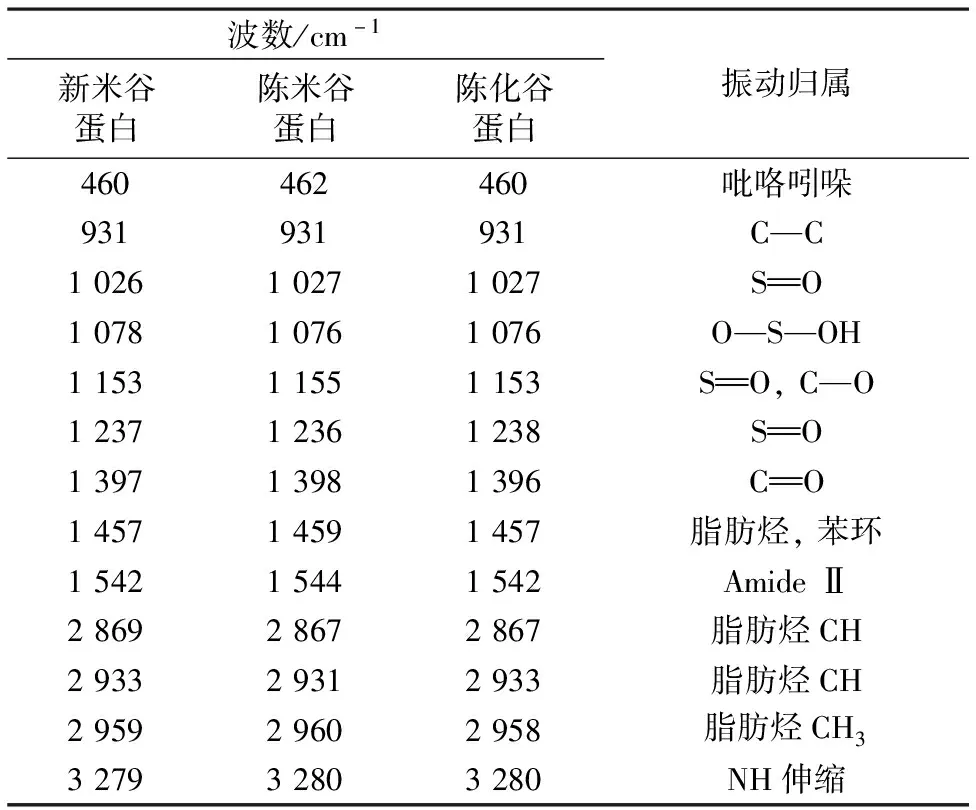
表2 谷蛋白红外特征频率及归属
2.3 陈化对谷蛋白功能性质的影响
2.3.1 陈化对谷蛋白溶解性的影响
由图3可知,不同pH值下,陈米谷蛋白的溶解性均明显低于新米谷蛋白,且在pH 3时差异最大。陈化谷蛋白的溶解性仅在pH 3时低于陈米谷蛋白,而在其他pH值下高于陈米谷蛋白,且在pH 9时比新米谷蛋白更高。这些结果说明,陈化使得谷蛋白的溶解性降低,在酸性条件下尤为明显,这可能与光谱分析中所示谷蛋白氧化有关。陈化使更多的疏水基团暴露,降低了蛋白质溶解性。
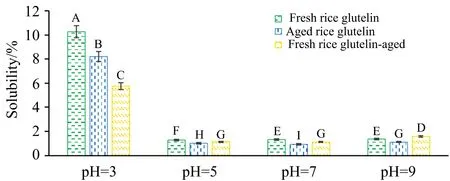
图3 陈化对谷蛋白溶解性的影响
2.3.2 陈化对谷蛋白持水性和持油性的影响
由图4(a)可知,新米谷蛋白的持水性最高,其次是陈米谷蛋白,陈化谷蛋白的持水性最低。而持油性变化趋势与持水性正相反[图4(b)],新米谷蛋白的持油性最低,陈米谷蛋白其次,陈化谷蛋白的持油性最高。实验结果表明谷蛋白的陈化降低了持水性,提高了持油性,这一变化支持光谱解析中谷蛋白陈化后疏水基暴露的结果。新米谷蛋白被提取出来后单独陈化的变化更明显,表明淀粉对谷蛋白陈化有一定缓解作用。
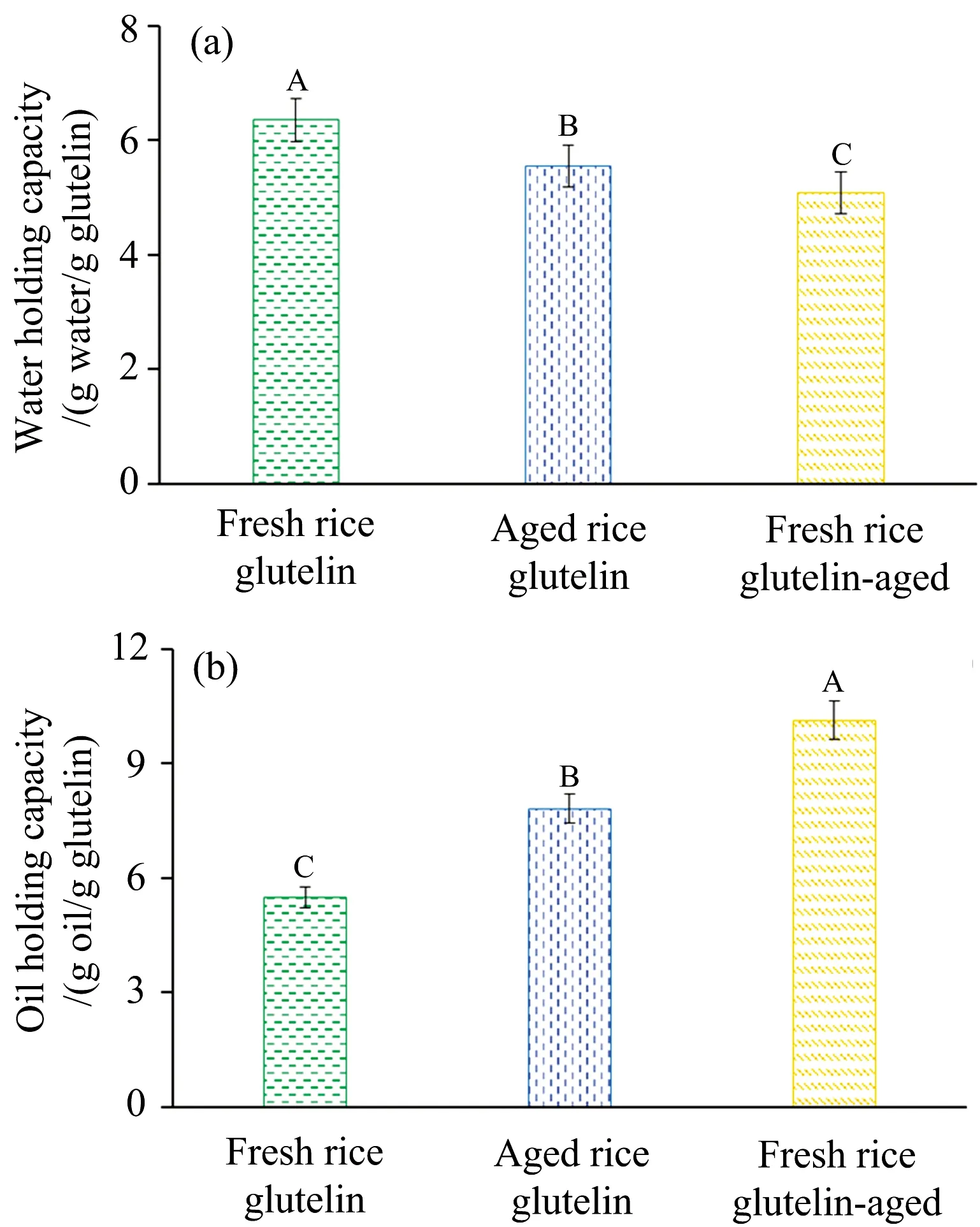
图4 陈化对谷蛋白持水性(a)和持油性(b)的影响
2.3.3 陈化对谷蛋白乳化性和乳化稳定性影响
由图5(a)可见,新米谷蛋白、陈米谷蛋白和陈化谷蛋白乳化性依次显著降低;新米谷蛋白的乳化稳定性最高,陈米谷蛋白和陈化谷蛋白乳化稳定性明显降低,但二者间差异不明显[图5(b)]。乳化性降低与蛋白质溶解性降低密切相关,陈化使蛋白质氧化程度加深,疏水基更加暴露,溶解性下降。
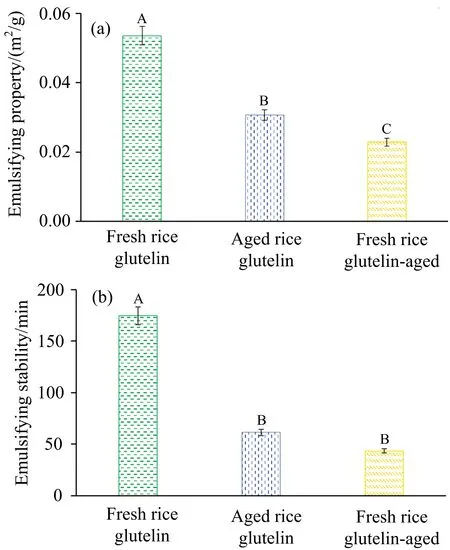
图5 陈化对谷蛋白乳化性(a)和乳化稳定性(b)的影响
2.3.4 陈化对谷蛋白起泡性和泡沫稳定性影响
由图6可见,在pH 3和pH 11时,新米谷蛋白、陈米谷蛋白和陈化谷蛋白起泡性依次显著降低;在其他pH下也呈下降趋势,但变化不显著。起泡性是蛋白质分散于界面成薄的能力,起泡性降低,说明其分散能力下降,显示了陈化导致的蛋白质氧化引起的溶解性降低。由图7可知,在各pH值下,泡沫稳定性变化不明显,说明谷蛋白的陈化变化对泡沫稳定性影响不显著。
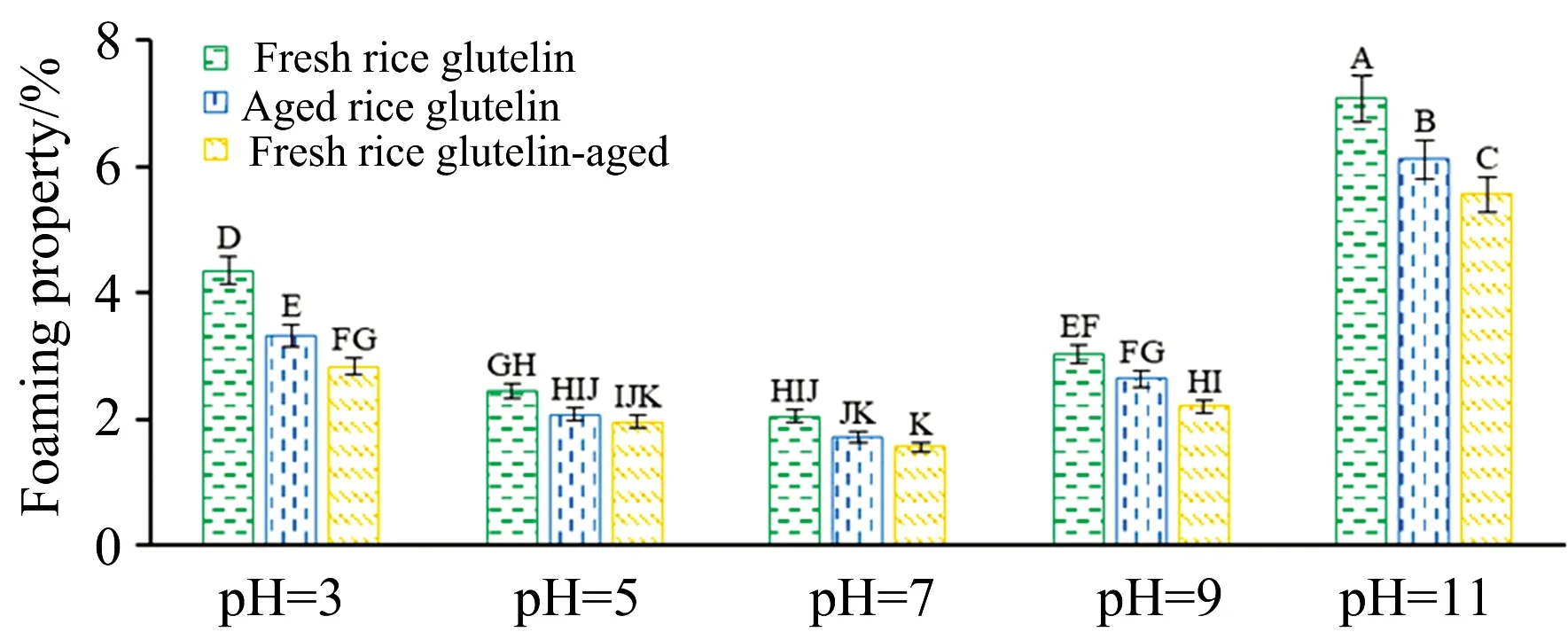
图6 陈化对谷蛋白起泡性的影响

图7 陈化对谷蛋白泡沫稳定性的影响
3 结 论
比较了新米谷蛋白、陈米谷蛋白和陈化谷蛋白的拉曼和红外光谱及三种谷蛋白功能性质变化,发现陈米谷蛋白和陈化谷蛋白比新米谷蛋白的α-螺旋减少,含硫氨基酸残基氧化产物增多,酪氨酸残基更加暴露,色氨酸残基更加埋藏,分子间结合程度更高,说明陈化中谷蛋白发生了氧化,并体现在蛋白功能性质变化上。陈米谷蛋白溶解性、持水性、乳化性和乳化稳定性均比新米谷蛋白低,而持油性比新米谷蛋白高,支持谷蛋白在陈化中发生的氧化变化。陈化谷蛋白溶解性(除pH 9)、持水性和乳化性比陈米谷蛋白更低,持油性更高,说明提取出来的新米谷蛋白单独陈化氧化程度更深。可见,通过拉曼和红外光谱能很好地表征大米陈化过程中米粒外层中谷蛋白的氧化,与蛋白功能性质的变化相一致,说明了稻米陈化劣变的内在原因,这为控制稻米陈化劣变、减少产后损失提供了依据。

