miR-203和ZEB2直接相互作用逆转胃癌细胞顺铂耐药性的作用研究
王彩玲,王俊生,候新芳,周 静,阚随随
0 引言
胃癌是我国发病率和死亡率比较高的消化系统恶性肿瘤之一,根治性手术是唯一有治愈可能的措施[1]。胃癌细胞属于对化疗药物相对敏感的一类恶性肿瘤细胞,含铂类化疗方案是目前临床使用最为广泛的标准方案之一,但是仍有部分患者会发生继发性耐药[2]。针对目前胃癌的治疗现状,筛选出具有耐药风险的高危患者,增强和重建胃癌细胞对化疗药物的敏感性,提高化疗疗效,改善患者预后,是胃癌治疗领域一直关注的热点。化疗耐药机制极为复杂,与上皮细胞-间充质转化(Epithelial-mesenchymal transition,EMT)[3]的关系研究一直是肿瘤领域的热点话题。有研究证实,发生EMT的细胞表现出较强的化疗药物抗性,这可能与某些信号通路的异常活化有关,促使EMT转录因子表达上调,从而促使肿瘤细胞发生EMT,产生耐药性[4]。E盒结合锌指蛋白(Zinc-finger E-box-binding protein 2,ZEB2)属于锌指转录因子Snail超家族成员之一,通过抑制细胞角蛋白、E-cadherin等因子的转录,促进EMT的发生[5]。此外,miRNAs也是参与调控肿瘤细胞耐药性的重要因子[6],有望成为精准医疗时代下恶性肿瘤的诊断和干预靶点。鉴于miRNA的内源性、保守型、稳定性特点,其无疑是化疗疗效预测的潜在良好指标,亦是逆转化疗耐药的有效靶点。因此,本项研究通过建立顺铂(Cisplatin,DDP)耐药性SGC7901细胞株模型,拟探讨miR-203和ZEB2的相互调控作用以及对胃癌耐药性细胞株的影响,从而为逆转胃癌细胞顺铂耐药性的研究提供新的突破口。
1 材料与方法
1.1 受试细胞来源和培养 人胃癌顺铂耐药细胞株SGC7901/DDP及其亲本非耐药的胃癌细胞株SGC7901购自中国科学院上海细胞库。将细胞株接种至含有10%胎牛血清、100 U/ml青霉素-链霉素双抗的RPMI1640培养基中,置于37 ℃、5% CO2细胞培养箱中进行培养。0.25%胰蛋白酶溶液消化传代,2~3 d传代1次。
1.2 主要试剂 注射用顺铂购自山东齐鲁制药,用前用生理盐水倍比稀释至实验浓度;RPMI1640细胞培养基、胰蛋白酶-EDTA细胞消化液(0.25%)(美国Gibco公司);胎牛血清(FBS)和链霉素-青霉素双抗(美国Thermo Fisher公司);噻唑蓝(monotetrazolium,MTT)、Trizol试剂、细胞转染试剂LipofectamineTM2000、Opti-MEM、SuperScript RT kit(美国Invitrogen公司);mirPremier®microRNA Isolation Kit购自日本Takara公司;SYBR DDPeen PCR master Mix(美国Applied Biosystems公司);Annexin V-FITC细胞凋亡试剂盒(上海碧云天生物技术研究所);双荧光素酶报告基因载体pisCHECK-2(美国Promega公司);上皮型钙黏附素(Epithelial cadherin,E-cadherin)抗体、Snail抗体(美国Abcam公司);ZEB2多克隆抗体(美国Cell Signaling Technology公司);实验用水为超纯水,其他试剂均为国产分析纯。miR-203模拟物(mimics)及阴性对照(NC)序列购自上海吉玛制药技术有限公司;ZEB2 siRNA及阴性对照(si-NC)由上海吉凯基因化学有限公司合成。PCR引物自行设计,并由上海吉凯基因化学有限公司合成。
1.3 细胞转染和分组 取对数期生长的SGC-7901/DDP细胞,培养在6孔板中,根据LipofectamineTM2000转染试剂盒说明书,将miR-203 mimics和无关系列转染至SGC-7901/DDP细胞中,置于荧光倒置显微镜下观察荧光染色,以判断感染率。提取细胞RNA,验证miR-203表达情况及转染效率。转染成功后用1 μg/ml嘌呤霉素筛选2~3周,耐嘌呤霉素的细胞用于后续实验。细胞分组:SGC-7901组、SGC-7901/DDP组、miR-203mimics转染组(miR-203组)和阴性对照组(NC组)。采用同样的转染方法将si-ZEB2和si-NC序列转染至SGC-7901/DDP细胞,将细胞分为si-ZEB2组和阴性对照组(si-NC组)。
1.4 细胞活力测定(MTT法) 将对数期生长的SGC-7901细胞或SGC-7901/DDP细胞(1×104个/孔)单层接种至96孔板中,每组设置8个平行孔,分别加5、10、20、40、80、160 μmol/L(终浓度)DDP,培养48 h后,加入MTT,孵育4 h后,置于450酶标仪上,检测波长为570 nm处的吸光光度值(OD值),计算细胞增殖抑制率:增殖抑制率(%)=1-OD值受试组/OD值对照组×100%。计算半数抑制浓度(50% inhibition concentration,IC50)以及SGC-7901/DDP细胞的耐药指数(Resistance index,RI)。RI=IC50(SGC-7901/DDP)/IC50(SGC-7901)。实验重复3次,取平均值。
1.5 Annexin V/PI双染法检测细胞凋亡 收集对数期生长的细胞,洗涤3次后,3 000 r/min离心5 min,离心半径10 cm,弃上清;加入500 μl Binding Buffer重悬,加入Annexin V 5 μl,避光孵育15 min;上机前加入PI 5 μl,避光孵育15 min;上机检测。所有操作严格按照试剂盒说明书操作进行。采用流式细胞仪(Ex=488 nm,Em=530 nm)检测细胞凋亡情况。每组实验重复3次。
1.6 荧光素酶分析 设计合成ZEB2-3′UTR序列及突变序列,并插入pGL3荧光素酶报告载体的XbaI和FseI位点以构建荧光素酶报告质粒。取对数期生长的人上皮细胞HEK293T细胞5×105个,接种于6孔板中,将pisCHECK-2/ZEB2 WT 3′-UTR、pisCHECK-2/ZEB2 MUT 3′-UTR和miR-203 mimics,采用Promega GloMaxTM20/20发光检测仪检测荧光素酶活性。每组实验重复3次。
1.7 RNA提取及实时荧光定量PCR(qRT-PCR) 采用TRIzol法提取细胞总RNA。采用凝胶电泳检测RNA分子量;采用紫外分光光度计检测RNA浓度。根据试剂盒说明书操作进行。进一步采用mirPremierTMmicroRNA Isolation Kit分离miRNAs,根据 SuperScript RT kit说明书合成cDNA。按照SYBR DDPeen PCR master Mix 说明书进行qRT-PCR。冰浴中配制20 μl PCR反应体系,95 ℃ 10 min,95 ℃ 10 s,60 ℃ 30 s,循环40次。根据NCBI数据库获得的资料设计引物。引物序列如下:miR-203(F:5′-GTATTCGCACTGGATACGACCGACC-3′,R:5′-TGCGCTAACAGTCTACAGCCA-3′);ZEB2(F:5′-CAGCAAACCAACAATGCCGA-3′;R:5′-GATCTGCGACCACACCATGA-3′)。根据使用说明调整基线,将阈值设定在荧光值对数图的线性部分,从软件中读取Ct值。ΔCt=样品Ct均值-内参Ct均值,ΔΔCt=ΔCt-(随机阴性对照样品Ct均值-内参Ct均值),以2-ΔΔCt表示目的基因mRNA相对表达量。
1.8 免疫印迹(Western blot)法检测蛋白表达量 收集对数期生长的细胞1×1010个,加入200 μl细胞裂解液,提取总蛋白;BCA法检测蛋白浓度。蛋白样品凝胶电泳;转膜;用5%的脱脂奶粉封闭60 min;加入E-cadherin抗体(1∶1 000稀释)、Snail抗体(1∶200稀释)、ZEB2抗体(1∶500稀释)孵育;加入二抗(1∶5 000稀释)孵育;按照ECL显影试剂盒说明书进行显影操作;采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(IOD)表示灰度值。

2 结果
2.1 MTT法检测SGC-7901/DDP细胞对DDP的耐药指数 经MTT法检测,随着DDP作用浓度的增加,DDP对SGC-7901细胞增殖活性的抑制率明显高于SGC-7901/DDP细胞,差异有统计学意义(P<0.05)。DDP对SGC-7901、SGC-7901/DDP细胞的IC50分别为18.37、94.68 μmol/L。SGC-7901/DDP的RI为5.15±0.27,说明SGC-7901/DDP细胞耐药性良好,可用于后续试验。见图1。
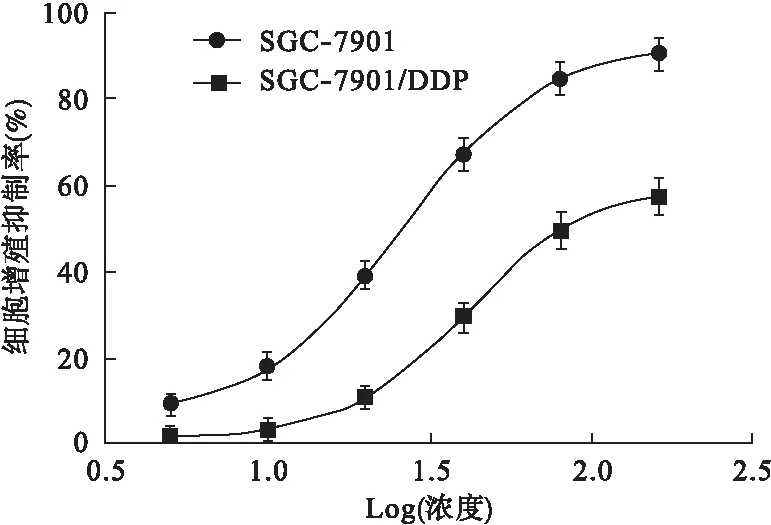
图1MTT法检测DDP对SGC-7901/DDP细胞和SGC-7901细胞增殖活性的差异(n=8)
2.2 SGC-7901和各组SGC-7901/DDP细胞miR-203和ZEB2表达量 SGC-7901/DDP细胞中miR-203表达量明显低于SGC-7901细胞,差异有统计学意义(P<0.05)。经miR-203 mimics转染后,miR-203组SGC-7901/DDP细胞miR-203表达量明显高于SGC-7901组、SGC-7901/DDP组和NC组,同时,si-ZEB2组miR-203的表达量较SGC-7901组、SGC-7901/DDP组和si-NC组SGC-7901/DDP细胞也明显升高,差异有统计学意义(P<0.05)。另外,沉默SGC-7901/DDP细胞ZEB2基因表达后,ZEB2 mRNA表达量降低,而miR-203表达量明显升高,与Si-NC组比较,差异有统计学意义(P<0.05)。见表1。
2.3 miR-203 mimics慢病毒转染效率以及qRT-PCR验证 经慢病毒转染后,SGC-7901/DDP细胞出现GFP绿色荧光,则表示转染成功。miR-203 mimics慢病毒滴度为1×108PFU/ml时,细胞转染效率为77.35%±2.46%。见图2。
2.4 DDP对miR-203 mimics转染细胞株增殖活性的影响 重复测量的方差分析结果显示,SGC-7901/DDP组、NC组和miR-203组细胞增殖抑制率比较差异有统计学意义(F=489.53,P<0.05);

表1 各组细胞中miR-203和ZEB2的表达量
注:与SGC-7901组比较,aP<0.05;与SGC-7901/DDP组比较,bP<0.05;与NC组比较,cP<0.05;与miR-203组比较,dP<0.05;与Si-NC组比较,eP<0.05
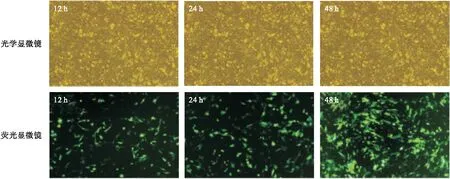
图2 显微镜下观察miR-203 mimics转染效果(200×)
随着药浓度的增加,各组细胞增殖活性抑制率也逐渐增加。另外,相同浓度条件下,DDP对miR-203组SGC-7901/DDP细胞增殖活性的抑制率明显高于SGC-7901/DDP组和NC组,差异有统计学意义(P<0.05)。DDP对SGC-7901/DDP组、NC组和miR-203组细胞的IC50分别为92.81、94.35、22.68 μmol/L。见图3。

图3MTT法检测DDP对SGC-7901/DDP组、NC组、miR-203组SGC-7901/DDP细胞增殖活性的影响
2.5 Annexin V/PI双染法分析SGC-7901/DDP细胞凋亡情况 经FCM法检测,25 μmol/L浓度的DDP分别作用于SGC-7901组、NC组和miR-203组细胞24 h后,细胞凋亡率分别为6.38%±1.55%、5.69%±1.76%、23.14%±2.03%,DDP对miR-203组细胞凋亡的促进作用明显高于SGC-7901/DDP组和NC组细胞,差异有统计学意义(P<0.05)。见图4。
2.6 沉默ZEB2基因的表达对SGC-7901/DDP细胞增殖活性的影响 重复测量的方差分析结果显示,SGC-7901/DDP组、Si-NC组和Si-ZEB2组细胞增殖抑制率比较差异有统计学意义(F=243.17,P<0.05);随着药物浓度的增加,各组细胞增殖活性抑制率也逐渐增加。另外,相同浓度条件下,DDP对Si-ZEB2组SGC-7901/DDP细胞增殖活性的抑制率明显高于SGC-7901/DDP组和Si-NC组,差异有统计学意义(P<0.05)。DDP对SGC-7901/DDP组、Si-NC组和Si-ZEB2组细胞的IC50分别为94.53、97.89、29.76 μmol/L。见图5。

图4 FCM法检测DDP对SGC-7901/DDP组、NC组、miR-203组细胞凋亡活性的影响

图5 MTT法检测DDP对SGC-7901/DDP组、Si-NC组、Si-ZEB2组SGC-7901/DDP细胞增殖活性的影响
2.7 过表达miR-203或沉默ZEB2表达对EMT通路相关蛋白的调节 经Western blot法检测,miR-203组SGC-7901/DDP细胞Snail蛋白表达量明显低于SGC-7901/DDP组和NC组,而E-cadherin蛋白表达量高于SGC-7901/DDP组和NC组,差异有统计学意义(P<0.05)。另外,沉默SGC-7901/DDP细胞ZEB2基因表达后,E-cadherin蛋白表达量升高,而Snail蛋白的表达量明显降低,与Si-NC组比较,差异有统计学意义(P<0.05)。表2。
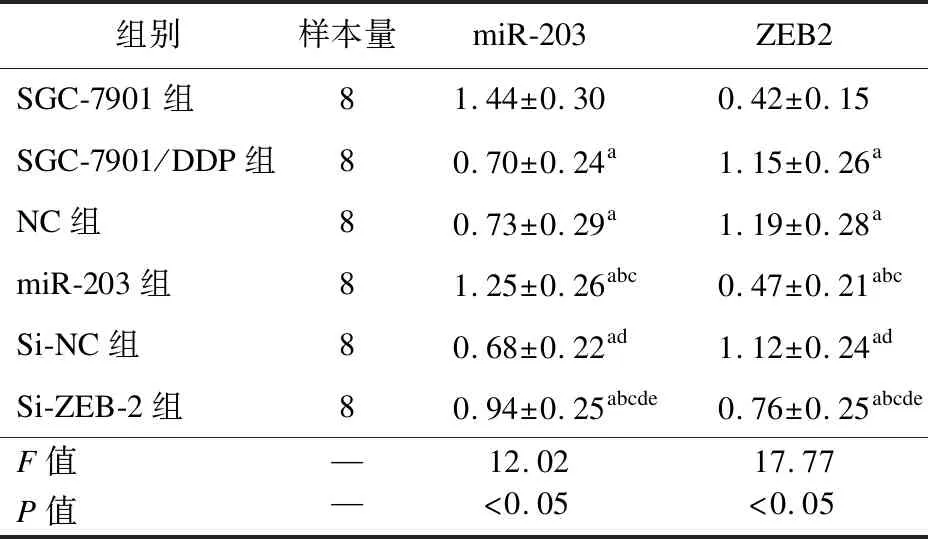
表2 各组细胞中E-cadherin和Snail蛋白的表达量
注:与SGC-7901组比较,aP<0.05;与SGC-7901/DDP组比较,bP<0.05;与NC组比较,cP<0.05;与miR-203组比较,dP<0.05;与Si-NC组比较,eP<0.05
2.8 双荧光素酶基因报告分析 通过靶基因预测数据库TargetScan、microrna和miRanda筛选,发现ZEB2基因结合位点与miR-203互补,可能是miR-203下游的靶基因。通过构建含有靶基因野生型或突变型3′-UTR的荧光酶报告基因质粒来检测细胞内源性miR-203对预测靶基因的抑制作用。结果显示,克隆了野生型ZEB2 3′-UTR的基因报告质粒同miR-203 mimics共转染之后,荧光酶活性被明显减弱(P<0.05),而将突变型ZEB2 3′-UTR的基因报告质粒与miR-203 mimics共转染之后,其并没有对荧光素酶活性产生明确影响。提示ZEB2可能是miR-203的下游靶基因。见图6、图7。

图6 双荧光素酶报告基因实验结果

图7 ZEB2 3′-UTR与miR-203 mimics双荧光素酶报告基因实验结果
3 讨论
在胃癌综合治疗中,以铂类药物为基础的化疗是进展期胃癌的标准一线治疗方案[7],但是随着化疗次数的增加,部分肿瘤细胞会产生顺铂耐药性,从而导致治疗失败。铂类药物(包括顺铂)的耐药机制复杂,包括细胞DNA损伤与错配修复能力增强,靶点表达异常、药物进入靶细胞通路受阻等[7]。在实际临床中,至少有一半的患者会对DDP产生原发性或继发性耐药。因此,寻找逆转DDP耐药的作用靶点,是进行个体化治疗、提高患者预后的关键。
在本项研究中,我们自上海细胞库购入胃癌耐药细胞株SGC-7901/DDP,并通过MTT法证实其对DDP的耐药性。既往已有研究证实,miR-203在膀胱癌[8]、食管癌[9-10]等多种肿瘤组织中呈低表达或阴性表达,而且季超等[11]研究也证实,miR-203与胃癌患者的预后密切相关。我们在前期调研工作中发现,ZEB2可能是miR-203的下游靶基因。而ZEB家族成员与EMT的关系早已被众多研究所证实[11],因此,我们考虑miR-203是否与SGC-7901细胞耐药性有关。miRNAs作为一类非编码小分子调控基因,可对靶基因转录或翻译过程进行调节,从而影响下游蛋白的表达量[12]。而这些靶基因若与药物敏感性有关,则可能通过上调或下调miRNAs的表达进而影响药物抗肿瘤作用[13]。因此,我们通过细胞转染的方法上调SGC-7901细胞miR-203的表达,确定其转染率达到70%以上后,进行后续试验。加入DDP干预后,转染组SGC-7901/DDP细胞增殖和迁移活性明显受到抑制,而且凋亡活性大大增加,表明miR-203在胃癌细胞中属于功能性基因,上调miR-203的表达量可明显增加SGC-7901/DDP耐药细胞株对DDP的敏感性。随后,我们又通过双荧光素酶基因报告分析和qRT-PCR法检测,证实上调miR-203的表达可以抑制ZEB2的表达;同时也发现EMT相关蛋白,包括E-cadherin和Snail的表达均受到影响,与SGC-7901/DDP组细胞相比,miR-203组细胞E-cadherin的表达量增加,且Snail蛋白的表达量降低,说明miR-203的直接靶点是ZEB2,通过ZEB2抑制EMT进程。E-cadherin是维持上皮细胞极性最主要的细胞黏附分子[14],通过与β-catenin结合形成复合物,与肌动蛋白细胞骨架连接,形成细胞间黏附,从而阻止细胞侵袭和转移[15]。而Snail也属于影响EMT进程的转录因子之一[16],通过与多种miRNAs形成双向负性调节,对肿瘤细胞EMT进程有更强烈的效应[16]。在本项研究中,上调SGC-7901/DDP耐药细胞株miR-203的表达,使得与EMT进程有关的E-cadherin蛋白表达量升高,而Snail蛋白表达量降低,说明EMT进程受到明显抑制。
另外,在本项研究中,我们还采用了RNA干扰技术沉默SGC-7901/DDP耐药细胞中ZEB2基因的表达,结果发现miR-203表达量也相应增加。说明miR-203在靶向调控ZEB2时,ZEB2基因也在负反馈调节miR-203的表达。并且沉默ZEB2基因的表达,同样也可提高SGC-7901/DDP细胞对DDP的敏感性,因此,与Snail/miRNAs系统一样[17],ZEB2可能与miR-203形成双向负性调节通路,从而增强其对EMT进程的效应[12]。但是ZEB2并非是miR-203唯一的靶点,同样miR-203也不是ZEB2唯一的靶基因[18],而具体的作用机制和调控网络尚处于研究中。
综上所述,上调miR-203表达或沉默ZEB2的表达均可显著提高SGC-7901/DDP细胞株对DDP的敏感性,并通过上调E-cadherin黏附因子的表达和抑制Snail转录因子的表达,最终抑制EMT进程。因此我们认为,miR-203可与ZEB2启动子区域结合,两者都有望成为预测胃癌对含铂类化疗方案敏感性的重要参考指标,同时可考虑其作为逆转化疗药物耐药靶点的潜力,为临床个体化治疗提供新的思路。

