PD-L1抑制剂—Atezolizumab的药理作用和临床评价
曹园园,高 欢,金 芳,宋燕青
0 引言
肿瘤治疗是当前医学工作者面临的巨大挑战,传统治疗方法主要以手术、放疗和化疗为主。由于肿瘤易侵袭转移及复发,传统治疗方法因应答率低和应答持久性差不能真正治疗肿瘤,并且放疗和化疗靶向性较差,易损伤正常细胞而产生严重的不良反应。肿瘤免疫疗法主要通过激活体内的免疫系统,增强抗肿瘤免疫力,特异性清除癌变细胞,2013年被Science杂志评为年度十大科技突破之首[1],已成为继手术、化疗、放疗和靶向治疗后的一种有效疗法,并广泛应用于临床。肿瘤免疫治疗包括肿瘤疫苗、靶向肿瘤的被动免疫治疗、免疫检查点抑制剂及细胞因子等[2],其中免疫检查点有望成为解决肿瘤问题的重要途径之一。
程序性死亡分子1(PD-1)及其配体PD-L1是一种负性共刺激因子,属于B7家族免疫球蛋白类,在T细胞的活化中发挥重要作用。高表达的PD-1与PD-L1特异性结合后提供抑制性信号,抑制T细胞的活化和增殖,进而诱导T细胞的凋亡,形成免疫抑制的微环境[3]。Atezolizumab(TecentriqTM)是一种靶向PD-L1的单克隆抗体。PD-L1通过减少抗原特异性CD8+T细胞增殖和控制抗原特异性T细胞积聚,在治疗免疫系统疾病中发挥重要作用,上调PD-L1能够使肿瘤细胞逃避宿主的免疫系统[4-9]。Atezolizumab已被美国批准作为尿路上皮癌的二线治疗药物[10],并有望成为非小细胞肺癌(Non-small cell lung cancer,NSCLC)的二线治疗药物。目前,关于Atezolizumab的抗肿瘤研究正在进行,主要包括三阴性乳腺癌、肾细胞癌、黑素瘤和结直肠癌。Atezolizumab的临床发展过程见图1[4]。
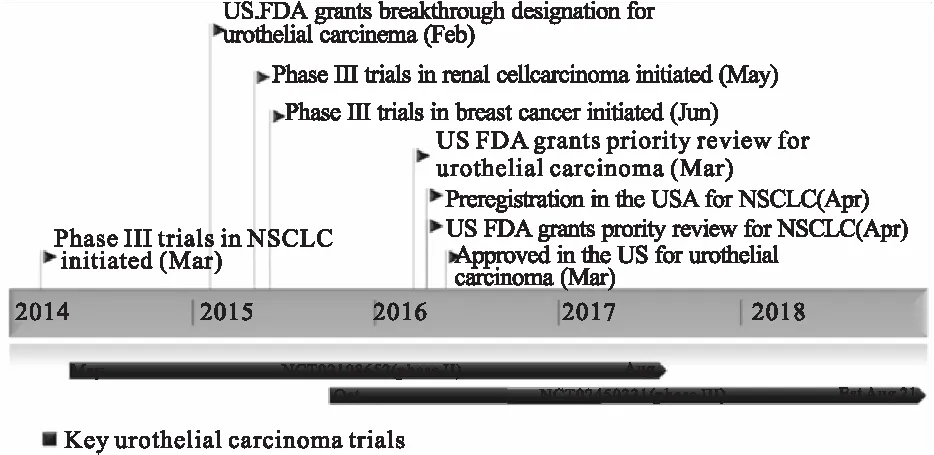
图1 Atezolizumab的临床发展过程
1 作用机制
免疫检查点抑制及Atezolizumab在该过程中的作用见图2。Atezolizumab是一种工程化的人源化单克隆抗体,通过结晶片段结构域修饰,消除其抗体依赖性的细胞毒性,从而抑制活化T细胞的消耗[11]。Atezolizumab以解离常数(Kd)0.4 nM特异性结合PD-L1,阻止其与PD-1和B7.1受体相互作用,而对PD-L2(B7-DC或CD273)与PD-1结合无明显影响[12-13]。
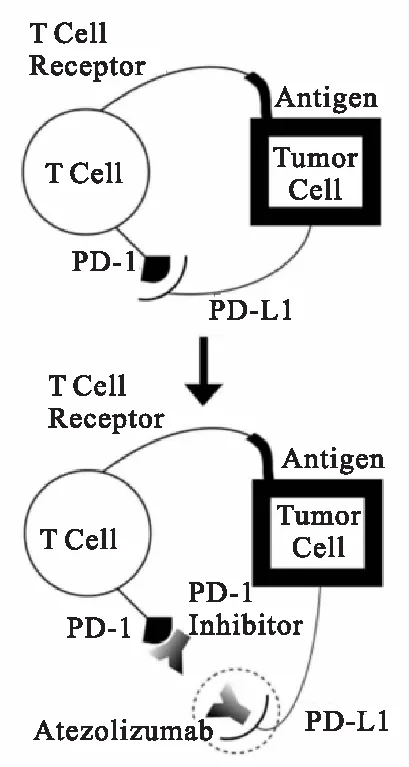
图2 免疫检查点抑制,PD-L1和PD-1的相互作用[14]
2 药动学特征
研究共纳入472例患者,Atezolizumab剂量范围为1~20 mg/kg,包括每3周静脉推注给予1次1 200 mg。研究发现,药物暴露量与剂量增加呈正比,清除率为0.20 L/d,稳态表观分布容积为6.9 L,终末半衰期为27 d。群体药代动力学资料表明,治疗6~9周(2~3个剂量周期)后患者血药浓度达到稳态,药时曲线下面积(Area under the plasma concentration time curve,AUC)、峰浓度(Cmax)和谷浓度(Cmin)的全身积蓄分别为1.91、1.46和2.75倍。结果表明,年龄、体重、性别、白蛋白水平、肿瘤负荷、地区或种族、轻度或中度肾损伤、轻度肝功能损伤、PD-L1表达水平和美国东部肿瘤协作组(ECOG)体能状态评分等因素对Atezolizumab的全身暴露量无明显影响。Atezolizumab与其他药物之间的相互作用尚不明确[15]。
3 临床研究
3.1 尿路上皮癌 正在进行的Ⅱ期IMvigor 210临床研究(NCT02108652),目的在于评价Atezolizumab对接受过铂类化疗后出现疾病进展不能手术治疗的晚期或转移性尿路上皮癌患者的安全性和有效性[16]。根据患者肿瘤浸润性免疫细胞(IC)的PD-L1状态进行分级:PD-L1阳性细胞<1%为IC0,≥1%而<5%为IC1,>5%为IC2/3。截至2015年9月14日的试验结果表明,给予静脉推注Atezolizumab 1 200 mg每3周治疗1次,所有患者(310例)的客观缓解率(Objective response rate,ORR)为15%,其中完全缓解率(Complete response,CR)为15%,部分缓解率(Partial responses,PR)为30%;IC2/3亚组ORR为26%(CR为11%,PR为11%);IC1/2/3亚组ORR为18%(CR为13%,PR为24%)。约4.5个月后随访发现,IC2/3和IC1/2/3亚组患者ORR分别为26%和18%,总体ORR为15%。中位随访时间为11.7个月,中位持续时间未获得。结果表明,Atezolizumab对晚期或转移性尿路上皮癌患者具有持久的药物活性[16]。
Ⅰa期临床研究(NCT01375842)评价了Atezolizumab治疗曾接受过其他药物治疗的转移性膀胱上皮癌患者的疗效。共纳入患者85例,给予Atezolizumab静脉推注15 mg/kg或1 200 mg,每3周治疗1次。结果显示,46例患者PD-L1表达为IC2/3,38例为IC0/1,1例为未知。IC2/3和IC0/1亚组患者ORR分别为46%(CR 6%,PR 15%)和16%(PR 6%)。中位反应时间尚未达到。患者的中位无进展生存期(Median progression-free survival,PFS)分别为24、8周,24周总生存期(Overall survival,OS)分别为85%和71%。在IC2/3(31例)和IC0/1(33例)亚组中,内脏转移患者ORR分别为32%(CR 3%,PR 7%)和12%(PR 4%)[17]。综合以上试验结果,FDA批准Atezolizumab治疗转移性尿路上皮癌或接受过铂类为基础化疗后仍进展的晚期尿路上皮癌患者。
3.2 非小细胞肺癌 POPLAR为一项随机的Ⅱ期临床研究(NCT01903993),比较Atezolizumab和多西他赛治疗NSCLC患者的安全性与有效性[18]。该研究将287例患者按1∶1比例随机分为Atezolizumab组(1 200 mg)和多西他赛组(75 mg/m2),每3周治疗1次。结果显示,在13个月随访期后,Atezolizumab组(144例)的总体存活率为12.6个月,而多西他赛组为9.7个月(143例),两组比较差异有统计学意义(P=0.04)。两组患者的PFS分别为2.7、3个月,ORR分别为21%和15%。肿瘤细胞(Tumor cells,TC)或IC中PD-L1的表达水平与OS的改善相关。Atezolizumab和多西他赛治疗TC3(≥50% PD-L1表达细胞)或IC3(≥10% PD-L1表达细胞)患者的OS分别为15.5、11.1个月(风险比为0.49,P=0.068)。两个治疗组中,TC0和IC0患者均为9.7个月(<1%PD-L1表达细胞,风险比1.04,P=0.871)。结果表明,Atezolizumab能显著改善NSCLC患者的生存期。
在FIR(NCT01846416)和BIRCH(NCT0203-1458)Ⅱ期临床研究中,评价了Atezolizumab作为一线或后续治疗TC2/3或IC2/3的PD-L1表达的NSCLC患者的疗效[19-20]。在FIR临床研究中,未接受过化疗(31例)、脑转移(12例)和无脑转移(71例)患者,给予Atezolizumab作为二线或后续治疗后ORR分别为29%、17%、17%,其中TC3或IC3患者ORR分别为29%(n=7)、27%(n=26)、25%(n=8)[21]。在BIRCH临床研究中,Atezolizumab作为一线治疗TC3或IC3和TC2/3或IC2/3患者时,ORR为26%(n=65)和19%(n=139);作为二线治疗时,患者ORR为24%(122例)和17%(267例);作为三线治疗或后续治疗时,患者ORR为27%(155例)和17%(253例)。中位治疗时间为4.2个月,6个月以上的随访中反应率≥61%[19]。
一项正在进行的Ⅰb期临床研究(NCT01633970)评价了Atezolizumab联合标准化疗(卡铂+紫杉醇、培美曲塞或白蛋白结合型紫杉醇治疗4~6个周期后,给予Atezolizumab 15 mg/kg治疗直至疾病发生进展)治疗局部晚期或转移性NSCLC患者的疗效。中期研究结果显示,30例患者的ORR为67%(CR 2%,PR 18%)[22]。
3.3 三阴性乳腺癌 一项正在进行的Ⅰa期临床研究(NCT01375842)评价了Atezolizumab治疗转移性三阴型乳腺癌的有效性。Atezolizumab静脉推注15、20 mg/kg或1 200 mg,每3周1次。结果显示,21例患者的ORR为24%(CR 2%,PR 3%),中位反应时间尚未达到,24周总体无进展生存率为33%[22]。
Ⅰb期临床研究(NCT01633970)评价了Atezolizumab联合白蛋白结合型紫杉醇治疗转移性三阴型乳腺癌的有效性。其中Atezolizumab(静脉推注800 mg,每2周1次)联合白蛋白结合型紫杉醇(125 mg/m2,每周1次)持续3周,治疗4个周期。3个月随访时,5例患者中,1例完全缓解,4例部分缓解[23]。
3.4 转移性肾细胞癌 一项评价Atezolizumab治疗转移性肾细胞癌疗效的Ⅰa期临床研究(NCT01375842)中,给予Atezolizumab 10、15、20 mg/kg或1 200 mg,每3周治疗1次。结果显示,62例患者的ORR为15%(9例),其中18%的患者处于IC1/2/3状态。所有患者的中位持续时间为17.4个月,IC1/2/3状态患者的中位持续时间为14.9个月。两组的PFS均为5.6个月[24]。
Ⅰb期临床研究(NCT01633970)显示,Atezolizumab 20 mg/kg联合贝伐单抗15 mg/kg,每3周治疗1次,在最短随访时间2.1个月后,10例可评估疗效的患者ORR为40%[25]。
3.5 结直肠癌 一项用于评价Atezolizumab联合MEK抑制剂Cobimetinib治疗结直肠癌疗效的Ⅰb期临床研究(NCT01988896)[26]结果显示,Atezolizumab静脉推注800 mg每2周1次联合MEK抑制剂Cobimetinib 20~60 mg/d(治疗21 d,休息7 d/周期)治疗后,PR和病情稳定(Stable disease,SD)的患者分别为4例和5例。
4 不良反应
在IMvigor 210临床研究(NCT02108652)的310例尿路上皮癌患者中,≥10%的患者发生不良反应,未发生药物相关的死亡。最常见的不良反应包括乏力(52%)、食欲下降(26%)、恶心(25%)、尿路感染(Urinary tract infections,UTI)(22%)、便秘(21%)、发热(21%)、外周水肿(18%)、腹泻(18%)、腹痛(17%)、呕吐(17%)、背部或颈部疼痛(15%)、皮疹(15%)、血尿(14%)、关节痛(14%)及瘙痒(13%)[15]。Atezolizumab治疗时可发生免疫相关的不良反应,包括肺炎、肝炎、结肠炎或腹泻等。未观察到免疫相关的肾毒性反应[15]。
5 伴随诊断
Ventana OptiView DAB免疫组织化学检测试剂盒是针对Atezolizumab开发的,将自动化BenchMark ULTRA检测平台与抗人PD-L1兔单克隆抗体SP142相结合,以检测肿瘤细胞和肿瘤浸润免疫细胞中的PD-L1表达[27-28]。该方法可以为尿路上皮癌患者提供技术支持,明显提高诊疗水平。
6 正在进行的临床研究
正在进行的Ⅲ期临床研究,包括评价Atezolizumab治疗膀胱切除后PD-L1阳性的高风险肌层浸润性膀胱癌的疗效(NCT02450331[IMVigor010])[29];与其他药物联合治疗曾接受过铂类化疗后出现疾病进展的晚期NSCLC(NCT02409342[IMpower110],NCT02409355[IMpower111],NCT02367781[IMpower130],NCT02367794[IMpower130],NCT02366143[IMpower150])[28-29];与多西他赛比较,治疗曾接受铂化疗失败PD-L1阳性的晚期或转移性的NSCLC患者的疗效(NCT02008227[OAK])[30];联合白蛋白结合型紫杉醇作为转移性三阴性乳腺癌患者(NCT02425891[Impassion 130])的一线治疗[31]。
7 结语
肿瘤免疫治疗取得了令人振奋的进展,研究表明,免疫治疗较化疗可以获得更大的持续应答,对多种肿瘤患者具有长期疗效。PD-L1单克隆抗体是肿瘤免疫治疗的前沿,也是医药企业研发的热点。2016年5月18日,Atezolizumab被美国FDA批准作为治疗尿路上皮癌的二线治疗药物,并有望成为治疗NSCLC的二线治疗药物。我国膀胱癌在男性肿瘤发病率中位列前十,其中尿路上皮癌是膀胱癌中最常见的类型,占病例总数的90%。Atezolizumab是继铂类化疗药物之后首个经FDA批准用于膀胱癌的PD-1/PD-L1抑制剂。该药适用于局部晚期或转移性尿路上皮癌患者,在含铂类化疗方案治疗中或治疗后疾病出现进展;或在含铂类化疗方案术前新辅助或术后辅助治疗的12个月内。研究表明,在使用化疗减缓肿瘤进程失败后,Atezolizumab可以显著缩小肿瘤体积。FDA对Atezolizumab的批准使肿瘤免疫的新星之一PD-L1抑制剂成为泌尿系肿瘤的可选方案,扩大了PD-1/PD-L1免疫治疗的家族成员。目前,仍有多项临床研究正在进行中,有望进一步提高癌症患者的总生存期。肿瘤免疫治疗使抗肿瘤药物的研究进入了新的发展时期,更多更有效的调节免疫功能的药物被开发,并将有助于改善肿瘤患者的生存状态,为治愈肿瘤提供良好前景。

