阻燃剂TCPP暴露对小鼠的神经毒理作用观察及相关机制研究
王程强,钱 波,陆艳玫,王 璐,张亚斌,宋家乐
(桂林医学院公共卫生学院,广西 桂林 541000)
有机磷阻燃剂(organophosphate flame retardants,OPFRs)是一种化学性质稳定,并能在环境中长期存在的新型阻燃剂。空气、水体中的OPFRs会通过呼吸道、消化道进入生物体内[1]。随着多溴联苯醚(polybrominated diphenyl ethers,PBDEs)类阻燃剂的禁用,OPFRs的使用量与日俱增。有研究显示,多种环境介质及生物体内OPFRs检出浓度逐年递增[2]。OPFRs具有多种同系物,其中磷酸三(2-氯丙基)酯(tris(2-chloroisopropyl)phosphate,TCPP)是目前最常见的有机磷阻燃剂,而且在我国环境中广泛存在[3]。近年来,大量研究证实OPFRs具有神经毒性、生殖毒性、内分泌干扰效应、发育毒性、致癌性[1],其中以神经毒性及甲状腺干扰效应最为显著[4 - 5]。TCPP作为可疑的甲状腺激素干扰物(TDCs),可能会对甲状腺激素产生干扰效应[6]。甲状腺激素功能的紊乱,会影响神经及大脑的发育。因此,本研究以TCPP为受试物,通过对KM小鼠灌胃染毒,探索TCPP暴露对KM小鼠学习记忆能力及其血清甲状腺激素水平的影响。
1 材料和方法
1.1 实验动物
清洁级4周龄KM小鼠,由桂林医学院实验动物中心提供[SCXK (桂) 2013-0001],60只,雌雄各半,体质量(26.6 ± 4) g。小鼠饲养于桂林医学院公共卫生学院SPF级动物房[SYXK (桂) 2013-0001],自由采食和饮水,室内温度20℃ ~ 25℃,湿度40% ~ 70%,12 h亮暗循环。本研究获得桂林医学院实验动物伦理委员会审查批准(GLMC:201710020)。小鼠的饲养及使用过程严格遵守《美国公共卫生署人道管理和使用实验动物政策》[7]。KM小鼠在实验中处于舒适的环境,并为其提供足够的水和食物,舒适的睡眠,按实验动物使用的3R原则对其给予人道的关怀。
1.2 主要试剂与仪器
TCPP,产品批号YR160103(张家港瑞雅化工有限公司,纯度> 99%);谷胱甘肽转移酶(glutathione transferase,GST)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)试剂盒(南京建成有限公司);游离三碘甲腺原氨酸(free triiodothyronine,FT3)产品编号54010224,游离四碘甲腺原氨酸(free tetraimethionine,FT4)产品编号75434094,总三碘甲腺原氨酸(total triiodothyronine,TT3)产品编号52607543,总四碘甲腺原氨酸(total tetraiodothyronine,TT4)产品编号75648910,按配套试剂盒操作说明检测子鼠血清中T4、FT4、T3、FT3水平。甲状腺激素测定采用德国西门子ADVIA Centaur XP全自动免疫分析系统,使用的是直接化学发光法;Morris水迷宫检测系统,产品型号XR-XM101(上海欣软信息科技公司)。
1.3 实验方法
1.3.1 动物分组和处理
所有动物适应性饲养7 d后,按随机数字表法分成3组,分别为对照组和低、高染毒组,每组10只。将TCPP溶于纯花生油中,根据各染毒组小鼠体质量,按照10 mg/(kg·d)和100 mg/(kg·d)体质量灌胃染毒TCPP;对照组小鼠灌胃等体积花生油。连续灌胃染毒30 d后,采用随机数字表法,每组选取小鼠8只,作为本实验的研究对象。
1.3.2 小鼠体质量及一般情况观察
每天观察记录每组小鼠精神与活动状态,并于染毒后第28 ~ 30天,测量每组小鼠进食量、饮水量和体质量。实验结束后称重,处死小鼠取生物样本并计算脏器指数,脏器指数=脏器质量(mg)/小鼠体质量(g)。
1.3.3 小鼠空间学习记忆能力测定
染毒第30天后,进行水迷宫实验[8]。将水迷宫等分为Ⅰ、Ⅱ、Ⅲ和Ⅳ共四个象限,平台固定于第Ⅲ象限中部,录像机悬挂于水迷宫正上方,记录和分析动物行为轨迹及动物找到平台所需时间(即逃避潜伏期)。实验前,所有子鼠进行游泳预训练,2次/d。待适应后,分别从Ⅰ、Ⅱ、Ⅲ和Ⅳ共四个象限面向水池放入子鼠,记录子鼠在60 s内的逃避潜伏期。正式实验时,将平台至于水池水面下2 cm。若子鼠在60 s内未找到平台,则记录其逃避潜伏期为60 s。第5天后,撤去水中的平台,使子鼠从平台外任一象限入水。记录子鼠在60 s内,在原平台所在的象限游泳时间和跨越原平台次数。子鼠的逃避潜伏期反映其空间学习记忆能力,子鼠穿越平台次数和平台象限时间反映其空间位置记忆能力。
1.3.4 小鼠血清甲状腺激素水平检测
水迷宫实验结束后当天,各组小鼠采用苯巴比妥麻醉,1.0 mL注射器中心静脉采血0.5 mL。4℃下,1500 r/min离心10 min(离心半径10 cm),分离血清,采用化学发光免疫分析法测定子鼠血清中游离三碘甲腺原氨酸(FT3)、总三碘甲腺原氨酸(TT3)、游离四碘甲腺原氨酸(FT4)和总四碘甲腺原氨酸(TT4)水平[9]。
1.3.5 小鼠脑组织氧化应激指标检测
采血完毕后,断头处死小鼠,迅速剥离脑组织,1 mL生理盐水洗净血液后,立即置于-80℃液氮中保存待用。从液氮罐中取出脑组织解冻,以4℃预冷的生理盐水漂洗,剪碎组织后以组织捣碎机制备组织匀浆,3000 r/min离心10 min(离心半径10 cm),取上清液,按照试剂盒说明书进行操作,检测脑组织中GST、SOD、CAT和MDA水平。
1.4 统计学方法
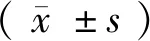
2 结果
2.1 小鼠一般情况
如表1、表2所示TCPP暴露对小鼠体质量、饮食量以及其余脏器指数均没有影响。但高剂量TCPP暴露后小鼠饮水量出现明显降低,同时肝和脾脏器指数也出现显著升高(P< 0.05)。

表1 不同剂量TCPP暴露对小鼠体质量、饮食、饮水的影响
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.

表2 不同剂量TCPP暴露对小鼠脏器指数的影响
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
2.2 小鼠空间学习记忆能力的变化
如图1、2、3所示,与对照组小鼠相比,低剂量TCPP染毒组小鼠仅逃避潜伏期出现延长。与对照组小鼠相比,高剂量TCPP染毒组小鼠逃避潜伏期和游行总路程出现明显延长,在第三象限停留时间出现下降(P< 0.05)。
2.3 小鼠甲状腺激素水平
如表3所示,与对照组小鼠相比,低剂量、高剂量TCPP染毒组小鼠FT3均出现明显增高(P<0.05)。与对照组小鼠相比,高剂量TCPP染毒组小鼠TT3出现明显增高(P< 0.05)。

注:与对照组相比,*P < 0.05。图1 不同剂量TCPP暴露对小鼠逃避潜伏期的影响Note. Compared with the control group,*P< 0.05.Figure 1 Effects of TCPP exposure on escape latency of the mice
2.4 小鼠脑组织氧化应激水平
如表4所示,与对照组小鼠相比,低剂量TCPP染毒组小鼠仅GST出现降低,MDA增高(P< 0.05)。与对照组小鼠相比,高剂量TCPP染毒组小鼠GST、SOD出现明显降低,MDA显著增高(P< 0.05)。
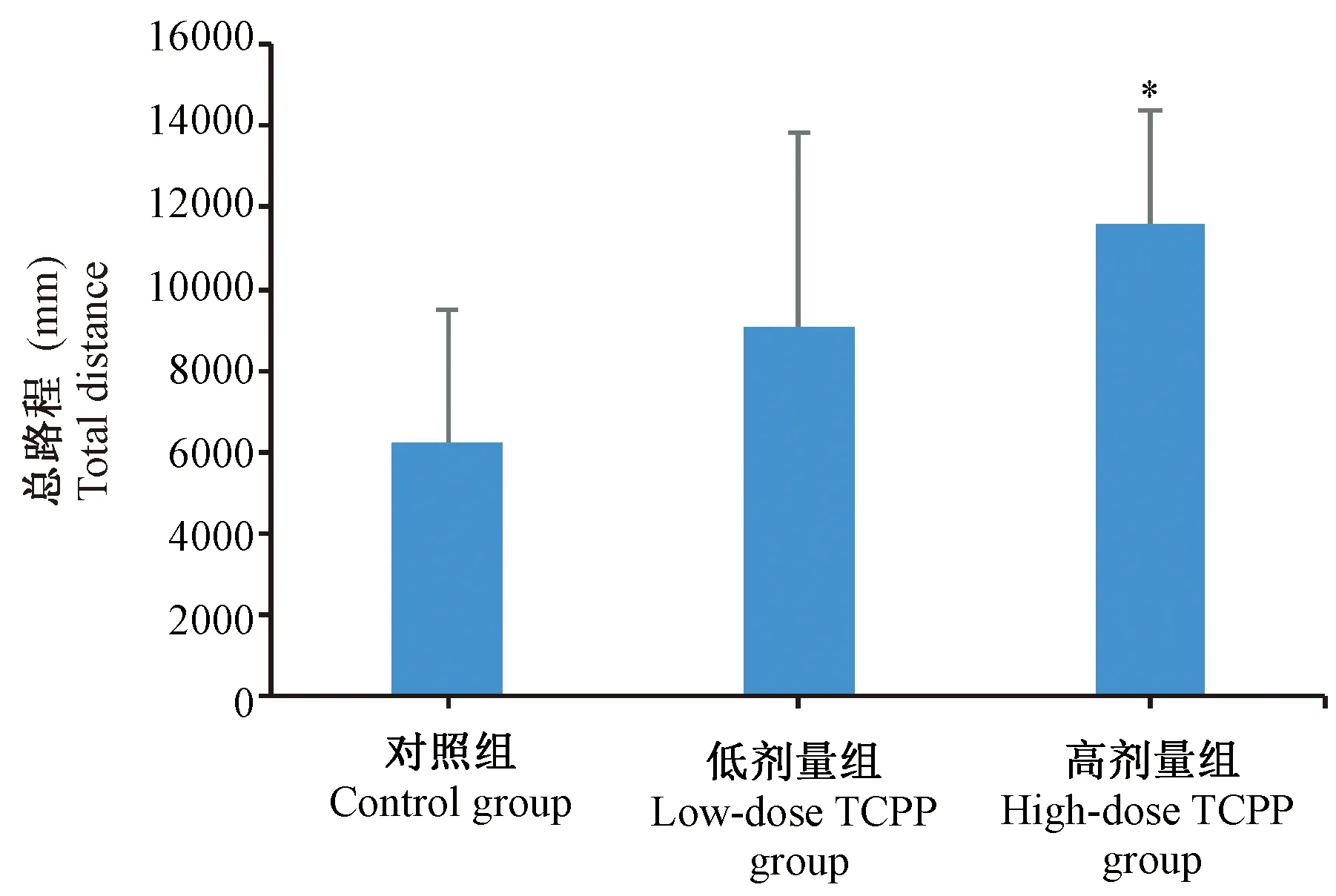
注:与对照组相比,*P < 0.05。图2 不同剂量TCPP暴露对小鼠游行总路程的影响Note. Compared with the control group,*P< 0.05.Figure 2 Effects of TCPP exposure on total swimming distance of the mice
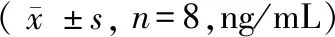
表3 三组小鼠甲状腺激素水平
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.

表4 三组小鼠脑组织氧化应激水平
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.

注:与对照组相比,*P < 0.05。图3 不同剂量TCPP暴露对小鼠目标象限停留时间的影响Note. Compared with the control group,*P< 0.05.Figure 3 Effects of TCPP exposure on residence time of the mice in the target quadrant
3 讨论
OPFRs是由磷酸根骨架及三个取代基组成,根据取代基的种类,可以分为烷基OPFRs、芳基OPFRs、卤代(主要是氯)烷基OPFRs三种。卤代烷基OPFRs中又分为TCPP(磷酸三(2-氯丙基)酯)、TCEP(磷酸三氯乙酯)、TDCPP(磷酸三(2,3-二氯丙基)酯)、TDCIPP(磷酸三(1,3-二氯-2-丙基)酯)。TCPP的化学结构与TCEP、TDCPP、TDCPP、TDCIPP相似,均是氯化OPFRs,可以在环境中长期存在。TCPP是目前数量最多运用最广的氯化OPFRs,可能对环境生物和人体带来巨大危害。目前,大量研究集中在TCPP对环境生物的影响。有研究表明,TCPP通过干扰内分泌系统来影响斑马鱼的发育[10]。TCPP暴露会导致秀丽线虫生殖发育障碍、运动行为损伤和神经毒性等[11]。通过大鼠垂体瘤细胞(GH3)增殖实验,发现TCPP对甲状腺激素具有干扰效应[6]。
然而TCPP对哺乳动物的毒性研究很少。本研究发现,高剂量TCPP(100 mg/(kg·d))灌胃后小鼠饮水量出现降低,肝和脾脏器指数出现显著升高。这一现象,与其同系物TDCIPP的实验结果十分相似。Zhao等[12]用TDCIPP(100 mg/(kg·d)、250 mg/(kg·d))灌胃青春期雌性大鼠21 d,也出现肝脏器指数、(肝、肾脏器指数)的增加。Moser等[13]用TDCIPP(150 mg/(kg·d))灌胃大鼠也出现了母鼠肝质量的增加。这些结果说明,高剂量的TCPP暴露会对小鼠的生长和发育带来不利的影响。但是皮天星等[10]用TCPP对成熟斑马鱼进行染毒,发现肝指数随着浓度的增加而降低。Fernie等[5]用TCPP等多种OPFRs(22 ng/g)染毒鸟类21 d,并未观察鸟类肝出现氧化损伤,但是肝细胞的完整性和功能性发生适度的改变。以上结果的不同,可能是因为实验动物的种类和剂量、染毒方式的不同所致。
本研究发现,高剂量TCPP染毒组小鼠逃避潜伏期和游行总路程出现明显延长,在第三象限停留时间出现下降,说明TCPP暴露后小鼠的学习、记忆能力出现明显下降。这一结果说明,TCPP和其他氯化OPFRs一样,具有明显的神经毒性。Tilson等[14]用TCEP急性短期(275 mg/kg)灌胃雌性大鼠,在水迷宫实验中也出现了学习记忆能力受损。这些结果与海马椎体细胞大量减少有着密切的关联。Umezu等[15]用TCEP急性短期(200 mg/kg)灌胃小鼠,小鼠自发性走动活动增加。这个结果可能是TCEP拮抗神经递质γ-氨基丁酸(GABA)有关。由于有机磷酸酯类阻燃剂在结构上有与有机磷农药类似的磷酸二酯键,也有研究认为OPFRs可能通过抑制胆碱酯酶产生神经毒性[16]。但是对线虫进行TCEP或TCPP染毒会导致线虫自主运动缺陷、帕金森样运动障碍,引起多巴胺能神经元退化[11]。TDCIPP对大鼠嗜铬细胞瘤细胞(PC12)染毒时,导致细胞内钙超载,从而激活丝裂原活化蛋白激酶(MAPK)信号通路[17]。上述研究虽然提出了研究OPFRs的神经毒性机制的新方向,但多为体外或脊椎动物,还需要进一步在体内和其他物种特别是哺乳动物中进一步探讨。
甲状腺激素在人类和动物的生理过程中起到了重要作用,尤其是在中枢神经系统的分化、发育及各种功能形成过程中。因此,干扰甲状腺激素将会对正常生理功能产生严重不良反应。由于TCPP的化学结构与TT3和TT4结构相似,因此TCPP可能对甲状腺素产生干扰效应,故被列为可疑甲状腺激素干扰物(TDCs)。流行病学研究显示,室内粉尘中TDCIPP的含量与人体血清中FT4有着密切的关系,二者出现负相关[18]。本次研究发现,高剂量TCPP染毒组小鼠与对照组小鼠相比TT3、FT3出现明显增高。同为氯代有机磷阻燃剂的TDCIPP对大鼠染毒,也出现了TT3增高的结论[12]。但是TDCIPP对鸡胚、斑马鱼染毒,均出现了TT4减少的现象[19 - 20],而本研究TT4未出现明显改变。以上结论出现不同的原因,可能是因为,相对于其他物种,哺乳动物具有更好的免疫力和强大的自我调节机制。当外界环境出现改变时,机体内甲状腺激素(thyroid hormones,TH)水平会受到干扰。哺乳动物往往比卵生动物更快的启动调节机制,如脑垂体和下丘脑的负反馈调节及甲状腺代偿机制来维持甲状腺激素的稳态。而且,卵生动物与哺乳动物有着不同的吸收、分布、代谢、排出的过程。卵生动物免疫功能及外界环境抗干扰能力显著低于哺乳动物,所以卵生动物比哺乳动物更加敏感。本研究发现高剂量染毒导致甲状腺激素增高,可能是机体的补偿机制。同为阻燃剂的多溴联苯醚,也出现了类似的效应。而且,多个时间点甲状腺激素的变化水平,往往比单个时间点甲状腺激素水平更有意义。但是,由于本研究经费有限,因此没有进行多点检测。
大脑是机体代谢最旺盛的器官,其抗氧化能力比较弱。本研究发现,高剂量TCPP暴露均可导致小鼠脑组织中MDA水平升高(P< 0.05),GST和SOD活力下降(P< 0.05),以及小鼠的学习、记忆能力出现明显下降。说明氧化应激在TCPP的神经毒性中起到重要作用。有研究报道,较高浓度TCPP(100、150、200 μmol/L)对人肝癌细胞(HepG2)、人肺腺癌细胞(A549)、人结肠腺癌细胞(Caco-2)细胞染毒时,相关细胞活力将受到抑制,其原因是细胞内产生大量活性氧、诱导DNA损伤及乳酸脱氢酶(LDH)大量渗出[21]。此外其同系物TDCIPP(30、60 μmol/L)对PC12细胞染毒时,细胞内活性氧增多,SOD与GSH随之剂量增高而降低,而MDA呈现增高的趋势[22]。以上研究与本研究结果比较一致。
本研究发现,高剂量TCPP染毒导致小鼠产生神经毒性及血清中TT3、FT3出现明显增高。甲状腺激素水平的增高,可以介导产生大量活性氧,导致脑细胞脂质过氧化和脑细胞损伤的发生,最终导致学习记忆能力下降[23]。综上,TCPP暴露具有明显的神经毒性,其毒性机制可能与脑组织氧化损伤及甲状腺激素紊乱有关。

