瑞士乳杆菌和鼠李糖乳杆菌混合培养条件优化及冻干菌粉的制备
王燕,王发美,张秀苑,白雪,贺红军
(烟台大学生命科学学院,山东烟台264005)
0 引 言
鼠李糖乳杆菌、瑞士乳杆菌作为应用最为广泛的益生菌,其产品在美国、芬兰、德国、澳大利亚、日本等30多个国家、地区广泛分布[1]。这两株菌能够耐酸性以及胆盐等,并且在肠道定殖能力强,能够抑制有害菌侵入,结合并排除毒素、预防龋齿、预防和治疗腹泻、改善免疫系统,加速感染后的恢复,预防和治疗过敏等作用[2]。鼠李糖乳杆菌和瑞士乳杆菌混合培养,瑞士乳杆菌对培养基中的蛋白的代谢能力较强,通过胞外蛋白水解酶将蛋白水解成小分子多肽和氨基酸[3-5],鼠李糖乳杆菌具有较强的耐酸性,并能够利用多肽及氨基酸,因此当两株菌混合培养时,利用两株菌细胞代谢差异性,提高两株菌的存活率。本文在两株菌混合培养的基础上以MRS为基础对碳源、氮源进行优化,并通过真空冷冻干燥技术制备冻干菌粉,为工业化生产提供理论依据。
1 材料与方法
1.1 主要仪器
SW-CJ-2FD洁净工作台,752N紫外可见分光光度计,BPX-272电热恒温培养箱,梅特勒FE20 pH计,MLS-3780高压蒸汽灭菌器,eppendorf-5810高速冷冻离心机,真空冷冻干燥机。
1.2 菌种
瑞士乳杆菌、鼠李糖乳杆菌均由中国科学院烟台海岸带研究所分离筛选,保藏于中国典型培养物保藏中心(CCTCC),保藏号分别为QC-1 CCTCC M 2015539,QC-2 CCTCC M 2015540。
1.3 培养基
MRS培养基:蛋白胨10 g,葡萄糖20 g,酵母浸膏5 g,乙酸钠 5 g,柠檬酸氢二铵 2 g,牛肉膏 10 g,吐温-80 1 mL,K2HPO42 g,MnSO4·4H2O 0.25 g,蒸馏水1 000 mL,pH=6.8,琼脂15 g。
1.4 方法
1.4.1 菌种的活化
将-80℃下甘油保存的瑞士乳杆菌和鼠李糖乳杆菌在无菌操作下分别接种于液态MRS培养基中,后置37℃恒温箱中培养12 h后,对发酵后的菌液进行分离、纯化,反复活化3~4代,进行种子液制备[5-6]。
1.4.2 活菌计数的测定
本文所选用的活菌计数法为同种细菌菌液的吸光度(Abs)在一定范围内与菌体数量呈正比关系以及系数涂布平板计数法进行活菌计数。采用紫外可见分光光度计测定瑞士乳杆菌和鼠李糖乳杆菌混合发酵液的吸光度值。
1.4.3 碳源的优化
将MRS液体培养基中的主要碳源(葡萄糖)去掉,其他成分不变[6],分别取质量分数为2%的葡萄糖、麦芽糖、乳糖、果糖、乳糖∶葡萄糖=1∶1、葡萄糖∶麦芽糖=1∶1。并以瑞士乳杆菌和鼠李糖乳杆菌6%的接种量,接种比例为瑞士乳杆菌∶鼠李糖乳杆菌=1∶2,且瑞士乳杆菌要早于鼠李糖乳杆菌3 h进行接种,在37℃下培养24 h[6-8]。同时设空白对照。
1.4.4 有机氮源的优化
将MRS液体培养基中的有机氮源(蛋白胨)去掉,其他成分不变,分别取质量分数为1%的大豆蛋白胨、蛋白胨、胰蛋白胨、酪蛋白胨作为氮源。培养条件同1.4.3,同时设空白对照[8-11]。
1.4.5 冻干离心条件的优化
在无菌环境下,将发酵液菌体移入50 mL无菌离心管中,配平,利用冷冻离心机(4℃)对菌液进行离心,设置不同转速(4 000 r/min、6 000 r/min、8 000 r/min、10 000 r/min),不同的时间(10 min、15 min)下进行离心,离心后所得的上层菌液倒入无菌瓶中,使用灭菌处理后的0.85%的生理盐水洗涤沉淀2~3次,并稀释沉淀到原体积,混合均匀,测定活菌数,并计算离心损失率和存活率,得出活菌收得率的最佳离心条件[12]。
离心损失率(%)=(初始活菌数-沉淀中活菌数)/初始活菌数×100%
离心收得率(%)=(沉淀中活菌数/初始活菌数)×100%
1.4.6 冻干保护剂的优化
冷冻干燥过程中对冻干保护剂的种类以及添加量进行优化,向菌泥中分别添加无菌的脱脂奶粉(4%、8%、12%、16%)、海藻糖(2%、4%、6%、8%)、甘油(2%、4%、6%、8%)、L-谷氨酸钠(0.5%、1%、1.5%、2%)、β-环糊精(4%、8%、12%、16%)、蔗糖(3%、6%、9%、12%),菌泥与无菌保护剂以1∶3的比例进行混合,将混合均匀的样品进行冻干前预冻处理,将样品放置于-80℃下预冻3 h,使样品中的水分以固态的形式存在,并将预冻后的样品放置于真空冷冻干燥机进行冷冻干燥[13]。
2 结果与讨论
2.1 碳源的优化结果
在不含碳源的MRS培养基中分别加入质量分数为2%的葡萄糖、麦芽糖、乳糖、果糖、乳糖:葡萄糖=1∶1、葡萄糖∶麦芽糖=1∶1,其他因素不变的条件下,在37℃下培养24 h,结果如图1所示。

如图1所示,两株菌在含有不同的碳源的MRS培养基中,培养24 h小时后,菌液的吸光值存在差异,瑞士乳杆菌和鼠李糖乳杆菌在以麦芽糖为碳源的培养基中生长的最好,其次是葡萄糖,而在以乳糖、混合糖(乳糖∶葡萄糖=1∶1、麦芽糖∶葡萄糖=1∶1)为碳源的培养基中则生长相对于缓慢,因此选择麦芽糖为增菌培养基的碳源。
2.2 氮源的优化结果
在不含有机氮源的MRS培养基中分别加入1%的大豆蛋白胨、蛋白胨、胰蛋白胨、酪蛋白胨,其他因素不变的条件下,在37℃下培养24 h,结果如图2所示。

图2 氮源对瑞士乳杆菌和鼠李糖乳杆菌生长的影响
如图2所示,在不同种类的蛋白胨培养条件下时两株菌吸光值(OD600)存在差异,大豆蛋白胨为有机氮源时,吸光值(OD600)明显高于蛋白胨、胰蛋白胨及酪蛋白胨,大豆蛋白胨因含有丰富的氨基酸和生长因子等营养物质,因此添加大豆蛋白胨有利于菌体生长,所以增菌培养基的有机氮源为大豆蛋白胨。
2.3 离心条件对菌体存活率的影响
离心速度以及离心时间对于菌体的存活率有很大的影响,实验主要对离心速度以及离心时间进行了比较,通过离心前和离心后的菌种的存活率的大小进行比较,得出最适的离心时间以及离心速度[14]。
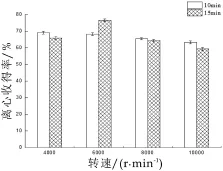
图3 离心条件对两株菌离心效果的影响
由图3可知,随着离心速度的增加两株菌的离心收得率降低,同时在相同的转速不同的时间下菌株的存活率也相差很大,在离心转速为6 000 r/min,时间为15 min时菌株的离心收得率最高,而在10 000 r/min,离心时间为15 min时菌株的离心收得率最小,菌株在这种长时间以及高转速的环境中容易发生细胞的破碎,进而影响了它的存活率,因此选择离心转为6 000 r/min,离心时间15 min对菌液进行离心。
2.4 冻干保护剂的筛选
冷冻干燥过程中菌泥中分别添加无菌的冻干保护剂的种类及添加量分别为,脱脂奶粉(4%、8%、12%、16%)、海藻糖(2%、4%、6%、8%)、甘油(2%、4%、6%、8%)、L-谷氨酸钠(0.5%、1%、1.5%、2%)、β-环糊精(4%、8%、12%、16%)、蔗糖(3%、6%、9%、12%)进行冷冻干燥,将冻干后的菌粉进行同体积复水,稀释涂板计数,求得冻干后的活菌数以及菌的冻干存活率,如图4所示。
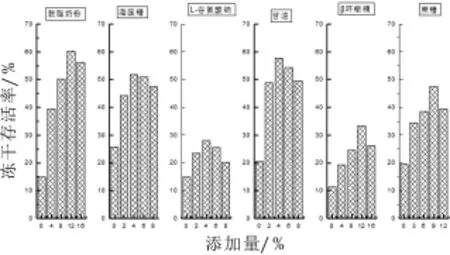
图4 不同冻干保护剂对瑞士乳杆菌和鼠李糖乳杆菌冻干存活率的影响
由图4可知,以脱脂奶粉、海藻糖、甘油作为保护剂时两株菌的冻干存活率最高,说明在冻干过程中,细胞损伤较小,保护效果较好。因此选取脱脂奶粉(4%、8%、12%、16%)、海藻糖(2%、4%、6%、8%)、甘油(2%、4%、6%、8%)作为两株混合菌的冻干保护剂[15-17]。
2.4.1 冻干保护剂的交互作用研究
通过Box-Behnken中心组合设计实验方案,确定因素水平及编码见表1,并按照表所给方案完成17组实验,结果如表2所示。

表1 Box-Behnken实验设计因素水平及编码表

表2 Box-Behnken实验设计方案及结果
将表2数据利用Design Expert.8.0.5软件进行二次多元回归拟合得到模型的二次多项回归方程如下:
活菌数=+7.62+0.13A+0.014B+0.11C+0.095AB+0.068AC-0.14BC-0.20A2-0.27B2-0.21C2
为检验方程的有效性,对两株菌冻干后活菌数的数学模型进行统计分析,得到的方差分析结果,结果如表3所示。
P>0.10,说明模型或考察因素影响不显著;P<0.05说明模型影响显著;P<0.01说明模型影响极显著。从表3可以看出,根据回归方差分析显著性的检验,回归模型显著性检验P<0.01,说明该模型的预测性良好;并且失拟项P值为0.1192(P>0.10),说明实验的误差较小,回归方程与实际情况吻合程度较高,因此,可用此回归方程来代替实验中真实点对实验结果的预测。一次项中A的偏回归系数显著(P<0.05),说明脱脂奶粉对两株菌冻干存活率有显著影响。从分析中可以看出一次项A、C差异均达到极显著水平。在所确定的试验水平范围内,各因素对响应值的影响程度顺序为:A>C>B,即脱脂奶粉>甘油>海藻糖。3个因素中,海藻糖和甘油之间有极显著的交互作用。交互项AC的偏回归系数不显著(P>0.10),说明脱脂奶粉与甘油的交互作用对两株菌冻干存活率没有显著影响。二次项A2、B2、C2偏回归系数均显著,说明其对两株菌冻干存活率的影响均极显著(P<0.01)。
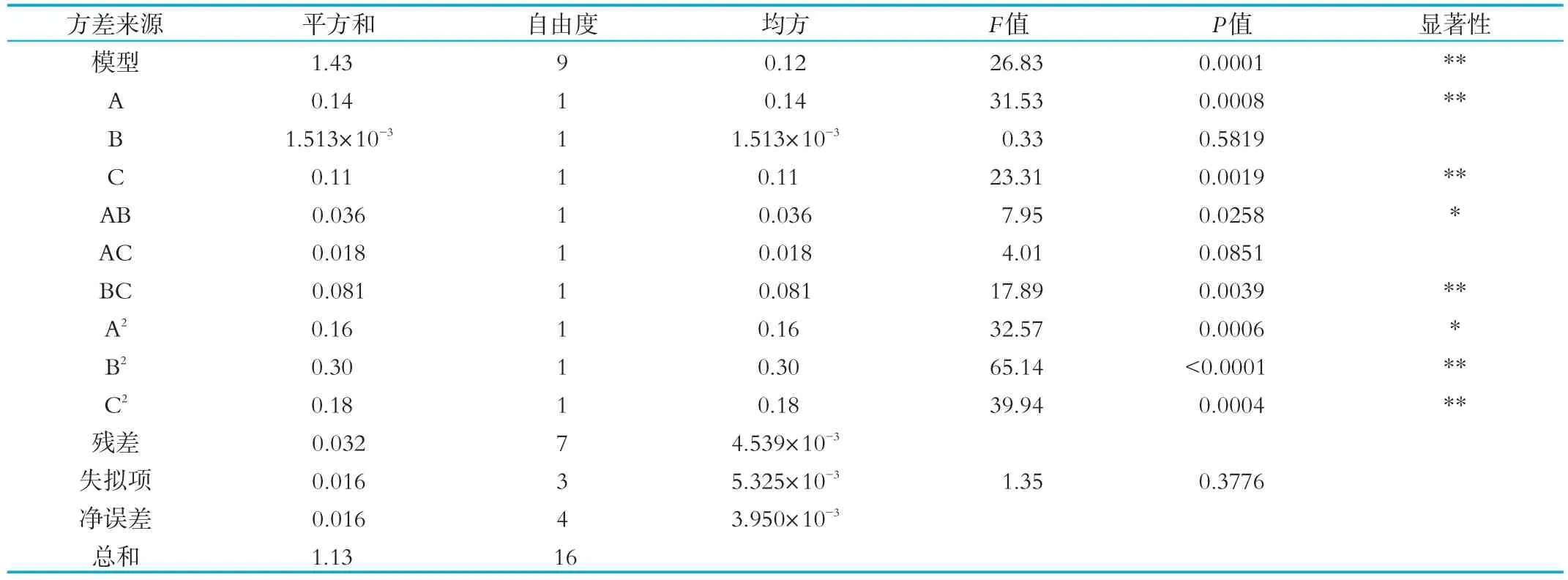
表3 以两株混合菌的活菌数为响应值的回归模型方差分析

表4 方程相关系数
由表4可知决定系数R2=0.9718,校正决定系数R2Adj=0.9356,说明该模型拟合度较好;信噪比较大说明模型有较高的可信度;变异系数CV=0.45%<5%,说明方程的重现性较好。这表明该模型自变量与指标值之间的线性关系显著,模型与实际实验的拟合性较好。因此,能够用此模型预测响应值随自变量的变化规律。
2.4.2 响应面分析
根据软件分析结果得出二次多项回归方程,做出三维立体响应面图,预测上述三个因素对两株菌冷冻干燥时菌得冻干存活率的影响。

图5 海藻糖和脱脂奶粉对两株菌冻干存活率的影响
如图5可知,随着脱脂奶粉添加量的增加,活菌数呈现出先增加后减少的趋势,而随着海藻糖添加量的增加,活菌数呈现缓慢增加的趋势,其中海藻糖添加量相对于茶多酚的添加量对活菌的影响不显著。由等高线图可以看出,等高线接近于椭圆,表明它们的交互作用显著,这与表3的结果一致。
由图6可知,在研究范围内,活菌数随着甘油和脱脂奶粉添加量的增加而增加,一定程度后开始减少。其中在冻干保护中甘油的添加量相对于脱脂奶粉的添加量的影响不显著,前者增大或减少的趋势不如后者明显。由等高线图可以看出,等高线接近于圆,表明它们的交互作用不显著,这与表3的结果一致。

图6 脱脂奶粉和甘油对两株菌冻干存活率的影响

图7 海藻糖和甘油对两株菌冻干后活菌数的影响
由图7可知,在研究范围内,随着海藻糖和甘油添加量的增加活菌数前期增加,后期减小。其中在海藻糖的添加量相对于甘油的添加量对活菌数的影响不显著,前者增大或者减少的趋势不如后者明显。由等高线图可以看出,等高线接近于椭圆,交互作用显著,这与表3的结果一致。
采用中心组合实验原理设计实验,得出了二次多元回归方程,对于方程求解得出的冻干保护剂的最佳组合为:脱脂奶粉添加量为14%、海藻糖添加量为6%、甘油添加量为4%。因最佳工艺条件不在表中,故需进一步的验证实验。在对两株菌进行冷冻干燥过程中,脱脂奶粉添加量为14%、海藻糖添加量为6%、甘油添加量为4%的冻干保护剂作用下两株菌的活菌数最高[18-19],活菌数约为5.9×109cfu/mL,因此确定冻干保护剂的最佳组合为脱脂奶粉添加量为14%、海藻糖添加量为6%、甘油添加量为4%。
3 结论
本实验研究在MRS培养基的基础上对碳源、氮源的进行优化,提高混合菌株的存活率;对培养后的菌液进行真空冷冻干燥,并对冻干过程中离心条件以及冻干保护剂进行优化。实验结果表明,两株菌在MRS培养基的碳源为麦芽糖,有机氮源为大豆蛋白胨,其他条件不变的情况下混合菌的存活率提高,通过真空冷冻干燥技术制备的冻干菌粉的活菌存活率高,可应用与食品、饲料等行业[20],同时也为工业化益生菌冻干菌粉制备提供理论依据。

