术中超声对肝肿瘤切除患者的应用价值
杜毅斌,王秀艳
同济大学附属同济医院超声诊断科,上海 200065
肝肿瘤是临床上常见的恶性肿瘤之一,据最近统计,肝肿瘤在全球范围内发病率居于第5位,死亡率居于肿瘤相关死亡的第3位。肝癌的首选治疗方案即手术切除,但既往研究发现肝肿瘤患者切除术后一年复发率可达18%[1]。除了肝肿瘤的诱因无法去除外,与手术中未能发现一些微小病灶及肝血管内的瘤栓息息相关。既往肝肿瘤手术切除标准常根据术前超声(preoperative ultrasonography POUS)、CT及术中超声检查(intra-operative ultrasonography, IOUS)的检查结果,但术前超声受皮肤、皮下组织、肌肉、骨骼等多种因素的干扰[2],且经体表超声检查采用较低频率,成像效果不佳;CT和MRI对于小于1 cm的微小病灶检测水平有限[3],所以导致一些肝内转移病灶漏诊,肝肿瘤切除术后复发率高。而IOUS可直接探查肝部组织,排出了其他组织因素的干扰。因此,IOUS对于肝外科手术极具价值。近年,随着超声技术的不断优化和超声设备的不断改进,以及术前超声经验的积累,术中超声的临床应用率不断提高。为了提高肝肿瘤切除术后患者的预后,降低肝肿瘤复发率,提高对于肝脏微小病变的检出率,有必要探索术中超声对于肝肿瘤切除患者的应用价值。基于此,我们将通过对比术前超声、CT和术中超声检测肿瘤病灶检出率以评估术中超声的应用价值。
1 研究对象与方法
1.1 研究对象
选择自2013年1月—2018年5月由同济大学附属同济医院收治的63例肝脏肿瘤患者。其中男性患者43例,女性患者20例,年龄41~78岁,平均(58.75±16.22)岁,其中81%患者有肝硬化病史。纳入标准:所有患者均经超声、CT或MRI检查发现肝实质性肿块,且具有肝肿瘤典型影像学表现而非巨块型及弥漫型。外科手术排除标准:(1)术前肝功能Child-Pugh 分级为C级。(2)合并严重心、肾等重要脏器功能衰竭者。(3)慢性肝病、肝硬化、生殖腺肿瘤等非肝肿瘤干扰性疾病。(4)伴有免疫系统疾病或活动性出血等疾病者。(5)有超声检查禁忌证患者。
1.2 研究方法
1.2.1 检查前准备
患者在进行POUS和CT检查前,应禁食6 h,CT检查前应嘱饮用温水500 mL,并告知其检查相关事项,为患者提供呼吸训练(均匀、平静的缓慢呼吸),以避免呼吸频率的变化导致图像质量差。
1.2.2 术前检查
术前行超声检查采用HITACHI VISION Ascendus型超声仪及1~5 MHz探头,常规检查探测肝脏,描述和记录病变的位置、大小、数目及与血管毗邻及侵袭情况。
术前CT检查采用西门子CT扫描仪进行肝平面扫描(扫描参数:200~300 MA,120 kV,层距5.0 mm,层厚3.75 mm,螺距1.375∶1),扫描位置自膈顶至肝部下,确定肝肿瘤病变情况。
1.2.3 术中超声检查
术中超声采用HITACHI VISION AVIUS型超声仪及1~5 MHz探头。在探头表面涂耦合剂后用一次性无菌套套住后直接置于肝脏表面[4],探头应先置于肝段4a和4b之间以观察肝门,然后在肝表面移动进一步评估肿瘤的位置、大小、数目等情况以及与门静脉,肝动脉,胆管的关系,并确定门静脉及肝静脉内是否存在癌栓。必须确认在术前超声分期中检测到的病灶位置,再描述新的病变灶,建议对每个节段进行标准化的顺序研究,避免有未经探测的肝叶。
1.3 统计学分析
数据采用SPSS 19.0统计软件处理。检出率采用χ2检验,组间比较采用独立样本t检验,标准水准α=0.05,P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料分析
63例肝肿瘤患者中患原发性肝癌者47例,转移性肝癌者6例,肝血管瘤患者10例。肝细胞癌的大体分型可分为微小癌(单个肿瘤直径≤1 cm),小肝癌(1~3) cm,中肝癌(3~5) cm,大肝癌(5~10) cm,巨块型肝癌(10 cm以上),弥漫型肝癌(肝内散在分布小癌灶)[5],经病理切片检查共发现81处病灶,其中微小肝癌(直径≤20个,小肝癌31个,中肝癌21个和大肝癌9个。其中术中发现瘤体80个,比术前新发现15个(图1),主要为微小病灶,见表1。
2.2 POUS、CT和IOUS的检出率比较
POUS组病灶检出数为65,漏诊16处,检出率为80.2%,CT组病灶检出数为71处,漏诊10处,检出率为87.6%,IOUS组病灶检出数为80,漏诊1处,检出率为98.7%,IOUS对于肝肿瘤病灶的检出率显著高于POUS组,差异具有统计学意义(P< 0.001);同时IOUS组也显著大于CT组,差异均同样具有统计学意义(P= 0.005)。
2.3 POUS、CT和IOUS对于肝肿瘤敏感度比较
IOUS组对于微小肝癌、小肝癌的敏感度均明显大于术前超声组,差异具有统计学意义(P=0.008、P=0.010),且IOUS对于微小肝癌、小肝癌的敏感度也明显大于CT组,差异均具有统计学意义(P=0.037、P=0.039)。CT组的微小病灶敏感度同样高于POUS组,但远不及IOUS组。而就大肝癌而言,IOUS虽检出敏感率较POUS组高,但差距并无统计学意义(P=0.147>0.05)。
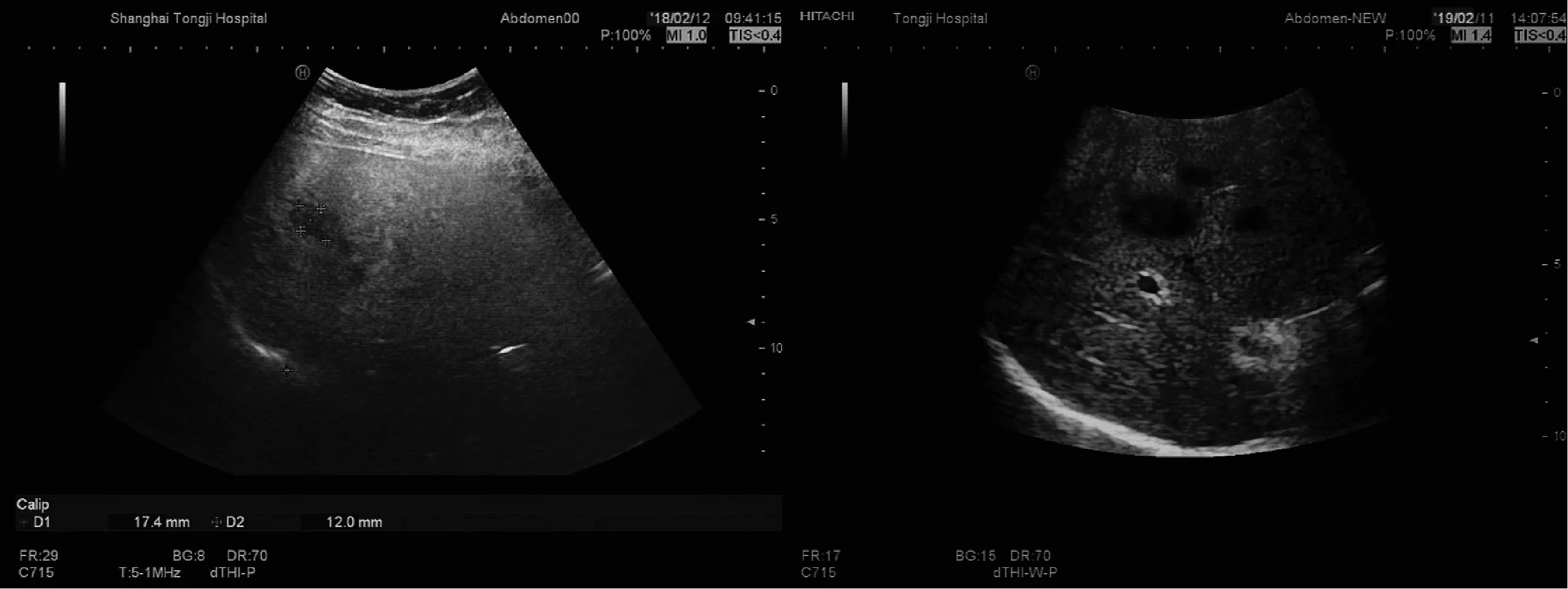
图1 同一病灶术前超声与术中超声的比较
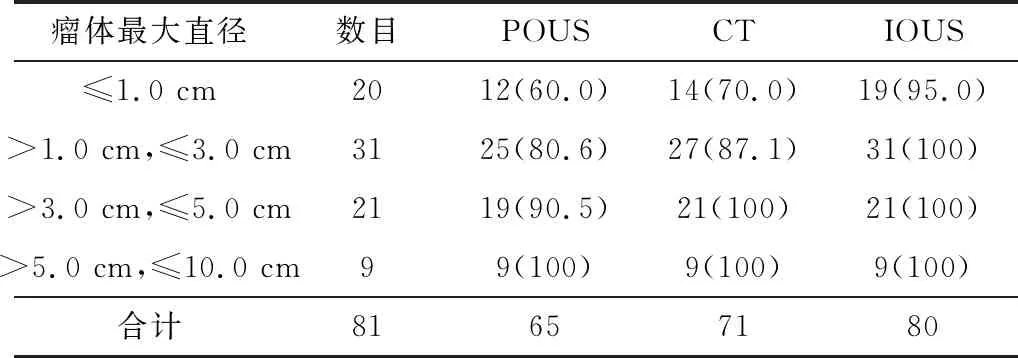
表1 POUS、CT、IOUS检查的一般资料比较
3 讨论
由于乙肝病毒等肝炎病毒在我国的高发性,肝肿瘤是我国最常见的肿瘤之一[6-7],目前临床上治疗肝肿瘤的主要手段是手术切除[8],手术术式的选择取决于肿瘤的类型,大小,发生部位,是否多发。虽然随着如今科技的发生发展,对于肝肿瘤的诊断已趋于成熟,但是对于这些细微具体的情况,术前超声检查由于皮肤、皮下组织,腹部脏器等层层阻碍,低频率超声探头的选定导致图像清晰度的不足[9-10],且由于我国肝肿瘤普遍由肝硬化基础上发展而来,纤维组织包绕的再生结节同样造成干扰[11]。种种因素导致术前检查对于肿瘤的类型,大小,发生部位,是否多发的了解不足,从而使术式的选择不恰当,对于肿瘤的清除不彻底,这也是日后肿瘤复发的重要因素,加之肝脏肿瘤的危险因素例如病毒感染,饮酒等因素难以去除,我国的肝肿瘤复发率居高不下。为了降低肝脏肿瘤复发率,延长患者存活率,提高肝脏肿瘤切除患者术后预后情况,术中超声也应用至肝外科手术中。
目前IOUS主要作用为可以精准定位病变位置以及其与周围胆道和血管之间的关系,确定胆道和血管内是否收到侵袭、存在癌栓转移,检查肝脏解剖结构,以便根据肿瘤学原理制定手术策略,以便尽可能多的保留自体肝脏[12]。与常规POUS相比,IOUS超声图像的分辨率更高,因为探头与肝脏直接接触,避免了腹壁对声波的吸收。 同时,术中探针可以放置在肝的不同表面,从不同的角度研究病变,更容易发现一些隐匿病变,不易漏诊,为术者提供更多信息。不仅如此,IOUS中,超声检测获得的信息可以与术中触诊和视诊得到的消息相互补充。除此之外,IOUS还与其他治疗手段联合应用,比如射频消融、微波热凝、射频消融及注射无水乙醇和术中肿瘤的局部灌注化疗。对于早期肝肿瘤和一些残留不易清除的微小病灶,IOUS联合经皮或腹腔镜射频消融即可达到切除效果[13-15]。而本研究主要以63例肝脏肿瘤患者为观察对象,通过对患者进行POUS、CT和IOUS检查和术后病理切片对比研究IOUS对肝肿瘤切除患者的临床应用价值。
医师从辅助检查手段中获取的信息越丰富,对于肝脏肿瘤的了解越透彻,手术才行之有效,倘若遗留未被切除的肿瘤,肝肿瘤的复发进程会大大加速。本研究结果表明IOUS在肝脏肿瘤的检查中漏诊率极低,POUS和CT组患者漏诊率明显高于IOUS组,差异有有统计学意义(P<0.05)。且IOUS对于微小病灶的敏感性极高,在微小病灶及小病灶诊断中远比POUS组和CT组有优势,差异有有统计学意义(P<0.05)。该结果提示,IOUS的临床应用对肝脏肿瘤的切除极有裨益,能够提供患者的预后和预期寿命。
本研究研究人群只筛选了本院一段时间内就诊的患者,样本数较小,只能初步判断IOUS具有提高肝肿瘤切除患者的预后的价值,需要大数据样本才能系统的证明其应用价值。此外,由于超声的非曲面断层扫描的特质,即使IOUS对于肝肿瘤敏感性较,也需与术前断层扫描技术如CT何MRI等获得的信息相结合。
随着美国对肝脏的研究中引入超声造影剂,术中超声造影进一步发展为术中对比增强超声造影(intra-operative contrast enhanced ultrasound, CEIOUS)。目前,IOUS被认为是肝外科的一种宝贵的技术手段,甚至其应用应该被认为是强制性的,这也预示着CEIOUS将有更广泛的应用,现有对于CEIOUS的研究发现CEIOUS的主要作用是对性质不确定的病变进行特质性的扫描并检测新病变[16]。经腹部造影增强超声(CEUS)和CEIUOS的主要优点是,它们允许连续的实时成像 ,因此它们提供更多有关肿瘤的信息,据研究,单独与其他技术相比较,CEIOUS的敏感度和特异性大幅度提高[17]。当整体术前检查分析(CT+POUS+CEUS)时,CEIOUS在敏感度方面没有变化,但在肝脏病变特异性方面有明显提高。此外,即使在整体术前检查分析上(CT+POUS+CEUS),CEIOUS的应用仍修改了44.4%的患者的手术策略[18]
综上所述,IOUS是肝脏手术中非常宝贵的工具,可用于术中再分期,也可用于手术过程中的新病灶的发现和手术策略的指导。随着超声技术的不断发展,超声的使用对于肝外科医师将成为和手术技能一样必备的技能之一。

