UV/Cl工艺对三氯生的去除与降解机理研究
周思琪,李佳琦,杜尔登*,李 淼,刘 翔
UV/Cl工艺对三氯生的去除与降解机理研究
周思琪1,李佳琦1,杜尔登1*,李 淼2,刘 翔2
(1.常州大学环境与安全工程学院,江苏 常州 213164;2.清华大学环境学院,北京 100084)
对UV/Cl高级氧化工艺降解水中广谱抗菌剂三氯生(TCS)进行研究,对比单一UV、单一Cl和UV/Cl工艺对TCS的去除效果.考察UV光强、余氯初始浓度、溶液pH值和氨氮浓度等因素对反应的影响,探究TCS在UV/Cl工艺中的降解机理,评估其生态风险.结果表明,与单一UV、单一Cl相比,TCS在UV/Cl工艺中降解效果较好,反应符合准一级反应动力学,降解速率常数随UV光强、余氯初始浓度增大而增大,随NH4+-N浓度的增加而减小.基于HRMS Q-TOF解析出17种中间产物,提出了降解反应路径.发光细菌毒性分析和ECOSAR预测均表明,TCS在UV/Cl工艺中产生毒性较高的中间产物,随着反应的进行,产生了毒性较低的中间产物,生态环境风险得以减少.
三氯生(TCS);UV/Cl;高级氧化工艺;影响因素;降解机理;毒性评价
药品和个人护理用品(PPCPs)包括各种药用化合物,以及日常个人护理用品,如化妆品、杀菌剂、洗护用品、芳香剂等,涵盖范围广泛[1-2].
三氯生(TCS)是一种典型的PPCPs类新兴污染物,作为广谱抗菌剂,广泛应用于生活用品中.TCS全球每年产量约1500t,其中96%以上使用后排入污水系统并最终进入环境[3].研究表明, 在河流、湖泊、海洋、沉积物、土壤、甚至哺乳动物体内检测出TCS[4].TCS对淡水水生物种(绿藻、水蚤、鱼类)具有很高的毒性,会引起细菌耐药性、内分泌紊乱,甚至增加致癌物的形成[5].因此,TCS对水生生物和人体健康的影响不容忽视.
UV/Cl工艺利用紫外线照射氯产生羟基自由基(·OH)和氯自由基(·Cl)[6-9],两者结合,能够有效去除有机污染物.UV/Cl工艺对典型PPCPs类污染物,如布洛芬、卡马西平、莠去津等都有良好的去除效果[10-11].作为一种新型的高级氧化工艺,UV/Cl工艺在水处理方面具有潜在的应用前景.
本研究采用UV/Cl高级氧化工艺降解TCS,考察不同因素(UV光强、余氯初始浓度、溶液pH值、氨氮浓度)对TCS降解效果的影响,解析反应过程中的降解中间产物,评价TCS及其中间产物的生态风险,以期为水中TCS的去除和风险评价提供理论依据,为水质安全提供技术保障.
1 材料与方法
1.1 实验试剂
TCS(色谱纯)购自于阿拉丁(上海),实验所配制储备液浓度4mg/L. NaClO(有效氯含量6%~14%)购自于阿拉丁(上海),使用DPD分光光度法测定游离余氯浓度,储备液游离余氯浓度为621mg/L.甲醇(HPLC级)购自于Sigma公司(美国).其他药剂(NH4)2SO4、NaOH、HCI、Na2HPO4·12H2O、KH2PO4、Na2SO3购自上海国药集团,均为分析纯.实验用水均采用超纯水(电导率18.3MΩ·cm).
1.2 实验装置
本实验的UV光反应装置采用波长254nm的UV汞灯(上海飞利浦),溶液配制在40mL表面皿中,通过磁力搅拌器(HJ-6,江苏金怡)确保反应均匀.调节灯管与反应液表面的距离来改变UV强度.通过紫外辐射计(UV-B,北师大光电仪器厂)确定光强.
1.3 实验方法和过程
取20mL浓度为4mg/L的TCS溶液,使用0.2mol/L磷酸盐缓冲液、氢氧化钠和稀盐酸调节溶液pH值.然后投加1~5mg/L的NaClO溶液于TCS溶液中,打开UV汞灯,开始降解反应.在不同反应时间取样,立即投加过量Na2SO3溶液(5g/L)终止反应,用HPLC-MS/MS(Thermo TSQ quantum Access Max)测定剩余TCS浓度.考察单一UV、单一Cl和UV/Cl工艺对TCS的去除效果的影响,探究不同因素(UV光强、余氯初始浓度、溶液pH值、氨氮浓度)对UV/Cl工艺降解TCS的影响.所有反应均进行3次平行实验,取平均值.
1.4 TCS及其中间产物分析
使用HPLC-MS/MS测定剩余TCS浓度,色谱条件:Thermo Accucore C18色谱柱(3mm×50mm,2.6 μm); 采用梯度洗脱程序,流动相为水和甲醇,流速0.6mL/min;柱温25℃.质谱条件:SRM扫描,负离子模式,TCS子母离子对/为286.8/35.3,轰击电压43V.
根据美国EPA 1694标准方法[12],对TCS反应液进行固相萃取预处理.
使用HRMS Bruker Impact II Q-TOF质谱仪(Bruker Daltonics Inc, USA)鉴别降解中间产物,色谱条件为:Waters HSS T3C18色谱柱(2.1mm×50mm, 1.7μm);流动相为甲醇和水;质谱条件:负离子模式, CID碎片模式,碰撞能量值(CE%)20%~50%.
1.5 生态毒性风险评价
选用费氏弧菌()作为指示细菌进行急性毒性实验,考察UV/Cl工艺过程中TCS及其中间产物的毒性变化.采用生物毒性分析仪(ATD- P1,北京金达清创)测定发光细菌的发光强度,利用相对抑制率评估急性毒性,每个样品测定3组平行数据,前后设置2组空白对照.由式(1)计算发光细菌发光强度的相对抑制率():
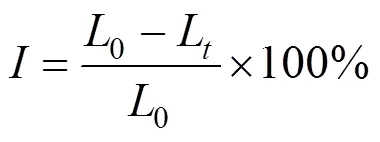
式中:L为样品发光强度;0为阴性对照发光强度.
2 结果与讨论
2.1 单一UV、单一Cl、UV/Cl工艺反应动力学
在光强1000 μW/cm2,TCS初始浓度4mg/L,余氯初始浓度2mg/L,溶液pH值为7.0条件下,分别考察单一UV、单一Cl和UV/Cl工艺对TCS降解的影响,并用准一级反应动力学方程拟合实验数据.结果见图1和表1.
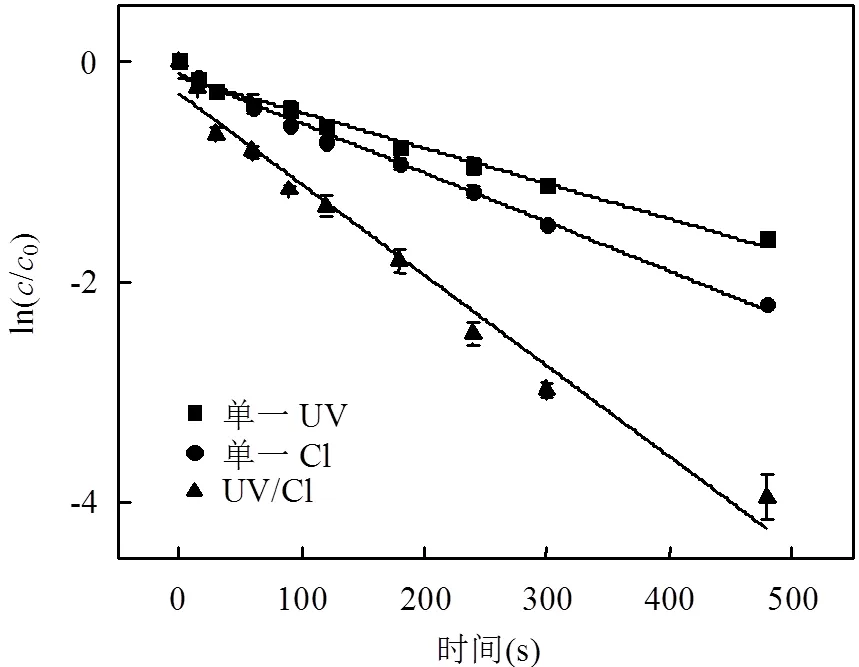
图1 单一UV、单一Cl、UV/Cl对TCS降解的影响 Fig.1 Effect of single UV photolysis, single chlorination, the UV/Chlorine process on TCS degradation
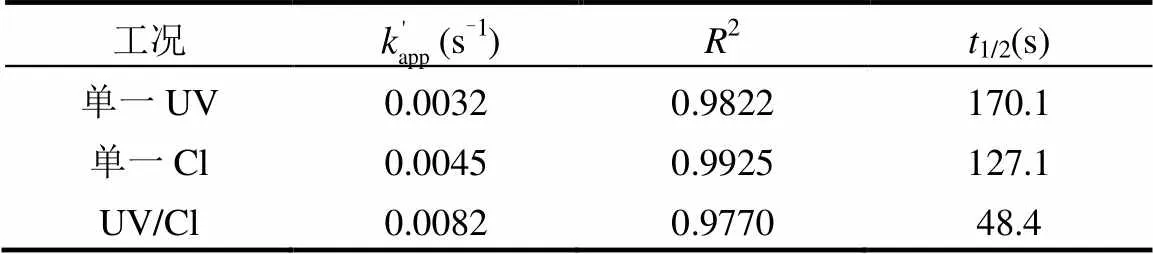
表1 不同工况下TCS的准一级反应动力学模型参数 Table 1 Parameters of pseudo-first-order kinetics at different conditions of TCS degradation
由图1和表1可知,反应300s, TCS在单一UV和单一Cl条件下分别去除67.5%和77.3%.而在UV/Cl工艺中去除率达100%.与单一UV,单一Cl相比,UV/Cl工艺明显提高TCS的去除率.由式(2)、(3)得, TCS的3种降解反应均符合准一级反应,反应速率常数分别为0.0032,0.0045和0.0082s-1,反应相关系数2为0.9822,0.9925和0.9770.由此可知,TCS在UV/Cl工艺中的去除效果最好.
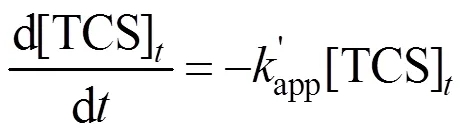
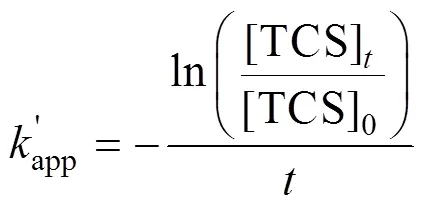
式中:[TCS]表示时刻反应体系中TCS浓度, mg/L;[TCS]0表示TCS初始浓度,mg/L;为准一级表观动力学速率常数,s-1.
ClO
-
+H
2
O⇌HClO+OH
-
(4)
由式(4)、(5)可知,NaClO在水溶液中以HClO和ClO-2种形式存在.经UV照射,HClO/CIO-可以生成·OH和·Cl两种自由基,其中·OH是非选择性氧化剂,能够与有机基团反应, ·Cl是强氧化剂,对亲电官能团具有较高的反应活性[6,13-14].两者结合加速了对TCS的氧化降解.
2.2 UV光强对降解反应的影响
考察TCS初始浓度4mg/L,余氯初始浓度2mg/L,溶液pH值为7.0的条件下,不同光强对TCS反应的影响,结果见图2和表2.
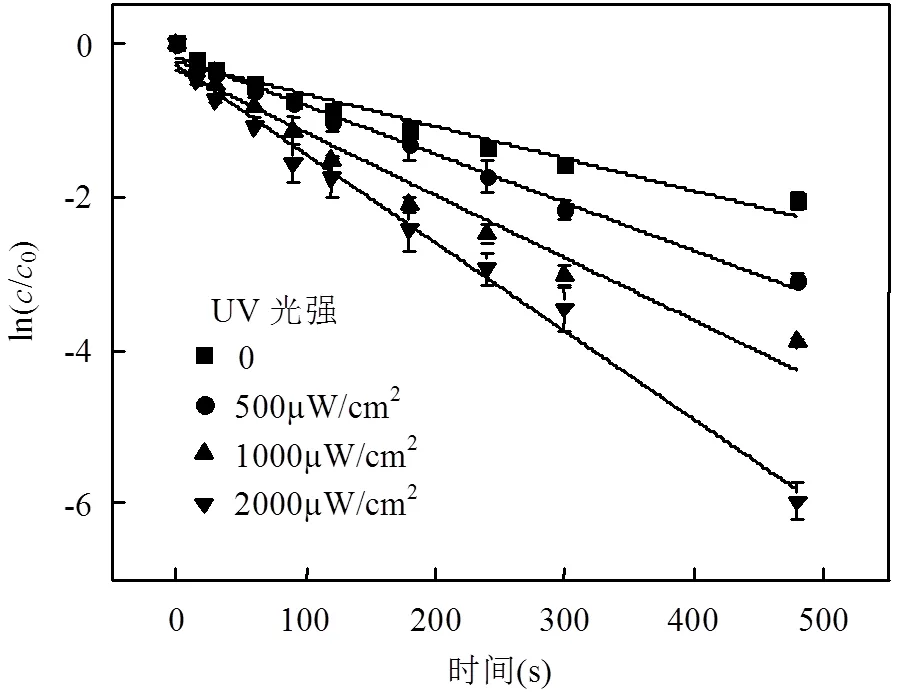
图2 UV光强对UV/Cl工艺降解TCS的影响 Fig.2 Effect of UV intensity on TCS degradation by the UV/chlorine process
图2和表2表明,光强对氯氧化TCS的影响效果显著.随着光强的增强,反应速率常数逐渐增加.当光强从0增加到2000μW/cm2时,反应速率常数由0.0042s-1升高为0.0115s-1.半衰期也由105.5s下降到34.4s.主要因为光强影响自由基的生成,光强增大,产生的自由基增多.在余氯初始浓度一定的条件下,单位时间内光强越大,与TCS反应的自由基越多.从而加快TCS的降解反应速率.此外,反应速率常数和光强具有明显的线性相关性(图3).李青松等[15]使用紫外/过硫酸钠(UV/SPS)降解TCS具有相似的结论.
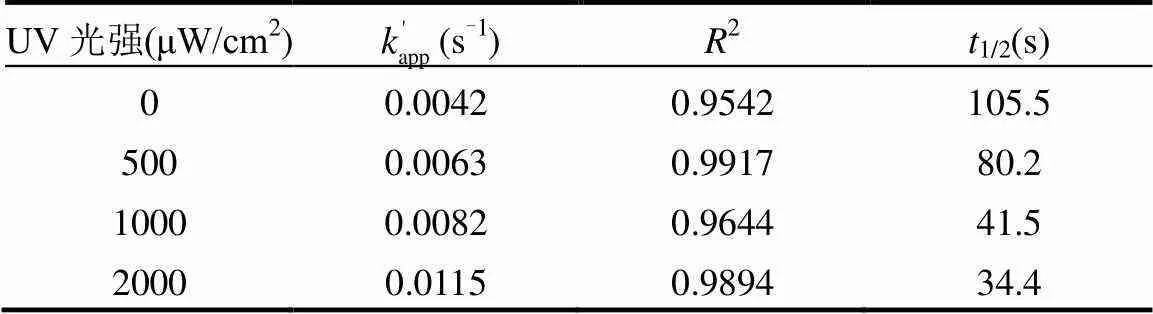
表2 不同UV光强下TCS的准一级反应动力学模型参数 Table 2 Parameters of pseudo-first-order kinetics of TCS degradation at different UV intensities

图3 UV光强对反应速率常数的影响 Fig.3 Influence of different UV intensities on the
2.3 余氯初始浓度对降解反应的影响
改变余氯初始浓度,考察其对TCS降解的影响,其他条件:TCS初始浓度4mg/L,光强500 μW/cm2,溶液pH值为7.0.结果见图4和表3.
从图4和表3可知,余氯初始浓度增加,TCS反应加快,反应速率常数逐渐增大.当溶液中余氯浓度从1mg/L增加至5mg/L,反应速率由0.0059s-1增加为0.0138s-1.半衰期也由105.2s减小到21.1s.拟合余氯初始浓度和反应速率常数,相关系数为0.9812,线性关系良好(图5).
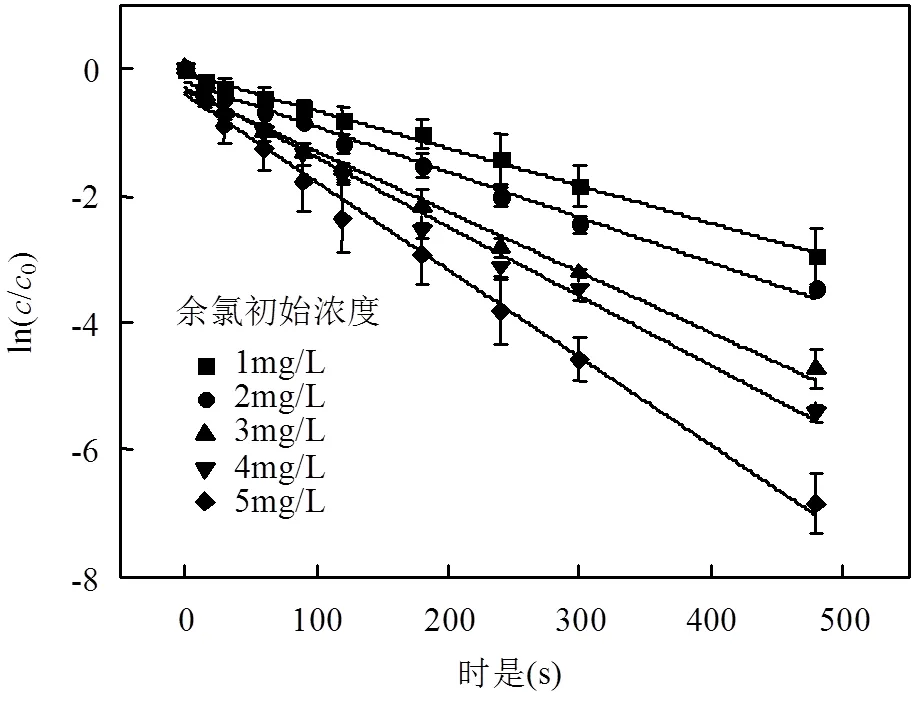
图4 余氯浓度对UV/Cl工艺降解TCS反应的影响 Fig.4 Effect of free chlorine residual on TCS degradation by the UV/chlorine process
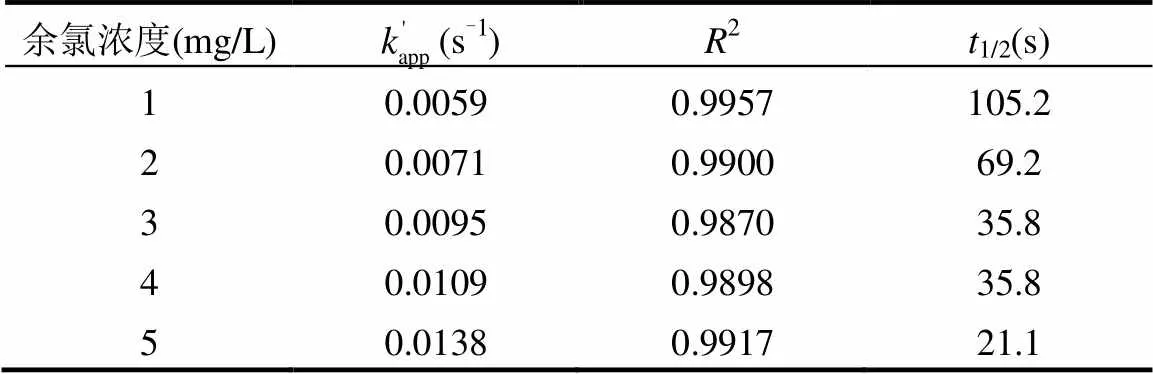
表3 不同余氯浓度下准一级反应动力学模型参数 Table 3 Parameters of pseudo-first-order kinetics of TCS degradation at various initial residual chlorine dose
TCS初始浓度一定时,余氯初始浓度增加即生成的HClO数量增加,促使产生更多的·OH和·Cl,从而加速TCS的氧化反应速率[16].
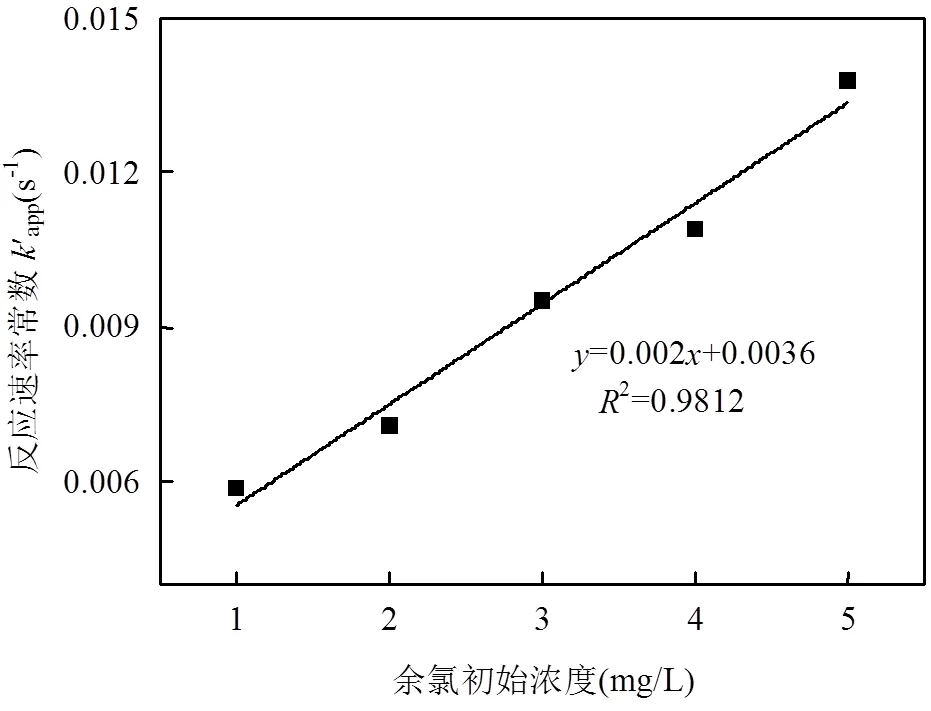
图5 余氯初始浓度对反应速率常数的影响 Fig.5 Influence of various initial residual chlorine dose on the
2.4 溶液pH值对降解反应的影响
在光强500μW/cm2,TCS初始浓度4mg/L,余氯初始浓度2mg/L条件下,用氢氧化钠和盐酸调节pH值,考察不同溶液pH值对反应的影响.结果见图6和表4.
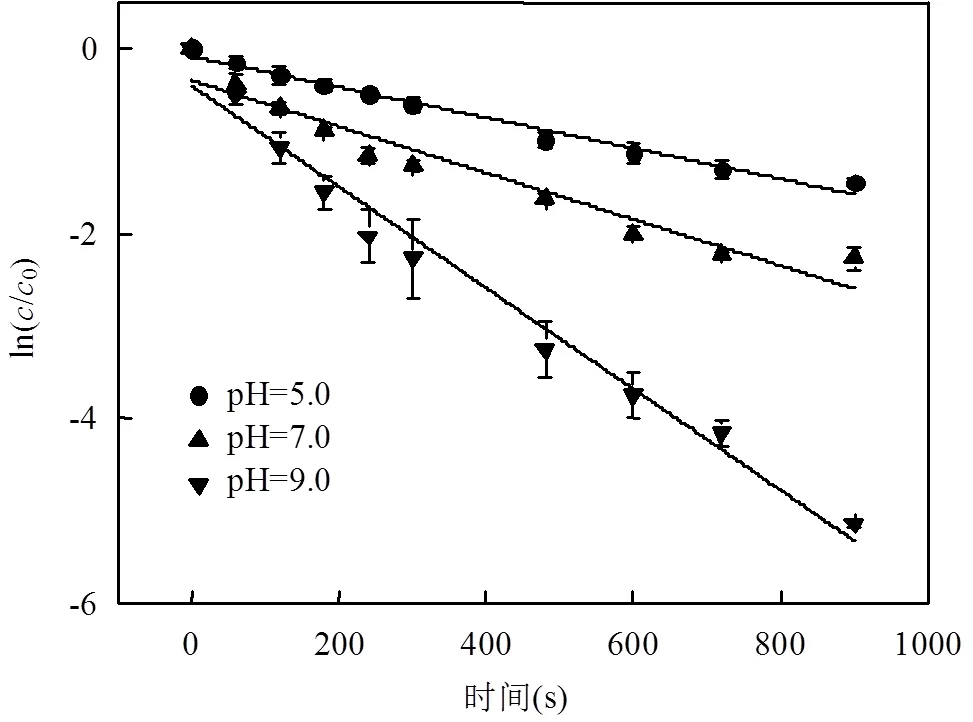
图6 pH值对UV/Cl工艺降解TCS反应的影响 Fig.6 Effect of pH value on TCS degradation by the UV/chlorine process
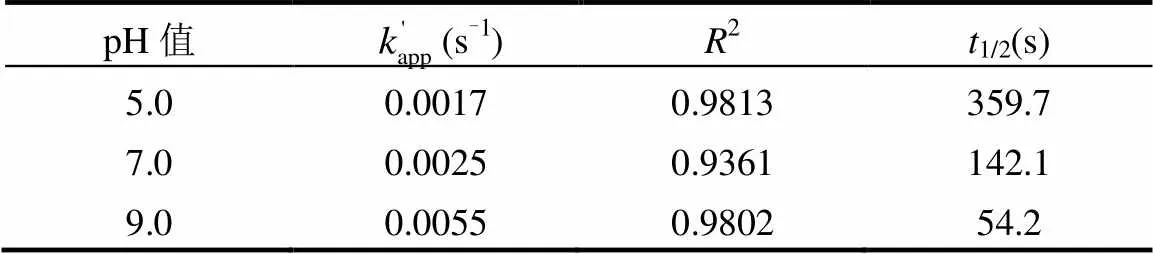
表4 不同pH值下TCS的准一级反应动力学模型参数 Table 4 Parameters of pseudo-first-order kineticsof TCS degradation at different pH values
由图6和表4可知, UV/Cl工艺中,TCS在不同溶液pH值内均有去除效果,且在碱性条件中的去除效果优于酸性条件.当溶液pH值从5.0增加到9.0时,反应速率常数由0.0017s-1升高到0.0055s-1.随着溶液pH值增大,TCS去除率明显升高,在溶液pH值为9.0时去除效果最好.
在酚类亲电取代反应中,反应速率与芳香烃的形态有关.离子态物质的亲电性较强,与自由基的反应速率是分子态的104~105倍[17]. TCS的pKa为8.1,当溶液呈碱性时,TCS以离子态的形式存在,而TCS在酸性溶液中大部分以分子态的形式存在,故碱性溶液中TCS的降解速率高于酸性溶液中[18].
2.5 氨氮浓度对降解反应的影响
考察光强500μW/cm2,TCS初始浓度4mg/L,余氯初始浓度2mg/L,溶液pH值为7.0时,氨氮浓度对反应的影响.结果见图7和表5.
由图7和表5可知,随着氨根离子浓度的增加, TCS在UV/Cl工艺中的降解速率逐渐降低.当氨根离子浓度从0升高到4mg/L,反应速率常数从0.0044s-1减少至0.0016s-1.900s内TCS的去除率从98.7%下降至71.7%.氨氮浓度和反应速率常数成明显负相关(图8),说明溶液中氨根离子对TCS的去除有明显抑制作用.溶液中的氨根离子先与NaClO溶液反应,降低HClO/CIO-的浓度,从而减少·OH和·Cl的生成量,因此TCS在UV/Cl工艺中的反应速率降低[19].
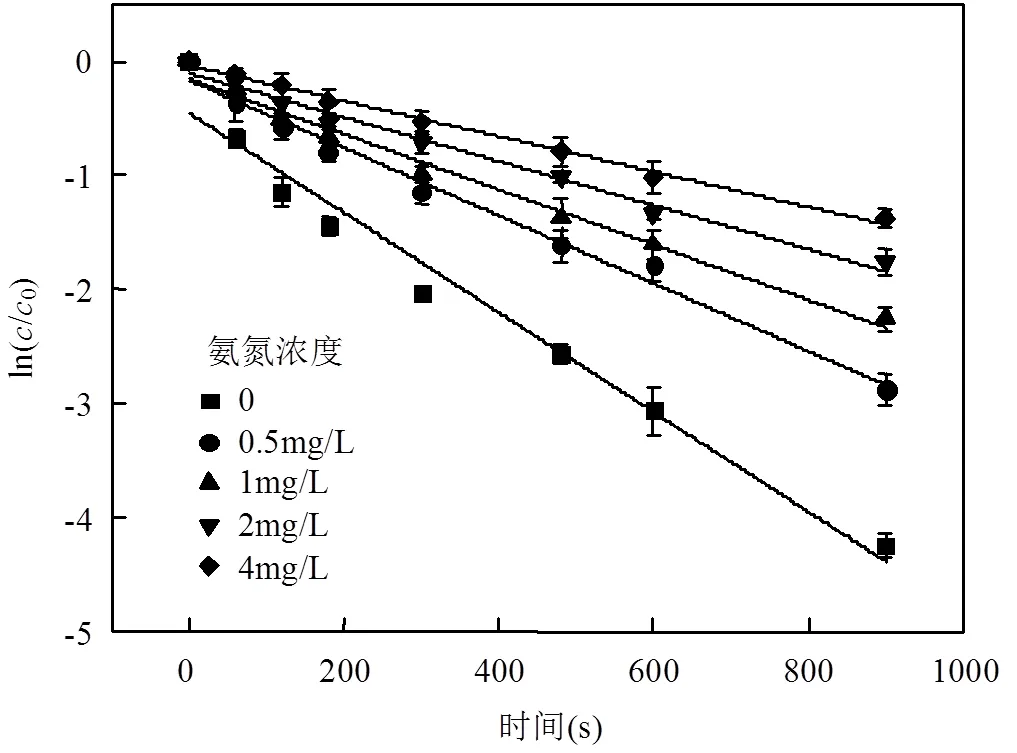
图7 氨氮浓度对UV/Cl工艺降解TCS反应的影响 Fig.7 Effect of ammonia concentration on TCS degradation by the UV/chlorine process
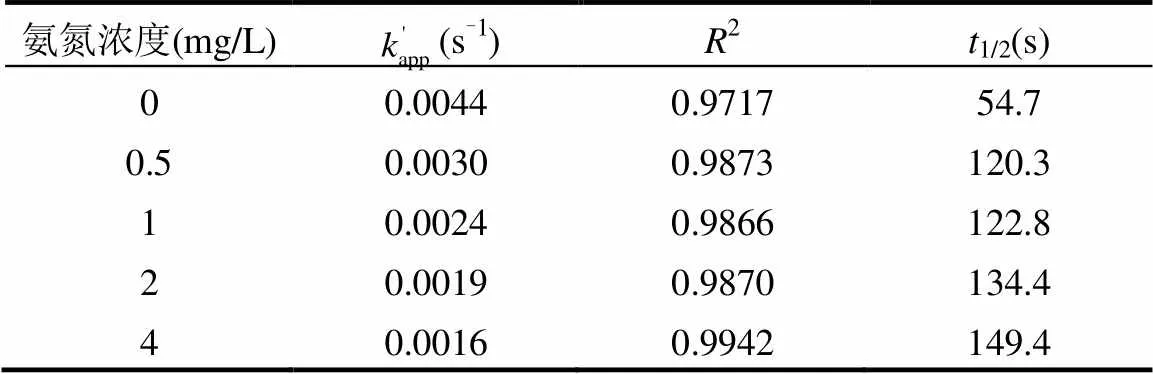
表5 不同氨氮浓度下TCS的准一级反应动力学模型参数 Table 5 Parameters of pseudo-first-order kinetics of TCS degradation at different ammonia concentrations
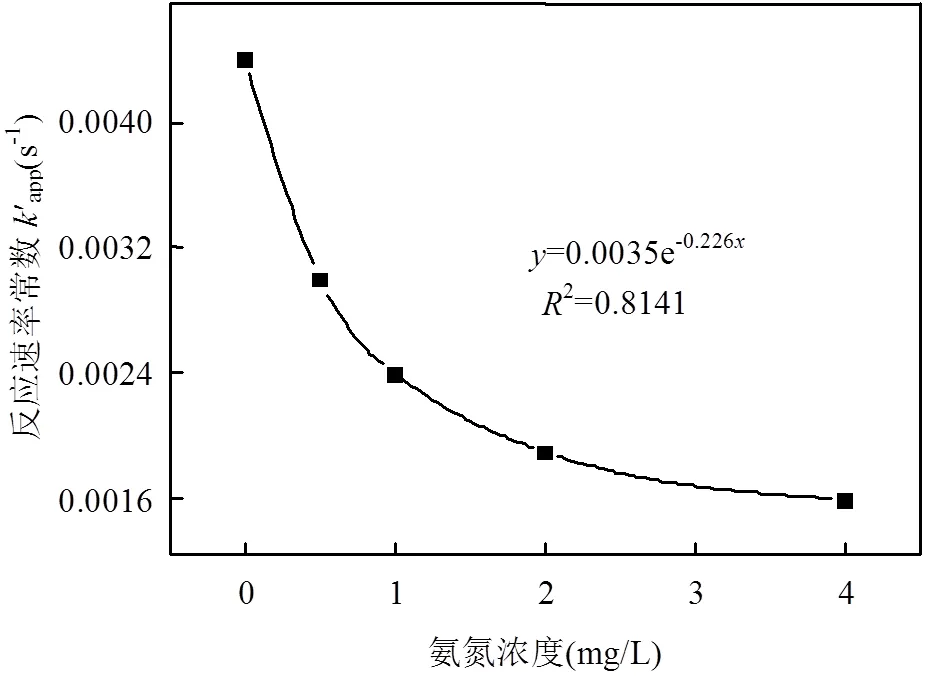
图8 氨氮浓度对反应速率常数的影响 Fig.8 Influence of ammonia concentrations on the
2.6 中间产物与降解机理
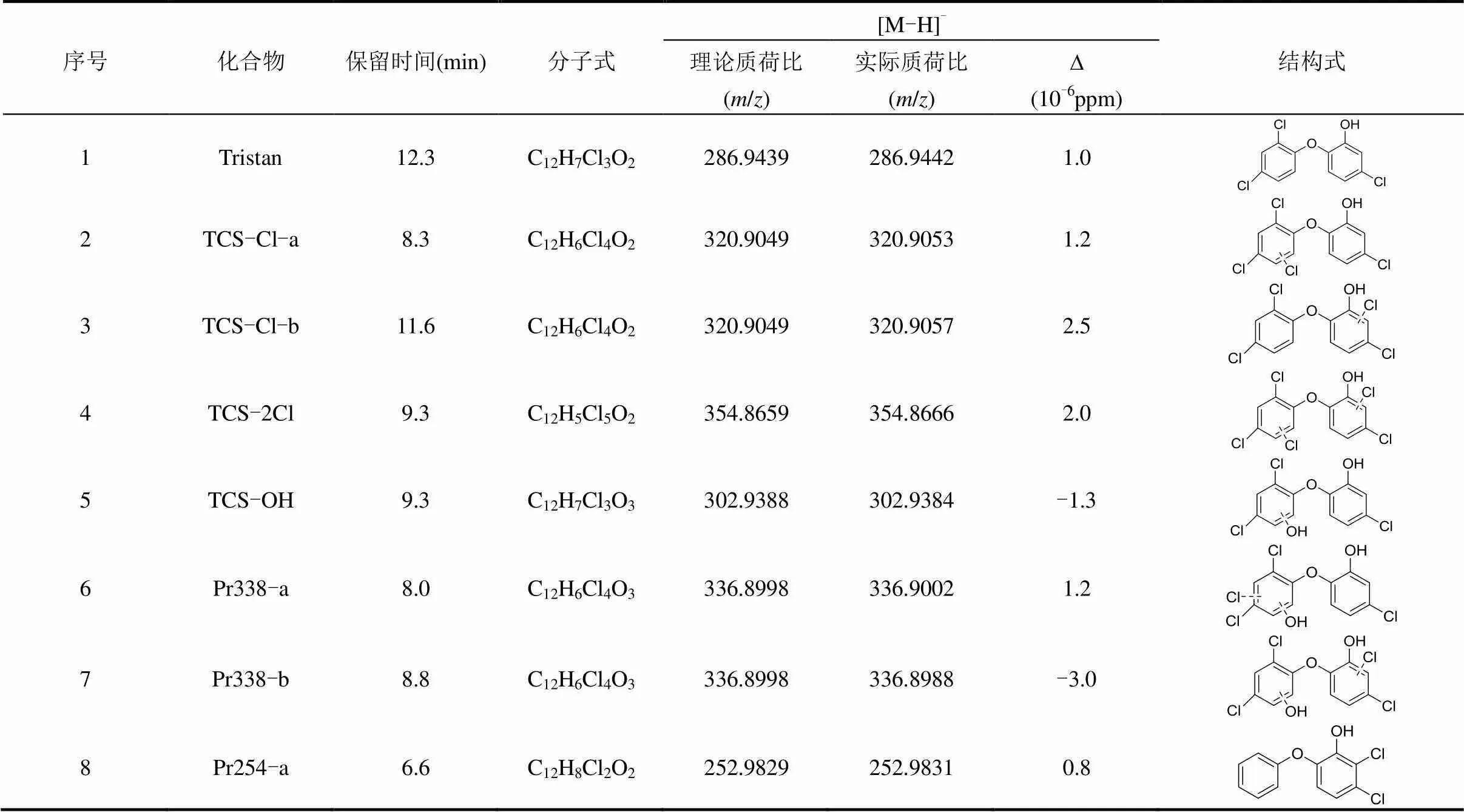
表6 TCS及降解中间产物质谱参数 Table 6 Mass spectrum parameters of TCS and its intermediates
续表6

序号化合物保留时间(min)分子式[M-H]-结构式 理论质荷比(m/z)实际质荷比(m/z)∆(10-6ppm) 9Pr254-b12.3C12H8Cl2O2252.9829252.98310.8 10Pr236-a6.6C12H9ClO3235.0167235.01690.9 11Pr236-b12.3C12H9ClO3235.0167235.01680.4 12Pr250-a14.4C12H7ClO4248.9960248.99600.0 13Pr250-b16C12H7ClO4248.9960248.99610.4 14Pr1249.1C6H4O3123.0088123.0087-0.8 15Pr144-a12.3C6H5ClO2142.9905142.99060.7 16Pr144-b13.2C6H5ClO2142.9905142.99060.7 17Pr162-a0.9C6H4Cl2O160.9566160.95670.6 18Pr162-b1.3C6H4Cl2O160.9566160.9564-1.2
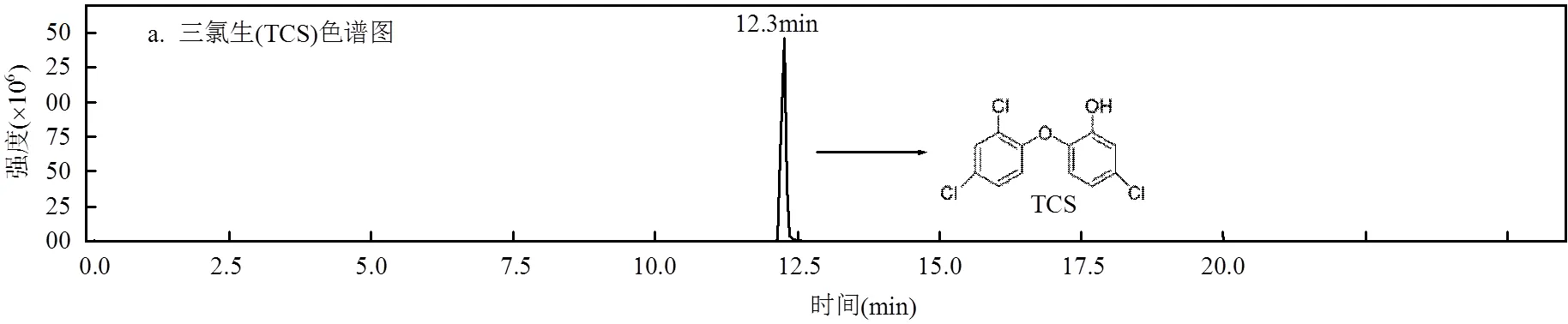
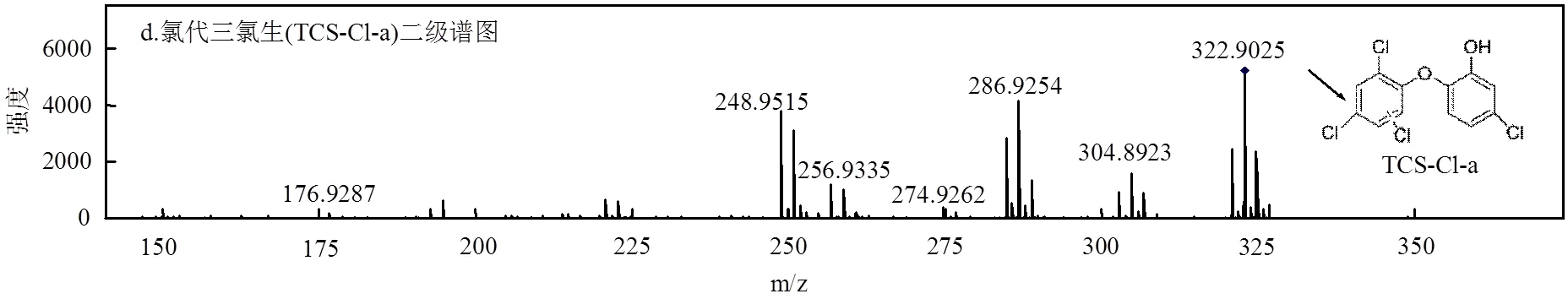
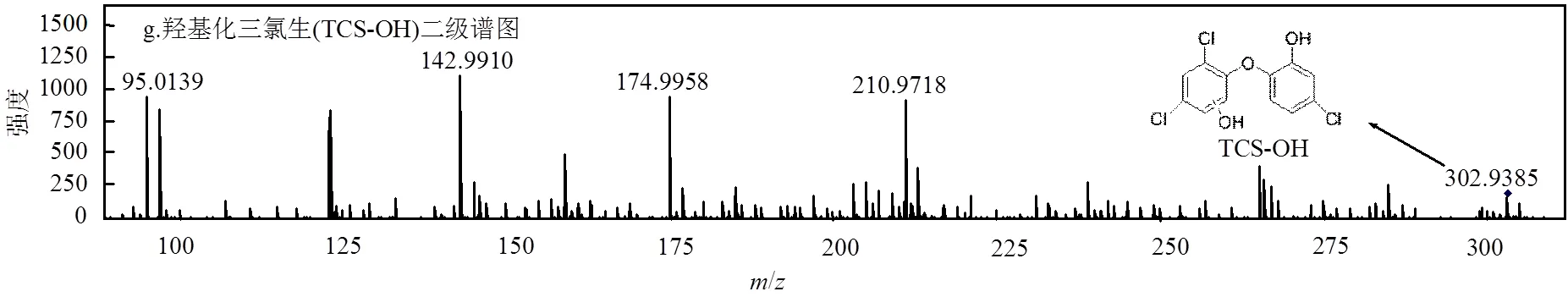
图9 TCS、氯代TCS、羟基化TCS的色谱图、二级质谱 Fig.9 Chromatogram and MS2spectrums of TCS ,TCS-Cl and TCS-OH
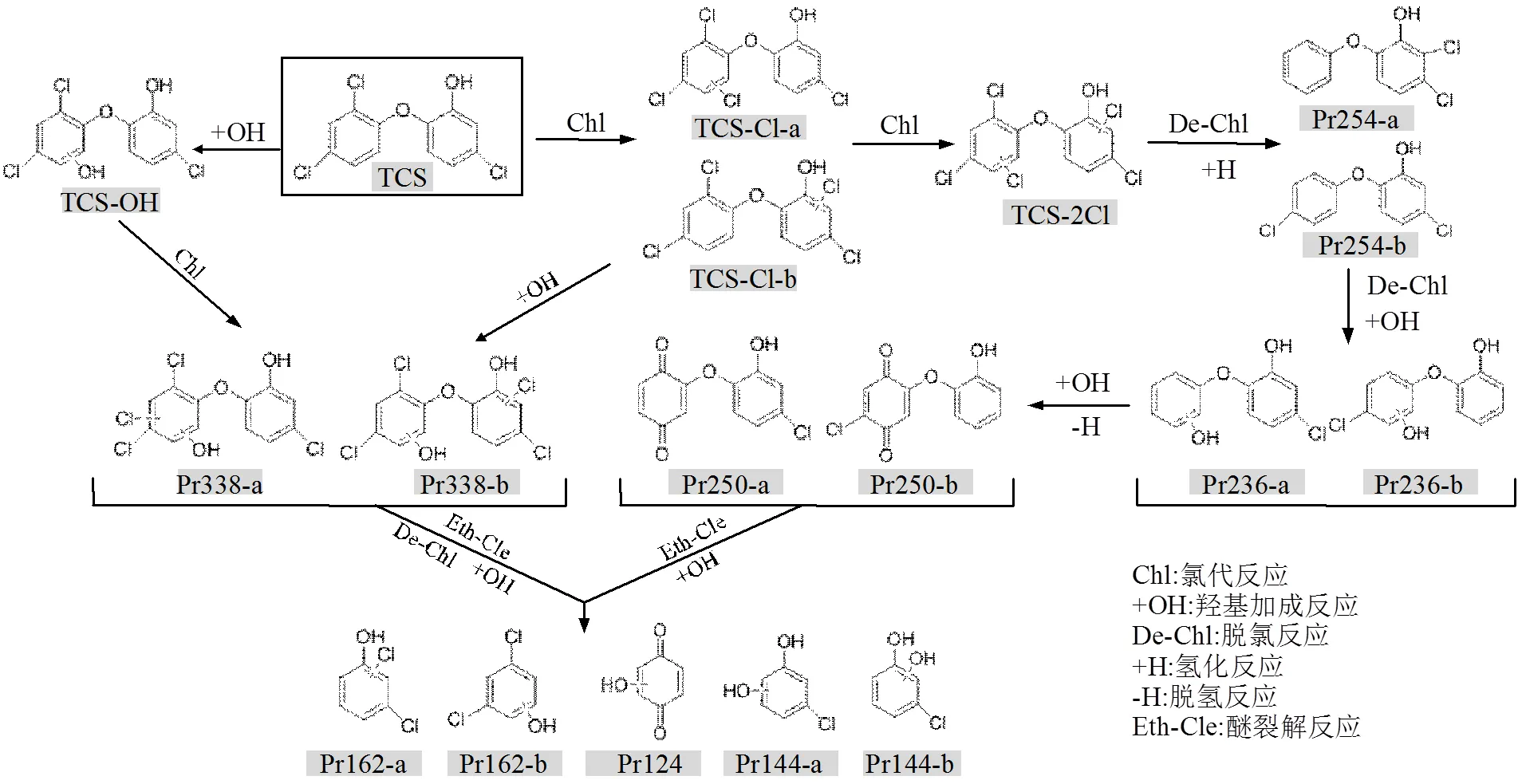
图10 TCS在UV/Cl工艺中的可能反应路径 Fig.10 Proposed reaction pathway of TCS by the UV/chlorine process
使用HRMS Q-TOF进行检测,解析出17种降解中间产物.结果见表6和图9.从图9a、图9b可以看出,TCS出峰时间为12.3min,分子离子的质荷比/为286.9442,有2个主要碎片离子,/分别为214.9907和141.9832.
在反应过程中,TCS主要发生氯代反应和羟基加成反应.TCS苯环上的氢原子与·Cl进行亲核取代反应,生成氯代化合物.一氯代产物具有2个同分异构体,保留时间分别为8.3min(TCS-Cl-a)和11.6min (TCS-Cl-b)(图9c、图9d、图9e).此外,·Cl进一步取代苯环上的H产生二氯代产物(TCS-2Cl).这与Fiss 等[20]鉴定的TCS氯代产物相同,说明氯代产物是TCS进行氯氧化反应的主要产物.
在UV照射、自由氯的联合作用下,·OH诱导TCS进行羟基加成反应,生成羟基化产物TCS-OH (图9f、图9g).继而发生氯取代反应,生成Pr338-a和Pr338-b(表6).同样,TCS-Cl也可能发生羟基加成反应生成Pr338-a和Pr338-b.随后,TCS及氯代产物发生脱氯氢化、脱氯羟基化、羟基加成、脱氢等[17]反应,生成具有同分异构体的Pr254-a、Pr254-b、Pr236-a、Pr236-b、Pr250-a和Pr250-b.在·OH的亲核作用下Pr250醚键断裂,羟基化生成单个苯环的小分子羟基化产物.Pr338等含氯化合物也可能发生脱氯,醚基断裂,羟基化等反应生成单环产物Pr144-a、Pr144-b、Pr162-a、Pr162-b和Pr124.这些中间产物与已有报道的降解TCS反应中间产物相同,表明TCS在不同工艺中降解具有相似的降解路径[21-23].基于以上分析,提出TCS降解反应机制,见图10.
2.7 生态毒性评价与预测
在光强500μW/cm2,TCS初始浓度4mg/L,余氯初始浓度2mg/L,溶液pH值为7.0的典型条件下,进行降解反应.利用费氏弧菌的发光强度指示溶液中TCS及其中间产物的毒性,毒性大小用发光抑制率(%)表示,见图11.反应前,TCS溶液对发光细菌的相对抑制率高达99%.反应300s时,TCS去除率为83.2%,但相对抑制率仅下降13.5%.当反应进行到480s时,TCS几乎完全降解,去除率为93.6%.此时TCS反应液平均抑制率降低为49.7%.延长反应时间至1200s,抑制率逐渐降低,最终抑制率降为36.8%.反应前期,TCS反应液的相对抑制率没有随TCS的去除同步下降.但反应持续到中后期,TCS完全去除,反应液的相对抑制率逐步降低,表明反应后期产生的中间产物毒性明显低于TCS.
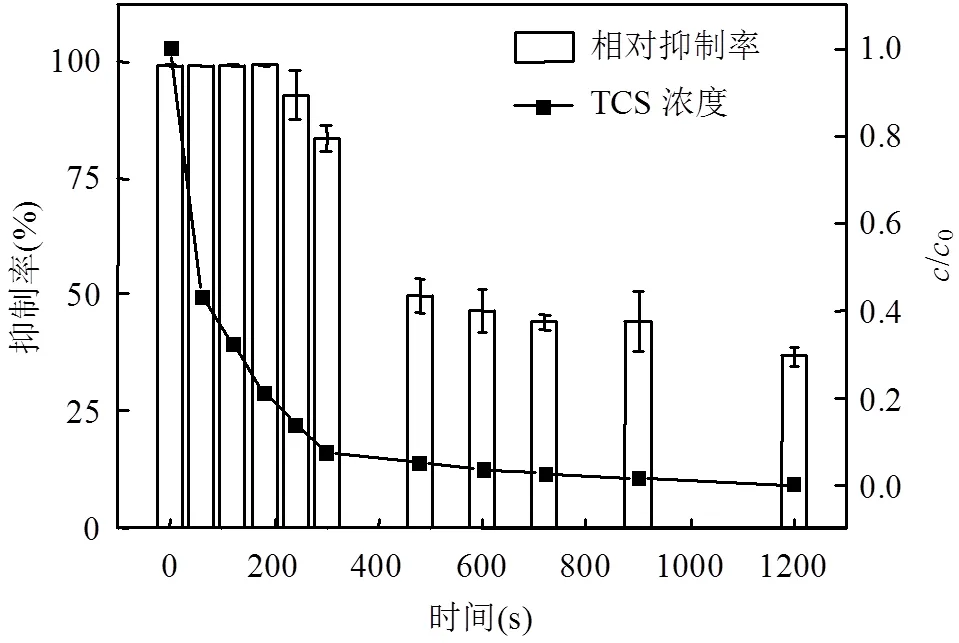
图11 TCS在UV/Cl工艺中对发光细菌的发光抑制率 Fig.11 Inhibition rate of TCS degradation by the UV/chlorine processon luminescent bacteria
使用ECOSAR软件(美国EPA),预测TCS及其中间产物对鱼类、水蚤、绿藻的急性毒性[24-25],结果见表7.TCS的LC50(鱼96h)值为0.97mg/L,前期产物TCS-Cl、TCS-2Cl及Pr338的LC50(鱼96h)值分别为0.29, 0.08, 0.81mg/L.与TCS相比,反应前期产物对水生生物具有较高的急性毒性.然而其余中间产物的LC50(鱼96h)值均高于TCS.可认为反应持续到中后期时,产生的中间产物对水生生物急性毒性明显降低.发光细菌急性毒性实验也验证了这一结论.TCS在UV/Cl工艺中产生毒性风险较高的中间产物,随着反应的进行,产生了毒性较低的中间产物,生态环境风险得以减少.
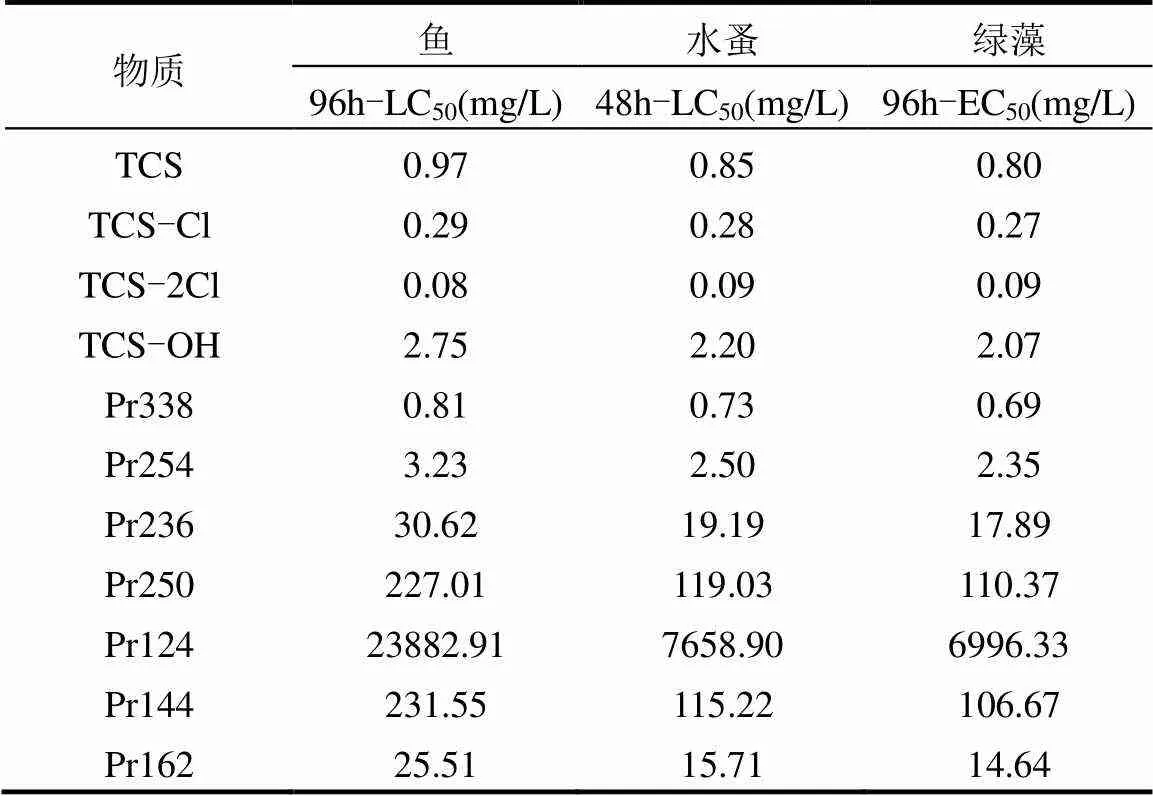
表7 利用ECOSAR预测TCS及其中间产物的急性毒性 Table 7 Estimated acute toxicity of TCS and its intermediates by ECOSAR software
3 结论
3.1 与单一UV、单一Cl相比,反应300s, TCS在UV/Cl工艺中去除率达100%,TCS在UV/Cl工艺中降解效果较好.
3.2 TCS降解速率常数随UV光强和余氯初始浓度增加而增加,随氨氮浓度的增大而减小.碱性条件明显促进TCS的降解反应.
3.3 使用HRMS Q-TOF解析出17种中间产物, UV/Cl工艺降解TCS主要涉及氯代、羟基加成、脱氯氢化、脱氯羟基化、醚键裂解和脱氢等反应.
3.4 TCS在降解过程中产生TCS-Cl和TCS-2Cl等毒性较高的中间产物.与TCS相比,TCS-2Cl的急性毒性高于TCS一个数量级.随着反应进行,产生了毒性较低的中间产物,反应时间1200s后,毒性抑制率降为36.8%, 生态环境风险得以减少.
[1] 刘 莹,管运涛,水野忠雄,等.药品和个人护理用品类污染物研究进展 [J]. 清华大学学报(自然科学版), 2009,(3):368-372.Liu Y, Guan Y T, Mizuno T, et al. Recent research advances of pharmaceuticals and personal care pollutants [J]. Tsinghua University(Sci & Tech), 2009,(3):368-372.
[2] 乔铁军,张锡辉,欧慧婷.药品和个人护理用品在水环境中污染状况的研究与展望 [J]. 给水排水, 2009,35(7):121-130.Qiao T J, Zhang X H, Ou H T. Advances and prospects on pharmaceuticals and personal care products in aquatic environment [J]. Geomatics World, 2009,35(7):121-130.
[3] Chen X J, Jessica R, Liu Y, et al. Ozonation products of triclosan in advanced wastewater treatment [J]. Water Research, 2012,46(7):2247- 2256.
[4] Song Z, Wang N, Zhu L H, et al. Efficient oxidative degradation of triclosan by using an enhanced Fenton-like process [J]. Chemical Engineering Journal, 2012,198-199(8):379-387.
[5] Brausch J M, Rand G M. A review of personal care products in the aquatic environment: Environmental concentrations and toxicity [J]. Chemosphere, 2011,82(11):1518-1532.
[6] Fang J Y, Fu Y, Shang C. The Roles of Reactive Species in Micropollutant Degradation in the UV/Free Chlorine System [J]. Environmental Science & Technology, 2014,48(3):1859-1868.
[7] 刘嘉健,吴梓昊,方晶云.UV/氯高级氧化技术对水中嗅味物质的降解动力学研究[C]//中国环境科学学会, 2015.Liu J J, Wu Z H, Fang J Y. Degradation kinetics of odorant substances in water by the UV/chlorine advanced oxidation technology [C]// Chinese Society For Environmental Sciences, 2015.
[8] 陈 成,杨绍贵,孙 成,等.阿特拉津在紫外-氯消毒中的转化特性及机理研究 [J]. 农业环境科学学报, 2009,28(6):1302-1306.Chen C, Yang S G, Sun C, et al. Conversion Characteristics and Mechanism of Atrazine in a Combination of UV and Chlorination [J]. Journal of Agro-Environment Science, 2009,28(6):1302-1306.
[9] 张永吉,刘文君,张 琳.氯对紫外线灭活枯草芽孢杆菌的协同作用 [J]. 环境科学, 2006,27(2):329-332.Zhang Y J, Liu W J, Zhang L. Synergistic disinfection ofspores by UV irradiation and chlorine [J]. Environmental Science, 2006,27(2):329-332.
[10] Pan Y, Cheng S, Yang X, et al. UV/chlorine treatment of carbamazepine: Transformation products and their formation kinetics [J]. Water Research, 2017,116:254.
[11] Kong X, Jiang J, Ma J, et al. Degradation of atrazine by UV/chlorine: Efficiency, influencing factors, and products [J]. Water Research, 2016,90:15-23.
[12] Sapozhnikova Y, Hedgespeth M, Wirth E, et al. Analysis of selected natural and synthetic hormones by LC-MS-MS using the US EPA method 1694 [J]. Analytical Methods, 2011,3(5):1079-1086.
[13] 李玉瑛,何文龙,李青松,等.UV协同ClO2去除三氯生及其降解产物的研究 [J]. 环境科学, 2015,(2):516-522.Li Y Y, He W L, Li Q S, et al. Removal of triclosan with the method of UV/ClO2and its degradation products [J]. Environmental Science, 2015,(2):516-522.
[14] 庞宇辰,席劲瑛,胡洪营,等.再生水紫外线-氯联合消毒工艺特性研究 [J]. 中国环境科学, 2014,34(6):1429-1434.Pang Y C, Xi J Y, Hu H Y, et al. Evaluation of sequential use of UV irradiation and chlorination to disinfect reclaimed water [J]. China Environmental Science, 2014,34(6):1429-1434.
[15] 李青松,李学艳,姚宁波,等.UV/SPS降解水中三氯生的效能及动力学 [J]. 环境科学, 2017,38(4):1467-1476.Li Q S, Li X Y, Yao N B, et al. Degradation efficiency and kinetics of Triclosan in Aqueous Solution by UV/Sodium persulfate [J]. Environmental Science, 2017,38(4):1467-1476.
[16] 樊鑫鑫,杜尔登,李佳琦,等.萘普生在氯消毒过程中的去除、转化与风险评价 [J]. 环境科学, 2018,4:1645-1653.Fan X X, Du E D, Li J Q, et al. Chloriation of naproxen: Removal, transformation and risk assessment [J]. Environmental Science, 2018,4:1645-1653.
[17] 付永胜,史鸿乐,刘义青,等.UV/H2O2光化学降解水中的三氯生 [J]. 中国环境科学, 2018,38(2):616-626.Fu Y S, Shi H L, Liu Y Q, et al. Photochemical degradation of Triclosan by UV/H2O2in water [J]. China Environmental Science, 2018,38(2):616-626.
[18] Kliegman S, Eustis S N, Arnold W A, et al. Experimental and theoretical insights into the involvement of radicals in triclosan phototransformation [J]. Environmental Science & Technology, 2013,47(13):6756-6763.
[19] Tian F, Liu W, Guo G, et al. Kinetics and mechanism of dimethoate chlorination during drinking water treatment [J]. Chemosphere, 2014, 103(1):181-187.
[20] Fiss E M, Rule K L, Vikesland P J. Formation of chloroform and other chlorinated byproducts by chlorination of triclosan-containing antibacterial products [J]. Environmental Science & Technology, 2007, 41(7):2387-2394.
[21] Yang B, Ying G G, Zhao J L, et al. Oxidation of triclosan by ferrate: reaction kinetics, products identification and toxicity evaluation [J]. Journal of Hazardous Materials, 2011,186(1):227-235.
[22] Song Z, Wang N, Zhu L, et al. Efficient oxidative degradation of triclosan by using an enhanced Fenton-like process [J]. Chemical Engineering Journal, 2012,198-199(8):379-387.
[23] Chen J, Qu R, Pan X, et al. Oxidative degradation of triclosan by potassium permanganate: Kinetics, degradation products, reaction mechanism, and toxicity evaluation [J]. Water Research, 2016,103: 215-223.
[24] Jones O A H, Voulvoulis N, Lester J N. Aquatic environmental assessment of the top 25 English prescription pharmaceuticals [J]. Water Research, 2002,36(20):5013-5022.
[25] Giddings J M, Salvito D, Putt A E. Acute toxicity of 4-amino musk xylene to Daphnia magna in laboratory water and natural water [J]. Water Research, 2000,34(14):3686-3689.
Removal and degradation mechanism of triclosan by the UV/chlorine process.
ZHOU Si-qi1, LI Jia-qi1, DU Er-deng1*, LI Miao2, LIU Xiang2
(1.School of Environmental & Safety Engineering, Changzhou University, Changzhou 213164, China;2.School of Environmental, Tsinghua University, Beijing 100084, China)., 2019,39(3):1000~1008
Degradation of triclosan(TCS), a kind ofbroad-spectrum antimicrobial agent, was studied in water by the UV/chlorine advanced oxidation process. The removal of TCS by single UV, single chlorination and the UV/chlorine process was compared. The effect of different factors on the UV/chlorine process was investigated, including UV intensity, initial residual chlorine, pH value and ammonia concentration. The degradation mechanism and the ecological risk were further discussed. The results indicated that TCS had higher removal by the UV/chlorine process compared with single UV and single chlorination. The reaction fitted pseudo-first-order kinetics. The degradation rate increased with the increase of UV intensity and initial residual chlorine, while decreased with the increase of ammonia concentration. Seventeen intermediates were identified byHRMS Q-TOF, and the possible degradation pathway was also proposed. Both luminescent bacteria experiment and ECOSAR prediction showed that intermediates with high toxicity were produced on TCS degradation by the UV/chlorine process. With the process of reaction, intermediates generated with lower toxicity, and the ecological environment risk was reduced.
triclosan (TCS);UV/chlorine;advanced oxidation process;influencing factors;degradation mechanism;toxicity evaluation
X522
A
1000-6923(2019)03-1000-09
周思琪(1996-),女,江苏徐州人,常州大学硕士研究生,主要从事饮用水水质安全保障技术.发表论文1篇.
2018-08-06
江苏省研究生实践创新计划项目(SJCX18-0960);国家水体污染控制与治理科技重大专项(2017ZX07202-002)
* 责任作者, 副教授, duerdeng@cczu.edu.cn

