氧化石墨烯对嗜热四膜虫的毒性效应
廖苑辰,常叶倩,徐晨珂,崔益斌,李 梅*
氧化石墨烯对嗜热四膜虫的毒性效应
廖苑辰1,常叶倩1,徐晨珂1,崔益斌2,李 梅1*
(1.南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏 南京 210023;2.生态环境部南京环境科学研究所,江苏 南京 210042)
以嗜热四膜虫()作为受试生物,考察了纳米材料氧化石墨烯(GO)对其细胞生长率、乙酰胆碱酯酶(AchE)和氧化应激酶活性、生物膜损伤及细胞凋亡的影响,以探究GO的毒性效应.结果表明,GO浓度高于32mg/L时显著抑制嗜热四膜虫的细胞增殖(<0.05),细胞存活率低于50%;在0~64mg/L实验范围内,随GO暴露浓度增加,细胞内活性氧自由基(ROS)和超氧化物歧化酶(SOD)水平呈先升后降的趋势,AchE活性受抑;GO抑制位于线粒体内膜的琥珀酸脱氢酶(SDH)活性,促进细胞质中乳酸脱氢酶(LDH)的释放;64mg/L GO导致四膜虫细胞出现明显凋亡现象.以上结果显示,中低浓度GO(0~8mg/L)暴露下,氧化应激机制对细胞毒性起主要贡献作用;高浓度GO(32和64mg/L)作用下,四膜虫凋亡现象的产生可能是GO抑制其生长作用导致的.
氧化石墨烯(GO);嗜热四膜虫;毒性效应;氧化应激
纳米材料氧化石墨烯(GO)因其独特的物理及化学性质,在生物、医学和材料科学等领域具有广阔的应用前景,尤其作为药物的靶向载体,被广泛用于生物医药领域.然而,GO在生产、贮存、运输、消费或废弃过程中不可避免地进入到环境中,造成暴露风险,最终可能通过直接排放或地表径流等方式迁移进入水体,对水生生态系统产生危害.研究表明,GO可进入溶酶体、线粒体、细胞核和内质网,诱导氧化应激和细胞凋亡[1],并通过改变细胞活力和形态、破坏膜完整性、诱导DNA损伤[2-4]等方式,对红细胞、成纤维细胞和大鼠肾上腺嗜铬细胞瘤细胞(PC12)等产生毒性.目前,有关GO对水生生物的毒性效应研究主要围绕藻类[5-7]、鱼类[8-10]、双壳类动物[11]和部分浮游动物[12-13]展开,而对原生动物的研究较少[3].
原生动物是无细胞壁的单细胞真核生物,直接暴露在水环境中,对污染物更为敏感,在水环境污染物毒性研究中发挥重要作用.四膜虫()外观呈椭圆形长梨状,体长约50μm.作为一种模式生物,四膜虫在过去几十年已成为一种有效的检测工具,被广泛应用于外源化学物质的潜在毒性研究[14].
本研究以嗜热四膜虫作为研究对象,结合细胞数和乙酰胆碱酯酶活性、氧化应激酶活性、生物膜损伤和凋亡形态学等指标,考察GO对四膜虫的细胞毒性、氧化应激、生物膜系统损伤和细胞凋亡的影响,为评估GO对四膜虫的毒性效应及其作用机制提供基础数据和科学依据.
1 材料与方法
1.1 试验材料
嗜热四膜虫株系()由中国科学院水生生物研究所赠予.采用SPP培养基:2%胰蛋白胨,0.1%酵母膏提取物,0.2%葡萄糖,0.003%西奎斯特林(13% Fe-EDTA)培养,加入100μL 100´青链霉素合剂,121℃灭菌20min,冷却后4℃保存.
GO购自南京先丰纳米材料科技有限公司.
1.2 试验方法
1.2.1 GO悬液配制及表征 GO悬液现配现用.将GO固体薄片置于灭菌超纯水中,使悬液中GO浓度为1mg/mL,超声处理15min(功率200W,10s脉冲,5s间隔),使体系充分分散.用超纯水稀释如下浓度:5, 20,80,320,640mg/L作为悬液母液,对照组为灭菌超纯水.
GO形貌特征表征采用透射电镜(TEM, Tecnai 12,荷兰Philips公司)、拉曼光谱(HR-800,法国Horiba Jobin Yvon公司)和傅里叶变换红外光谱仪(FTIR, Nicolet iS5,美国Thermo Fisher Scientific公司)进行.
1.2.2 GO对嗜热四膜虫细胞生长率的影响 根据预试验结果,确定正式试验GO浓度分别为:0.5, 8,32,64mg/L.取处于对数培养期的四膜虫培养液9mL装至50mL螺纹离心管中,加入1mL相应浓度GO悬液母液进行培养,使GO终浓度为0.5,8,32, 64mg/L.每组设置3个平行,另设空白对照,置于光强3000lx左右,30℃的恒温培养箱中培养,分别于24h 和48h进行细胞密度计数.根据实验结果作时间-剂量-效应图,并利用T检验确定是否具有显著性.
1.2.3 酶活性指标的测定 培养方法同前,72h后离心(1000r/min,3min,4℃),取上清液测定乳酸脱氢酶(LDH)活性.再取细胞沉淀,加入磷酸盐缓冲液(PBS)后超声破碎细胞(JY88-II型超声细胞破碎仪,超声20s,间隔10s,重复6次).将破碎后的细胞悬液离心(12000r/min,5min,4℃),取上清液测定活性氧自由基(ROS)、超氧化物歧化酶(SOD)、乙酰胆碱酯酶(AchE)和琥珀酸脱氢酶(SDH)活性.试验用试剂盒及方法均来自南京建成生物工程研究所.
1.2.4 四膜虫细胞凋亡检测 培养方法同前,72h后离心(1000r/min,3min,4℃),弃上清液.用细滴管将余下的0.5mL细胞悬液逐滴加入4℃预冷的1.5mL无水乙醇(99%)中,边加边震荡,4℃冰箱过夜,固定18h.细胞固定后2周内进行实验.通过加入PBS调整悬液浓度为1´106个细胞/mL,取1mL上述细胞液,离心后(1000r/min,3min,4℃)用PBS洗涤,重复3次,去除残留乙醇,弃上清,留细胞沉淀.加入RNA酶A(100μg/mL),37℃水浴中孵育30min.孵育结束再加入0.5mg/mL碘化丙啶(PI)染液50μL进行DNA染色,4℃再孵育60min.上机前用200目尼龙滤网过滤,流式细胞仪于488nm激发条件下对细胞凋亡情况进行分析.每个样品检测微粒数为2´104个.
1.3 数据分析
利用SPSS 20.0软件处理实验所得数据,进行正态分布检验,并用T检验和方差分析(ANOVA)进行统计处理.以<0.05表示具有显著性差异.
2 结果与讨论
2.1 GO表征
通过TEM、拉曼光谱和FTIR对GO进行相关表征,结果如图1所示.本实验所用GO主要以单片层形式存在,其片层厚度相对均一,约1~2nm,在纳米尺度范围内.拉曼谱图验证了GO在1330cm-1(D带)和1576cm-1(G带)附近有两个特征峰.红外谱图显示GO具有大量亲水性官能团,如3363cm-1附近出现明显吸收峰,代表O—H伸缩振动;1732cm-1处特征峰代表GO石墨片层边缘C=O伸缩振动[15];1371cm-1附近的峰归属O—H的弯曲振动;1074cm-1处为C—O的伸缩振动.该纳米材料在水中的分散情况良好.

2.2 GO对四膜虫的毒性效应
2.2.1 GO对四膜虫细胞生长率的影响 分别于培养24和48h后计数,得到四膜虫在不同时间及不同浓度GO下的存活数量(图2).结果显示在培养细胞中加入一定量GO后,相同暴露时间内,随GO浓度的增加,四膜虫细胞数量减少.高浓度GO(32和64mg/L)明显抑制细胞的增殖(<0.05).经验证,GO对四膜虫活性影响在48h内与时间关系不显著.Zhao等[16]研究了GO对小球藻()的毒性效应,结果显示,GO可通过遮蔽效应抑制约16%藻类的生长.石柳等[12]研究发现,GO对大型溞()的毒性表现出一定剂量-效应关系,在65~ 143mg/L范围内,随GO浓度的升高,大型溞死亡率从10%逐渐增加到100%.另有研究表明,GO对小眼虫()的96h EC50为(3.76±0.74)mg/L,当GO浓度超过2.5mg/L时产生明显不良反应(<0.01),抑制生物生长[3].上述研究结果与本实验结果存在一定差异,因为不同生物之间GO毒性大小有所区别,且培养基营养成分的不同也可能对GO的毒性造成影响[3].
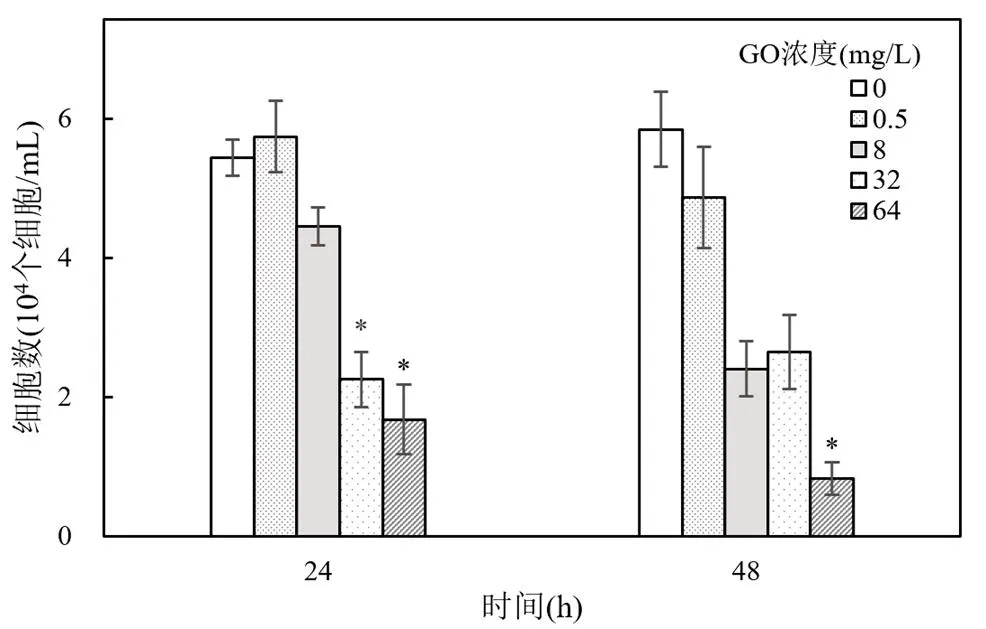
图2 GO对嗜热四膜虫细胞生长率的影响Fig.2 Effects of GO on cell growth rate of T.thermophila与CK组相比有显著差异,*P<0.05

用单个样本K-S检验、Q-Q图分别对24和48h四膜虫细胞数的正态分布进行检验(图3).在SPSS中执行“分析-非参数检验-单个样本K-S检验”,24h的值为0.745,值0.636>0.05;48h的值为0.606,值=0.856>0.05;Q-Q图中,各点基本围绕图中对角线.正态检验结果说明本实验所得GO毒性数据呈近似正态分布.
2.2.2 GO对四膜虫的氧化应激作用 氧化应激被认为是纳米材料重要的毒性机制[16].细胞内的ROS水平能直接反映细胞自由基的产生情况.SOD是机体抗氧化防御体系中的关键酶,可通过其在机体内含量和活性的变化间接反映机体的氧化损伤程度,保护细胞免受ROS的不利影响[17].
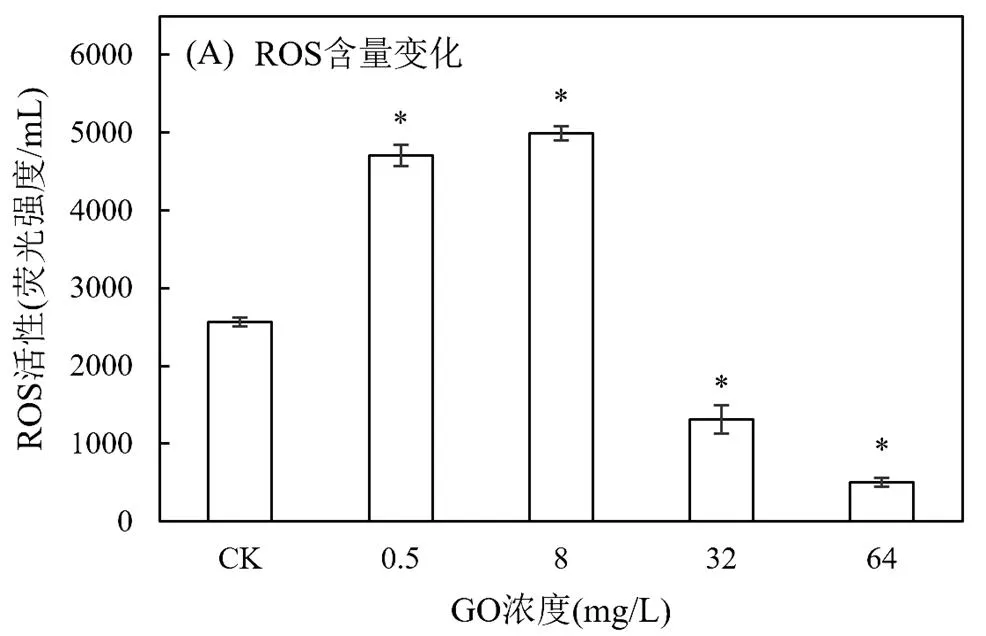
结果表明GO处理下ROS和SOD水平均随其浓度增大呈现先升后降的趋势(图4).在0~8mg/L范围内,随着GO暴露浓度增加,细胞内ROS含量升高,说明中低浓度GO可诱导四膜虫细胞产生氧化应激,此时细胞中的SOD活性增强以清除ROS,减轻GO造成的氧化胁迫.高浓度GO(32和64mg/L)条件下,ROS和SOD均呈大幅下降,结合GO浓度高于32mg/L暴露下,四膜虫存活率不足50%的情况,推测此时嗜热四膜虫难以生存,细胞中的抗氧化酶被破坏,导致酶活性降低.已有研究证实,GO能诱导藻类细胞和斑马鱼产生氧化应激,引起ROS的产生,破坏细胞完整性[18]. Nogueira等[19]将绿藻暴露于0~ 100μg/L GO,发现当其浓度为20μg/mL时,绿藻的生长抑制率为50%,且在96h孵育时间内,GO浓度与ROS产生呈显著正相关(<0.05);Lu等[20]将斑马鱼暴露于10mg/L GO培养14d,发现GO诱导斑马鱼胚胎产生过量ROS,造成斑马鱼明显的组织损伤.上述结果表明GO的毒性作用可能与其诱导细胞内ROS含量增加有关,提示本研究中高浓度(32和64mg/L)GO对细胞的毒害作用可能是由于ROS升高造成的.
2.2.3 GO对四膜虫AchE活性的影响 GO暴露下四膜虫AchE活性变化见图5,当GO浓度大于8mg/L时,随暴露浓度升高,AchE活性呈下降趋势.由图4可知,8mg/L GO作用下ROS活性最高,已有研究证实H2O2作为ROS的一种对AchE具有调节作用,高浓度H2O2抑制AchE活性[21],因此猜测8mg/L GO诱导ROS活性升高,导致AchE活性受抑.一般而言,当AchE活性抑制率大于20%时,说明污染物对生物体有暴露毒性作用的存在;抑制率大于50%时,认为污染物对生物生存产生危害[22].本实验中GO高浓度(32和64mg/L)处理下,AchE活性抑制率超过50%,表明GO对四膜虫造成毒害作用,威胁生物生存.另外,考虑到乙酰胆碱作为神经递质在运动行为控制中起重要作用[23],四膜虫的运动能力也受到一定程度的抑制.这也验证了2.2.2中GO浓度高于32mg/L时四膜虫难以存活的结果.周梦媛等[24]关于Al2O3纳米颗粒对梨形四膜虫细胞毒性的研究亦显示,高浓度(500mg/L)纳米Al2O3抑制四膜虫AchE活性.
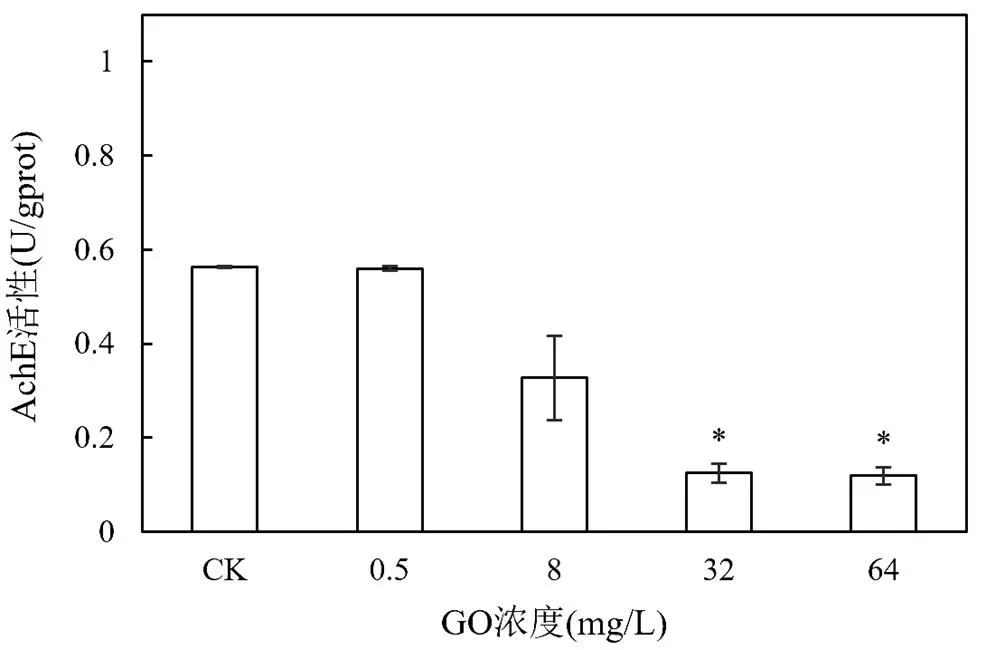
图5 GO暴露下四膜虫AchE活性变化Fig.5 Variation of acetylcholinesterase (AchE) activity of T.thermophila after GO exposure与CK组相比有显著差异,* P<0.05
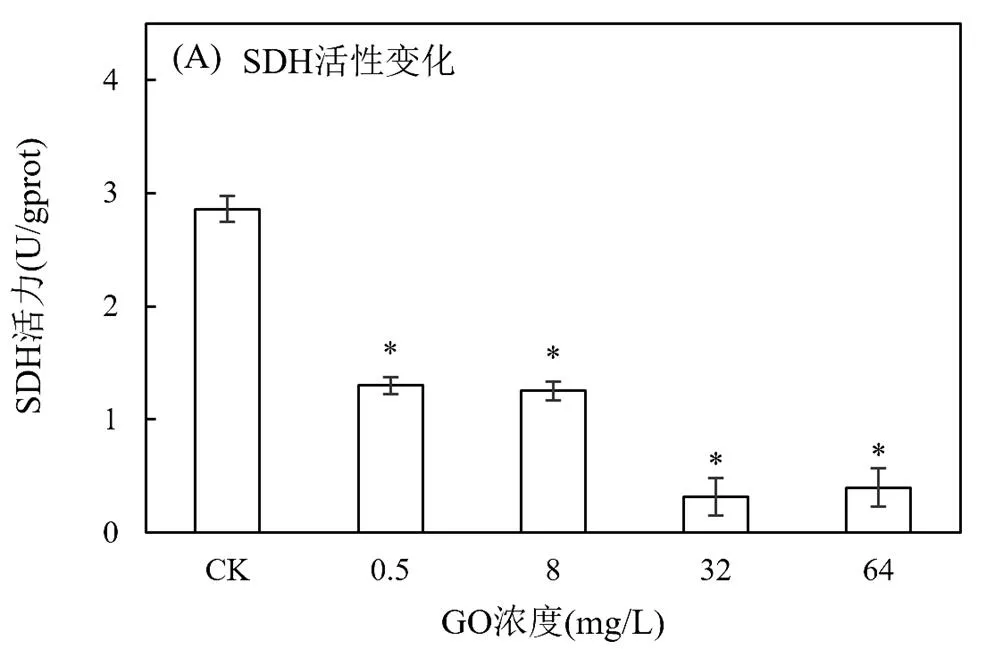
2.2.4 GO对线粒体内膜、细胞膜的影响 SDH位于线粒体内膜,参与三羧酸循环和电子传递链,能反映细胞功能状态的糖代谢过程,其浓度可以表征四膜虫细胞线粒体活性的高低及内膜完整程度[24].GO的存在使四膜虫SDH活性受到抑制,暴露浓度越高,抑制作用越明显(图6A).与对照组相比,各处理组SDH活力均显著降低(<0.05).Zhou等[25]对暴露于石墨烯的各种类型细胞SDH活性进行检测,发现在所有测试细胞中,石墨烯以剂量-依赖方式直接抑制SDH活性,与本实验结果相符.线粒体是ROS产生的重要场所,也是ROS攻击的主要部位.相关研究已证实纳米材料能诱导氧化应激产生ROS,破坏线粒体膜完整性[26].本实验中,GO抑制SDH活性,推测GO使四膜虫细胞线粒体活性降低,内膜受损,细胞能量代谢受阻,从而抑制细胞生长.结合GO对四膜虫的生长抑制作用(图3),进一步证实SDH活性变化可能与细胞增殖有关[24].
LDH作为胞质酶稳定存在于细胞质中,当细胞凋亡或裂解造成细胞膜结构破坏时即被释放到细胞外,因此该酶是细胞膜完整性的重要指标,可作为细胞死亡的信号.不同浓度GO处理后对四膜虫LDH活性的影响如图6(B)所示.低浓度(0.5mg/L)条件下,GO对LDH的释放无影响;当GO浓度高于8mg/L时,处理组LDH活性较对照组显著升高(<0.05),说明细胞膜损伤严重,胞内组分释放,四膜虫的生命活动受到影响.Zhang等[27]研究了石墨烯和碳纳米管对PC12细胞的毒性作用,发现石墨烯和碳纳米管均能诱导细胞内LDH表达水平升高.另有研究证实,GO能诱导HeLa细胞LDH的释放[28],与本实验结果一致.
目前,有关纳米材料细胞毒性的研究有3种主要机制:氧化应激、金属毒性和物理刺穿导致细胞破裂[29].针对石墨烯家族纳米材料(GFNs)的毒性机制,有研究提出,GFNs通过不同方式进入细胞,诱导ROS产生,使LDH增加,随后引起各种细胞损伤(如细胞膜损伤、线粒体损伤、细胞凋亡或坏死等),是GFNs细胞毒性的主要可能机制[30].在本实验中,GO浓度为0~8mg/L时,GO与细胞作用产生的ROS呈浓度依赖性(图4A),LDH亦呈上升趋势,推测由于GO诱导细胞产生ROS,ROS水平过高引发脂质过氧化反应,损伤细胞膜,此时可能是ROS对细胞毒性起贡献作用;高浓度GO(32和64mg/L)暴露下,ROS低于正常水平,而胞外LDH活性显著升高,推测四膜虫细胞受到破坏,从而产生强毒害作用.
2.2.5 GO对四膜虫细胞凋亡形态学分析 以上结果已证实GO能引起细胞膜及线粒体的损伤,为进一步检验其毒性,利用流式细胞仪对GO暴露下的四膜虫细胞凋亡形态学进行分析(图7).PI是一种DNA染料,由于其不能透过活细胞膜,但当细胞膜破损后可进入细胞,因此常用于鉴定死细胞.前向散射光(FSC)的强度与细胞体积大小和活力有关,侧向散射光(SSC)能反映细胞的复杂程度.随着GO浓度的上升,四膜虫的细胞趋向于细胞结构复杂程度上升和体积变大,表明细胞发生了凋亡现象. Kang等[31]的研究证实GO以剂量依赖性方式诱导PC12细胞凋亡.Hu等[29]认为GO对细胞膜的物理损伤作用是导致细胞凋亡的主要原因.Wang等[32]研究发现,氧化应激是人胚肺成纤维细胞暴露于GO后细胞凋亡和DNA损伤的关键原因.另有研究表明,GO可直接通过影响细胞线粒体活性从而导致细胞凋亡[29].本研究中,64mg/L GO能明显引起细胞凋亡,但GO对四膜虫细胞的具体凋亡途径及其机制有待进一步研究.

图7 不同浓度GO暴露下的凋亡形态学分析 Fig.7 Flow cytometry analysis under different GO concentrationsP2代表不同取样的粒子区位,P1表示发生变化的粒子区位
3 结论
3.1 GO浓度高于32mg/L时,嗜热四膜虫生长受到显著抑制(<0.05),细胞存活率低于50%.
3.2 在实验浓度范围内,随GO暴露浓度增加, ROS和SOD水平呈现先升后降的趋势,AchE活性降低,细胞毒性增强.GO抑制位于线粒体内膜的SDH活性,促进细胞质中LDH的释放,破坏细胞膜和线粒体内膜完整性.64mg/L GO能引起四膜虫细胞明显凋亡.
3.3 中、低浓度(0~8mg/L)GO暴露下,氧化损伤对细胞毒性起主要贡献作用;高浓度(32和64mg/L)GO暴露下,四膜虫凋亡现象的产生可能是GO抑制其生长作用导致的,具体凋亡途径及其机制仍需进一步研究.
[1] Vallabani N V, Mittal S, Shukla R K, et al. Toxicity of graphene in normal human lung cells (BEAS-2B) [J]. J. Biomed. Nanotechnol., 2011,7(1):106-107.
[2] Chatterjee N, Eom H J, Choi J. A systems toxicology approach to the surface functionality control of graphene-cell interactions [J]. Biomaterials, 2014,35(4):1109-1127.
[3] Liu Y, Luo Y, Wu J, et al. Graphene oxide can induceandmutagenesis [J]. Science Reports, 2013,3(12):3469.
[4] Hu C, Wang Q, Zhao H, et al. Ecotoxicological effects of graphene oxide on the protozoan[J]. Chemosphere, 2015,128: 184-190.
[5] 涂海峰,刘 成,王宇擎,等.氧化石墨烯对邻苯二甲酸二丁酯藻毒性的影响 [J]. 环境科学, 2018,39(8):3927-3936. Tu H F, Liu C, Wang Y Q, et al. Effect of graphene oxide on algal toxicity of dibutyl phthalate [J]. Environmental Science, 2018, 39(8):3927-3936.
[6] Zhao J, Cao X, Wang Z, et al. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae [J]. Water Research, 2016,111:18-27.
[7] Hazeem L J, Bououdina M, Dewailly E, et al. Toxicity effect of graphene oxide on growth and photosynthetic pigment of the marine algasp. during different growth stages [J]. Environmental Science and Pollution Research, 2017,24(4):4144-4152.
[8] Souza J P, Baretta J F, Santos F, et al. Toxicological effects of graphene oxide on adult zebrafish ()[J]. Aquatic Toxicology, 2017,186:11-18.
[9] Lv X, Yang Y, Tao Y, et al. A mechanism study on toxicity of graphene oxide to: Direct link between bioaccumulation and oxidative stress [J]. Environmental Pollution, 2018,234:953-959.
[10] 吕小慧,陈白杨,朱小山.氧化石墨烯的水环境行为及其生物毒性 [J]. 中国环境科学, 2016,36(11):3348-3359.Lv X H, Chen B Y, Zhu X S. Fate and toxicity of graphene oxide in aquatic environment [J]. China Environmental Science, 2016,36(11): 3348-3359.
[11] 段伟艳,杜永祥,孟范平,等.氧化石墨烯对双壳类动物文蛤的亚致死毒性研究 [J]. 中国环境科学, 2017,37(7):2755-2764.Duan W Y, Du Y X, Meng F P, et al. The sublethal toxicity of graphene oxide to bivalve[J]. China Environmental Science, 2017,37(7):2755-2764.
[12] 石 柳,王 栋,张 瑛,等.氧化石墨烯对大型溞的生物毒性效应研究 [J]. 生态毒理学报, 2017,12(3):416-424. Shi L, Wang D, Zhang Y, et al. The toxic effects of graphene oxide on crustacean[J]. Asian Journal of Ecotoxicology, 2017, 12(3):416-424.
[13] Mesaric T, Gambardella C, Milivojevic T, et al. High surface adsorption properties of carbon-based nanomaterials are responsible for mortality, swimming inhibition, and biochemical responses in[J]. Aquatic Toxicology, 2015,163:121-129.
[14] 傅诚杰,俞 婷,缪 炜,等.四膜虫:毒理学与生态毒理学研究中的优良模式生物 [J]. 动物学杂志, 2005,(1):108-113. Fu C J, Yu T, Miao W, et al.:a good model organism for toxicology and ecotoxicology [J]. Chinese Journal of Zoology, 2005, (1):108-113.
[15] Szabo T, Berkesi O, Dekany I. DRIFT study of deuterium-exchanged graphite oxide [J]. Carbon, 2005,43(15):3186-3189.
[16] Garza K M, Soto K F, Murr L E. Cytotoxicity and reactive oxygen species generation from aggregated carbon and carbonaceous nanoparticulate materials [J]. International Journal of Nanomedicine, 2008,3(1):83-94.
[17] Weckx J, Clijsters H. Oxidative damage and defense mechanisms in primary leaves ofas a result of root assimilation of toxic amounts of copper [J]. Physiologia Plantarum, 1996,96(3):506- 512.
[18] 胡俊杰,劳志朗,吴康铭,等.氧化石墨烯的环境行为和毒性效应研究进展 [J]. 生态环境学报, 2017,26(12):2169-2176. Hu J J, Lao Z L, Wu K M, et al. Research progress in environmental behavior and toxicity of graphene oxide [J]. Ecology and Environmental Sciences, 2017,26(12):2169-2176.
[19] Nogueira P F M, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algae[J]. Aquatic Toxicology, 2015,166:29-35.
[20] Lu K, Dong S, Petersen E J, et al. Biological uptake, distribution, and depuration of radio-labeled graphene in adult zebrafish: Effects of graphene size and natural organic matter [J]. ACS Nano, 2017,11(3): 2872-2885.
[21] Schallreuter K U, Elwary S, Gibbons N, et al. Activation/deactivation of acetylcholinesterase by H2O2: More evidence for oxidative stress in vitiligo [J]. Biochemical and Biophysical Research Communications, 2004,315(2):502-508.
[22] 蔡文超,黄 韧,李建军,等.生物标志物在海洋环境污染监测中的应用及特点 [J]. 水生态学杂志, 2012,(2):137-146. Cai W C, Huang R, Li J J, et al. Applications and characteristics of biomarkers on monitoring of marine environmental pollution [J]. Journal of Hydroecology, 2012,(2):137-146.
[23] Soares J C, Pereira T C B, Costa K M, et al. Developmental neurotoxic effects of graphene oxide exposure in zebrafish larvae () [J]. Colloids and Surfaces B-Biointerfaces, 2017,157:335-346.
[24] 周梦媛,赵群芬,吴雅菁,等. Al2O3纳米颗粒对梨形四膜虫细胞毒性机理研究 [J]. 生物学杂志, 2012,29(6):47-52. Zhou M Y, Zhao Q F, Wu Y J, et al. Cytotoxic mechanism of aluminium oxide nanoparticles to[J]. Journal of Biology, 2012,29(6):47-52.
[25] Zhou H, Zhang B, Zheng J, et al. The inhibition of migration and invasion of cancer cells by graphene via the impairment of mitochondrial respiration [J]. Biomaterials, 2014,35(5):1597-1607.
[26] 王 娟,王妹梅,王晶晶,等.线粒体在纳米毒性效应中的作用及其机制研究进展 [J]. 应用与环境生物学报, 2015,21(4):579-589.Wang J, Wang M M, Wang J J, et al. Review on the role of mitochondria in nano-toxicology [J]. Chinese Journal of Applied and Environmental Biology, 2015,21(4):579-589.
[27] Zhang Y, Ali S F, Dervishi E, et al. Cytotoxicity effects of graphene and single-wall carbon nanotubes in neural phaeochromocytoma- derived PC12cells [J]. ACS Nano. 2010,4(6):3181-3186.
[28] Zhang X, Hu W, Li J, et al. A comparative study of cellular uptake and cytotoxicity of multi-walled carbon nanotubes, graphene oxide, and nanodiamond [J]. Toxicology Research, 2012,1(1):62-68.
[29] Hu W, Peng C, Lv M, et al. Protein corona-mediated mitigation of cytotoxicity of graphene oxide [J]. ACS Nano, 2011,5(5):3693-3700.
[30] Ou L, Song B, Liang H, et al. Toxicity of graphene-family nanoparticles: a general review of the origins and mechanisms [J]. Particle and Fibre Toxicology, 2016,13(1):57.
[31] Kang Y, Liu J, Wu J, et al. Graphene oxide and reduced graphene oxide induced neural pheochromocytoma-derived PC12cell lines apoptosis and cell cycle alterations via the ERK signaling pathways [J]. International Journal of Nanomedicine, 2017,12:5501-5510.
[32] Wang A, Pu K, Dong B, et al. Role of surface charge and oxidative stress in cytotoxicity and genotoxicity of graphene oxide towards human lung fibroblast cells [J]. Journal of Applied Toxicology, 2013, 33(10):1156-1164.
Toxicity effects of graphene oxide to
LIAO Yuan-chen1, CHANG Ye-qian1, XU Chen-ke1, CUI Yi-bin2, LI Mei1*
(1.State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023, China;2.Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China)., 2019,39(3):1299~1305
Effects of graphene oxide (GO) on the growth, acetylcholinesterase (AchE) activity, oxidative stress, membrane damage and apoptosis ofwere investigated. The results showed that the concentrations higher than 32mg/L GOsignificantly inhibited the growth of(<0.05), and the cell survival rate was less than 50%. With the increase of GO concentration (0~64mg/L), the levels of reactive oxygen species (ROS) and superoxide dismutase (SOD) incells initially also increased but then decreased while the activity of AchE decreased. GO inhibited the activity of succinate dehydrogenase (SDH) and promoted the release of lactate dehydrogenase (LDH). Highest concentration of GO (64mg/L) caused cell apoptosis. Based on the results, it can be concluded that oxidative stress contributed to cytotoxicity at low and medium concentrations of GO (0~8mg/L) while at higher concentrations (32 and 64mg/L) of GO, apoptosis ofmay be causedby GO inhibiting its growth.
graphene oxide (GO);;toxic mechanism;oxidative stress
X172
A
1000-6923(2019)03-1299-07
廖苑辰(1996-),女,福建长汀人,南京大学硕士研究生,主要研究方向为环境毒理学.
2018-08-19
国家自然科学基金资助项目(41571468,41773115),江苏省科技支撑项目(BE2016736)
* 责任作者, 教授, meili@nju.edu.cn

