鲢鱅鲴混养对水环境及氮素迁移转化的影响
陈玲玲,高月香,张毅敏*,朱月明,孔 明,许雪婷,王涌涛,黄天寅
鲢鱅鲴混养对水环境及氮素迁移转化的影响
陈玲玲1,2,高月香2,张毅敏2*,朱月明2,孔 明2,许雪婷2,王涌涛1,黄天寅1
(1.苏州科技大学环境科学与工程学院,江苏 苏州 215009;2.环境保护部南京环境科学研究所,江苏 南京 210000)
利用15N稳定同位素技术研究混养细鳞斜颌鲴对鲢鱅鱼水环境及氮素迁移转化的影响.结果显示:实验期间,鲴鲢鱅组各营养盐浓度经过短暂升高后迅速降低,实验结束时,TN,TP,NO3--N,NO2--N,PO43--P浓度分别达到2.67,0.13,0.93,0.026,0.0035mg/L,鲢鱅组各营养盐浓度总体保持增长趋势并于第10d后显著大于鲴鲢鱅组相应值(<0.05),到实验结束分别为鲴鲢鱅组的1.80,1.69,1.73,1.72,1.83倍.与对照组相比,有鱼组的叶绿素浓度Chla和藻细胞密度明显下降,到实验结束,鲢鱅组的Chl a和藻细胞密度分别为34.69mg/m3,1.96´106cells/L,鲴鲢鱅组分别为25.32mg/m3,1.9´106cells/L,均显著低于对照组(<0.05).同位素分析结果显示:标记物15N微囊藻进入系统后,部分被鲢鱅鱼摄食同化为机体组成部分,再通过鱼类分泌,排泄等方式进入水体,水体中含氮营养盐被藻类生长吸收,此外,一部分微囊藻沉淀和鱼类排泄物作为沉积腐质被鲴鱼摄食同化为其机体组成部分.
稳定同位素技术;细磷斜颌鲴鲢鱼;微囊藻
为治理富营养化水体,遏制蓝藻爆发,非经典生物操纵理论提出了利用滤食性鱼类鲢(),鱅()直接牧食藻类的方法,但是对于该理论的应用一直存在争议.一方面,Ke等[1]通过围隔实验发现鲢鱅肠道对微囊藻的贡献率最高可达80%~100%;李元鹏等[2]也通过向富营养化水库投放鲢鱅鱼,发现鲢鱅鱼对水体中COD,TN,TP,NH3-N和藻类等均达到一定的去除效果.但Starling等[3]研究表明鲢鱼10d内排泄粪便重量近乎其自身重量,而其沉淀粪便沉积物所释放的营养盐将对水质产生负面影响.谷孝鸿等[4]也发现鲢鱅鱼体储存的氮、磷只占总氮、总磷的一小部分,大部分仍滞留在水体中,而鱼类摄食,排泄活动和对底泥的扰动会加速水体中氮、磷养分循环,促进浮游植物密度的提高.近些年,许多学者发现细鳞斜颌鲴()与河蟹、鳜鱼、青虾、泥鳅等水生动物套养可以更好地维持水环境的生态平衡,创造更多的经济效益[5-7].细鳞斜颌鲴是生活在水体底层的鱼类,以刮取有机碎屑、污泥杂质及水表面残渣泡沫中的裸藻为食,有水底“清洁夫”之称[8],而鲢、鱅鱼属于水体中上层鱼类,主要以浮游生物为食,将三者混养可丰富生物和食物链结构,提高经济效益.
此外,在水域生态学中稳定同位素是一种被广泛运用的示踪剂[9-11],王银平等[12]曾利用该技术研究鲢,罗非鱼摄食15N标记物微囊藻干粉后排泄氮在水中的迁移转化规律;Bergner等[13]也利用15N标记鱼体组织,在饲养中接受不同的蛋白质来源以研究鱼类的蛋白质代谢与植物蛋白质的氨基酸区别.因此,本论文结合两者考虑,设计在模拟的富营养水环境下将鲴鱼与鲢鱅鱼混养,利用稳定同位素技术,通过鲢鱅鱼牧食藻类,鲴鱼摄食底层碎屑的食物链结构,探究鲴鲢鱅鱼混养对水环境和氮素迁移转化的影响.
1 材料与方法
1.1 实验材料
实验装置:采用9个100L的白色塑料圆桶,桶高65cm,顶部直径52cm,底部直径40cm.
实验用水:采用经过曝气除氯的自来水,铜绿微囊藻(藻密度约为7.4×106cells/L)和一定量的化学药剂(1.40gNaNO3,0.90gK2HPO4)在恒温循环水箱中混合均匀后分装到实验装置中.
实验鱼种:细鳞斜颌鲴(Plagiogathops),体长(10.12±0.56)cm,体重(13.45±3.98)g,鱼龄接近1龄,由湖南醴陵市国家鲴鱼良种场提供.鲢(),体长(10.28±2.00)cm,体重(30.68±3.87)g.鱅()体长(14.48±0.43)cm,体重(46.21±2.24)g,由安徽香泉鲢鱅养殖鱼塘提供.
铜绿微囊藻:中国科学院水生生物研究所接种的纯种铜绿微囊藻()藻种,采用BG11培养基扩大培养,培养温度为(25±0.5)℃,光照强度为2000lx,光暗比为 12h:12h.
1.2 实验方法
铜绿微囊藻培养液用15NH4Cl(98atom%15N)溶液进行15N标记,标记后离心去除上清液后进行冷冻干燥,再添加等量诱食剂制成藻食颗粒物待用.
实验设计为鲢鱅组,鲴鲢鱅组和对照组3组,每组设3个平行实验.1~3#为鲢鱅组(5尾鲢,3尾鱅),4~6#为鲴鲢鱅组(5尾鲢,3尾鱅,5尾鲴),7~9#为对照组(不放鱼)排除因实验环境对铜绿微囊藻产生的影响.实验前将鲴鲢鱅鱼放入清水中饥饿处理3d排空肠胃,挑选其中活泼健康,大小接近的个体作为实验材料.实验水桶上方装有日光灯,光照时间为9:30~21:00,24h曝气.
实验时间为2018年5月21~6月9日,共计20d,于实验前1d,实验第1,5,10,15,20d上午09:30取样监测,监测的指标有:TN,TP,NH3-N,NO3--N, NO2--N, PO43--P,Chl a,SS和藻细胞密度.实验第1d及以后每隔5d采集鱼类生物体,浮游藻类,沉积腐质和水体进行稳定同位素比值测定,由于鳙鱼生物量有限,因此分别于实验第1,10,20d进行采样,采集样品分别记为δ15N(鲴),δ15N(鲢),δ15N(鱅),δ15N(浮游藻类),δ15N(沉积腐质), δ15N(氨氮)和δ15N(硝酸盐氮),同位素比值单位为‰.
1.3 指标测试和分析方法
1.3.1 水质指标 营养盐TN,TP,NH3-N,NO3--N, NO2--N,PO43--P浓度测定方法参照《水和废水监测分析方法(第四版)》[14],SS浓度依据《湖泊富营养化调查规范》[15]中所述方法进行测定,Chl a浓度测定采用热乙醇萃取分光光度法[16],藻细胞密度采用血小板显微镜计数法和分光光度法[17].
1.3.215N同位素比值测定 实验期间采集的鱼类生物体、沉积腐质、浮游藻类样品均放入仪器中冷冻干燥,干燥后的样品进行研磨,水体中δ15N(氨氮)样品处理按照Lehmann等[18]提供的方法,δ15N(硝酸盐氮)样品测定按照吴俊森等[19]提供的方法,所有样品最终送入元素分析仪-同位素比质谱仪联机(FLASH 2000-Thermo Fisher DELTA V advantage,测定精度δ15N£±0.1‰)中测定氮同位素组成.
1.4 数据处理与分析
文中数据采用Execl和SPSS进行单因素方差分析和显著相关性分析,利用Origin2018进行作图.
2 结果与分析
2.1 各组水体中营养盐、Chl a、SS浓度和藻细胞密度的变化
由图1可知,实验前期,鲴鲢鱅组各营养盐浓度(除NH3-N)快速增长,TN,TP,NO3--N,NO2--N, PO43-- P浓度分别于实验第1,5d达到最大值为3.94,0.20, 1.19,0.034,0.0039mg/L,随后浓度逐渐下降,到实验结束分别达到2.67,0.13,0.93,0.026,0.0035mg/L.而鲢鱅组各营养盐浓度(除NH3-N)总体保持持续增长并于第10d后显著大于鲴鲢鱅组相应值(<0.05),到实验结束,鲢鱅组TN,TP, NO3--N,NO2--N,PO43--P分别为鲴鲢鱅组的1.80,1.69,1.73,1.72,1.83倍.实验期间NH3-N浓度变化略有不同,实验前期,3组的NH3-N浓度快速下降,实验后期趋于稳定,到实验结束,对照组、鲢鱅组和鲴鲢鱅组均达到最低值,分别为0.08,0.13,0.16mg/L,去除率分别为85.96%,77.19%, 71.93%.
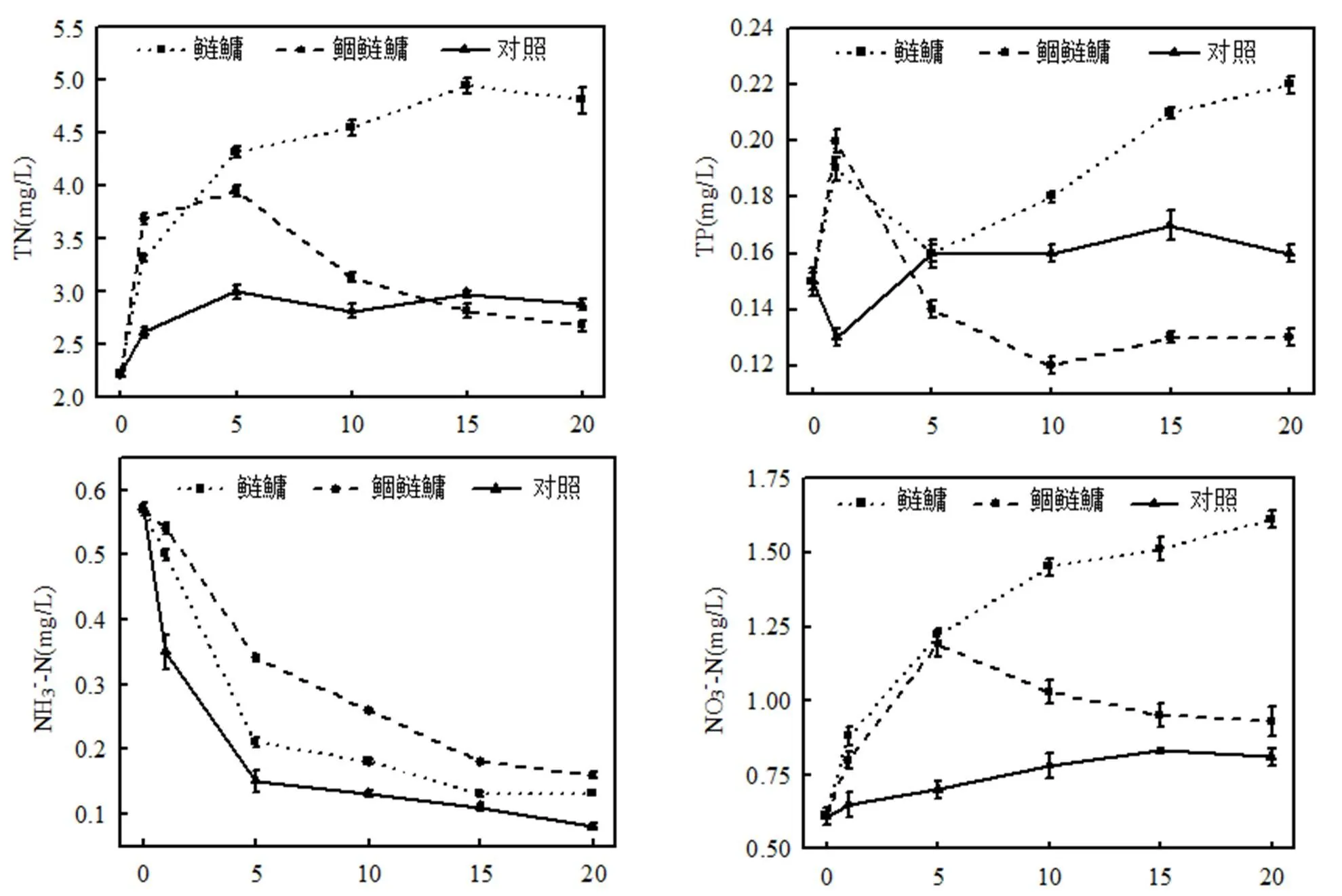
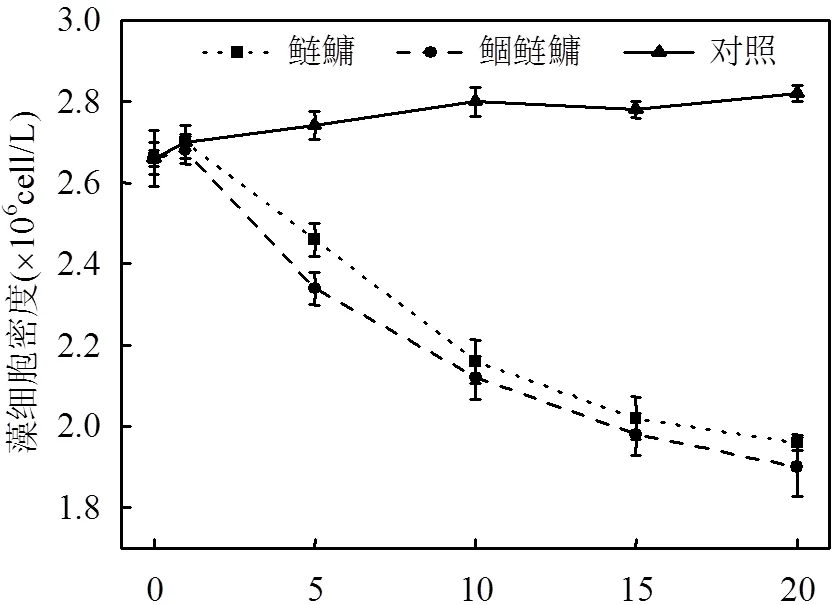
由图2可知,对照组悬浮固体SS浓度围绕30.52mg/L上下浮动,变化较小,实验第1d鲢鱅组和鲴鲢鱅组SS浓度达到最大值,分别为43.13, 45.17mg/L,显著高于对照组(<0.05),随后浓度逐渐下降,实验第10d后均低于对照组.Chl a浓度表现为实验前期鲢鱅组和鲴鲢鱅组浓度快速下降,鲢鱅组于第5d达到最小值33.85mg/m3,极显著低于对照组(<0.01),随后缓慢增长并趋于平稳,而鲴鲢鱅组Chl a浓度持续下降,于第15d显著低于鲢鱅组(<0.05),实验结束达到最小值25.32mg/m3.藻细胞密度变化与Chl a,SS不同,鲢鱅组和鲴鲢鱅组藻细胞密度自实验开始后持续下降,并于第5d后均显著低于对照组(<0.05),至实验结束,鲢鱅组和鲴鲢鱅组藻细胞密度分别达到最低值1.96´106,1.90´106cells/L,为对照组的69.50%和67.37%.
2.2 各组合中生物相和非生物相中δ15N值的变化
由图3可知,自实验第1d投加标记物微囊藻干粉后,3组水体中δ15N值均明显增大.实验期间,对照组的δ15N(氨氮)值和δ15N(硝酸盐氮)值分别围绕平均值491.57‰,292.89‰上下浮动,最大幅度分别为9.11%, 18.53%,显著低于鲴鲢鱅组(<0.05).鲴鲢鱅组的δ15N(氨氮)值和δ15N(硝酸盐氮)值在实验前期快速增长并于第10d达到最大值,分别为1108.66‰,668.64‰,随后均逐渐下降,到实验结束分别为956.14‰,406.73‰.鲢鱅组δ15N(氨氮)值和δ15N(硝酸盐氮)值前期迅速增长,δ15N(氨氮)值于第5d达到最大值788.72‰后迅速下降,且显著低于鲴鲢鱅组(<0.05),而δ15N(硝酸盐氮)值与鲴鲢鱅组对应值变化趋势相似,实验第10d达到最大值490.61‰,但显著低于鲴鲢鱅组(<0.05).
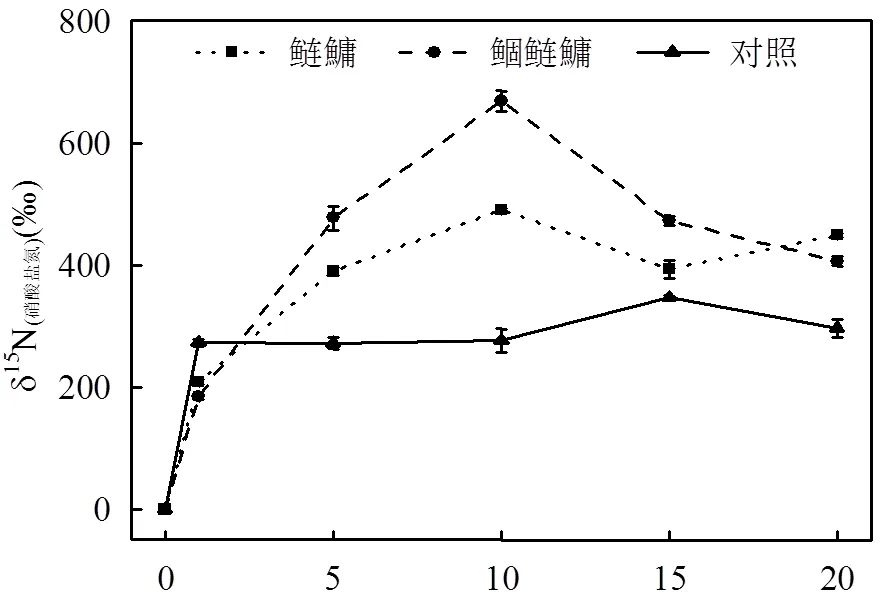
由图4可知,实验前期,对照组的δ15N(浮游藻类)值保持增长,并于第10d达到最大值1153.95‰后逐步下降,而鲢鱅组和鲴鲢鱅组中δ15N(浮游藻类)自实验开始就保持下降趋势,极显著低于对照组(<0.01),到实验结束达到最低值,分别为324.74‰,307.17‰.鲢鱅组δ15N(沉积腐质)值自实验第1d就持续下降,而鲴鲢鱅组则经历短暂的升高后于第5d达到最高值1229.54‰后迅速下降,到实验结束鲢鱅组和鲴鲢鱅组δ15N(沉积腐质)值均达到最低值,分别为681.97‰,349.17‰.
由图5可见,鲢鱅组和鲴鲢鱅组的鲢鱼和鱅鱼δ15N值变化趋势相似,但总体上鲢鱅组的δ15N(鲢)值,δ15N(鱅)值均大于鲴鲢鱅组相应值,且2组均表现为δ15N(鲢)值大于δ15N(鱅)值.实验前期,鲢鱅组和鲴鲢鱅组的δ15N(鲢)值,δ15N(鱅)值均迅速增长,第10d达到最大值分别为282.485‰,276.72‰,279.04‰, 260.12‰,随后逐渐下降.鲴鲢鱅组的δ15N(鲴)值自实验开始就保持增长趋势,实验前期δ15N(鲴)值低于δ15N(鲢)值和δ15N(鱅)值,实验结束时达到最大值307.65‰,显著高于δ15N(鱅)值和δ15N(鲢)值(<0.05).
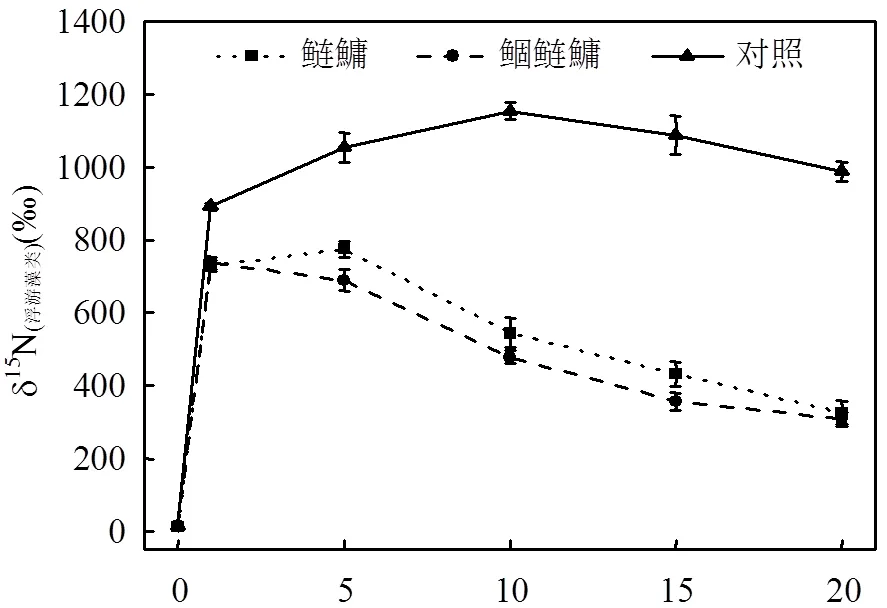
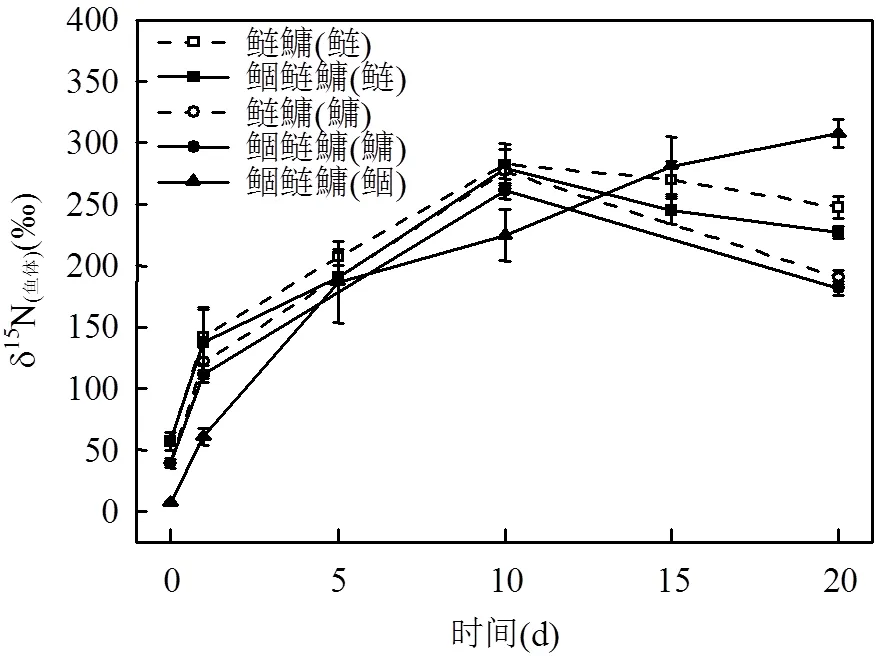
图5 各组不同鱼类δ15N值的变化 Fig.5 Changes of δ15N values of different fishes in each group
2.3 不同组合中的氮素值相关性分析
由表1可知,各组NH3-N与TN, NO3--N, NO2--N, δ15N(氨氮)和δ15N(硝酸盐氮)均成负相关,其中鲢鱅组和对照组NH3-N与TN,δ15N(硝酸盐氮)和NO3--N呈显著相关性,鲴鲢鱅组未达到显著水平,同时,鲢鱅组和对照组的TN与对应组中其他不同形态氮素成一致相关性,其中与NO3--N,NO2--N和δ15N(氨氮)均呈正相关性,同时表现为与相应组的δ15N(硝酸盐氮)呈正显著相关性,鲢鱅组的TN与NO3--N,NO2--N也达到显著水平,说明实验水体的氮盐主要由硝酸盐氮贡献,鲴鲢鱅组TN与其NH3-N,NO3--N,δ15N(氨氮)和δ15N(硝酸盐氮)均成正相关,但未达到显著水平.
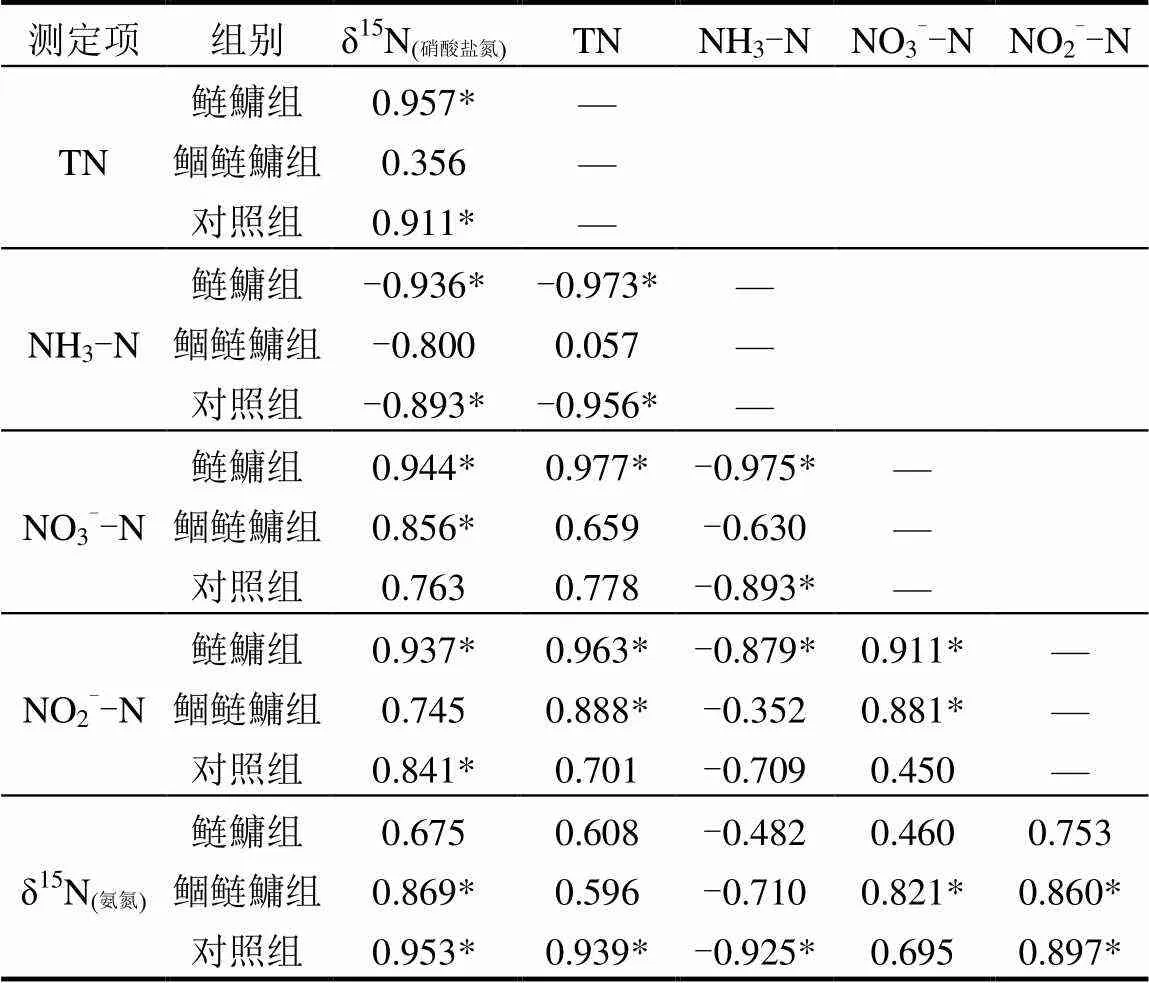
表1 实验中各组合水体中不同形态氮素测定值的相关关系 Table 1 Correlation of different morphological nitrogen values in each combination of water in the text
注:*表示显著相关,<0.05.
3 讨论
3.1 各实验组合对水环境的影响
研究指出,大规模放养鲢,鱅对藻类有明显消耗作用[20],尤其是蓝,绿藻的生物量能被控制在较低的水平[21].范振强等[22]也发现以水华微囊藻为优势种的高藻原水经过在水厂预沉池放养鲢鱼进行预处理后,藻类总量,蓝藻和水华微囊藻含量分别下降了61.8%,76.1%和78.2%.本次实验鲢鱅组和鲴鲢鱅组的Chl.a和藻细胞密度与对照组对应值相比,均明显下降,鲢、鱅鱼生理特征显示,其鳃粑、腭褶和鳃粑管上皮都分布有味蕾和丰富的粘液细胞[23],另外从鲢鱅所生活水体中的浮游生物组成和它们肠管中食物组成的一致性来看,它们对食物并无选择能力[24],更能表明鲢,鱅确实能够摄食铜绿微囊藻.但鲢鱅鱼类牧食排泄活动也会导致营养物质重新进入水体,陈少莲等[25]通过实验研究发现鲢,鱅鱼组水体中氮,磷释放率分别为无鱼水体的1.8和1.41倍,王嵩等[26]通过围隔实验也发现水体总磷较放鱼前明显上升.本次研究中鲢鱅组TN,TP等部分营养盐浓度持续增高,到实验后期,鲢鱅组水体中各营养盐浓度均高于鲴鲢鱅组,分析原因是放养鲢,鳙会在很大程度上加速浮游生物—有机质—微生物—营养盐这一链条的循环速率,加速了水体富营养化盐氮磷的溢出作用[27].本次实验中后期,鲴鲢鱅组相较于鲢鱅组水体各营养盐浓度明显下降,同时,水体Chl a和藻细胞密度也明显低于对照组和鲢鱅组,原因可能是细鳞斜颌鲴喜食一些能形成“水华”的藻类,如微囊藻,丝状颤藻等,并主要以水中有机碎屑和腐殖质为食[28],混养鲴鱼可以减少鲢鳙摄食微囊藻后的排泄物,同时降低排泄物中微囊藻活性,减少了因鲢鳙排泄物引起的水环境污染和生态影响[29].
3组的NH3-N浓度自实验开始就迅速下降,到实验结束,对照组,鲢鱅组和鲴鲢鱅组3组均达到最低值,去除率分别达到85.96%,77.19%,71.93%,分析可能是曝气对水体中NH3-N有一定的吹脱作用,且曝气营造的好氧环境也抑制了NH3-N的产生,加快了其分解[30].同时,实验期间3组的NH3-N浓度表现为鲴鲢鱅组高于鲢鱅组,对照组浓度明显低于鲢鱅组和鲴鲢鱅组,可能是因为氨作为鱼类最主要的排泄产物之一,在肝脏内通过自由氨基酸的转氨和脱氨作用产生,靠扩散作用等透过细胞膜而排出体外[31],而鲴鲢鱅组鱼类密度明显高于鲢鱅组.
3.2 各实验组合中15N的迁移转化
经过同位素标记的标记物进入生态系统,在传递过程中会产生具有一定规律性的分馏效应,各生物与非生物相同位素比值有一定的差异,通过此差异性可以研究标记元素的迁移转化[32].本次实验通过将用15N标记过的铜绿微囊藻做成食物投加到系统中,实验前期,各组水体中δ15N(氨氮)值和δ15N(硝酸盐氮)值明显增长,分析可能是实验前期藻类处于生长适应期,释放的15N大大超过藻类生物合成过程中吸收的[33],此外鱼体通过鳃排出15N以及微生物从沉积的鱼类排泄物和衰亡藻类分解出的15N也会导致δ15N(氨氮)值增高[34],而硝化细菌在好氧环境中将水体中的NH3-N转化为NO3--N,因此δ15N(硝酸盐氮)值也逐步增长.随着实验的进行,藻类生长所需的15N超过释放的,鲴鲢鱅组和鲢鱅组中鱼类生物量减少,各组中鱼类排出的15N量也随之降低,但生物量总体表现为鲴鲢鱅组高于鲢鱅组,因此实验后期,鲢鱅组和鲴鲢鱅组的δ15N(氨氮)和δ15N(硝酸盐氮)值开始下降,且总体表现为鲴鲢鱅组δ15N(氨氮)和δ15N(硝酸盐氮)值高于鲢鱅组对应值.
实验第1d,各组δ15N(浮游藻类)值和δ15N(沉积腐质)值均迅速升高,说明无机氮能够有效地被微囊藻利用[35],而沉积腐质主要由鱼类排泄物,悬浮物颗粒物和藻类衰亡的沉淀物组成,δ15N(沉积腐质)值迅速增加,原因可能有以下3个:喂食过程中部分未被摄食的饵料作为悬浮颗粒物沉淀到装置底部;藻类生长适应期部分衰亡沉淀;鱼类的代谢活动导致排泄物增多.对比王银平等[12]实验研究中δ15N(沉积腐质)值缓慢升高到第5d达到最大之后下降,本次实验鲢鱅组和鲴鲢鱅组的δ15N(浮游藻类)值和δ15N(沉积腐质)值自实验第1d后迅速下降,同时鲢鱅组和鲴鲢鱅组中各鱼类的δ15N值逐步升高,说明鱼类能够有效进行牧食活动.此外,各组鱼类δ15N值表现为鲢鱅组和鲴鲢鱅组δ15N(鲢)值和δ15N(鱅)值于第10d达到最大值后趋于平稳,且2组的δ15N(鲢)值分别高于相应组的δ15N(鱅)值,原因是鲢鱼和鳙鱼的肠道发育不同,当鱼体长超过3cm,鲢鱼的肠道明显长于鳙鱼,使得鲢鱼摄食消化率高于鱅鱼.
3.3 各实验组合中不同相15N的收支平衡
根据样品经同位素质谱仪分析出的15N原子百分比(atom%)和氮含量百分比(N%),计算得出样品中的15N增加量(excess15N)及15N存储量(store15N).
excess
15
N
[36]
=
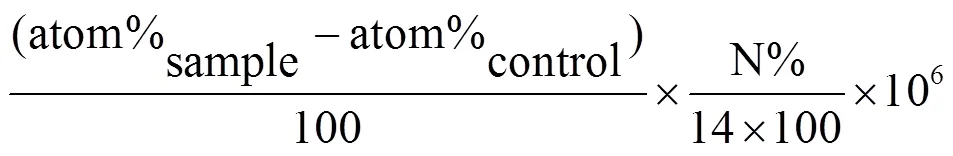
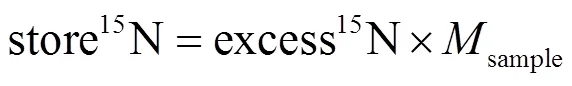
式中:atom%sample为样品15N原子百分比平均值; atom%control为标记前样品15N原子百分比平均值;sample为样品质量.;excess15N为15N原子的增加量,mmol;store15N为15N原子的存储量,μmol.
根据以上公式计算得出每组投加的标记物微囊藻中15N总量为19.34μmol,由表2可见,实验第1d,3组沉积腐质的15N存储量占比较大,鲢鱅组,鲴鲢鱅组和对照组分别为总量的20.77%,21.56%和20.66%,说明标记物微囊藻干粉有部分沉淀.随着实验的进行,各类鱼体中过量15N存储量均有所增高,但占总量的百分比不高,到实验结束,鲢鱅组的鲢鱼,鳙鱼转化百分比分别是7.31%和6.96%,鲴鲢鱅组分别为7.15%, 6.73%,同时,鲴鱼达到了转化最大百分比7.85%.实验期间,浮游藻类的15N存储量表现为对照组高于鲢鱅组和鲴鲢鱅组,实验结束时,鲢鱅组和鲴鲢鱅组分别达到最低值0.45和0.42μmol,占总量的2.33%和2.19%,对照组则为1.79μmo,占比9.27%.同时,各组水体中营养盐15N存储量表现为NH3-N大于NO3--N,对比实验第1d和第20d,鲢鱅组,鲴鲢鱅组和对照组硝酸盐氮过量15N存储量分别增加了2.96,2.65和0.38μmol,此外,根据各组中不同相的占比总和可知,投加的标记物并未全部转化到监测的生物和非生物相中,说明系统中微生物也参与了15N的迁移转化.由实验中15N存储量数据和食物链相关知识分析可知,标记物微囊藻进入系统后,一部分经鲢鱅鱼摄食后被同化成鱼类有机体组成部分,一部分标记物下沉和鱼类排泄物一起作为沉积腐质被鲴鲢鱅组中鲴鱼摄食并同化成其机体组成部分,而鱼类分泌,排泄等活动使氮营养盐进入水体,水体中含氮营养盐被浮游藻类生长利用.
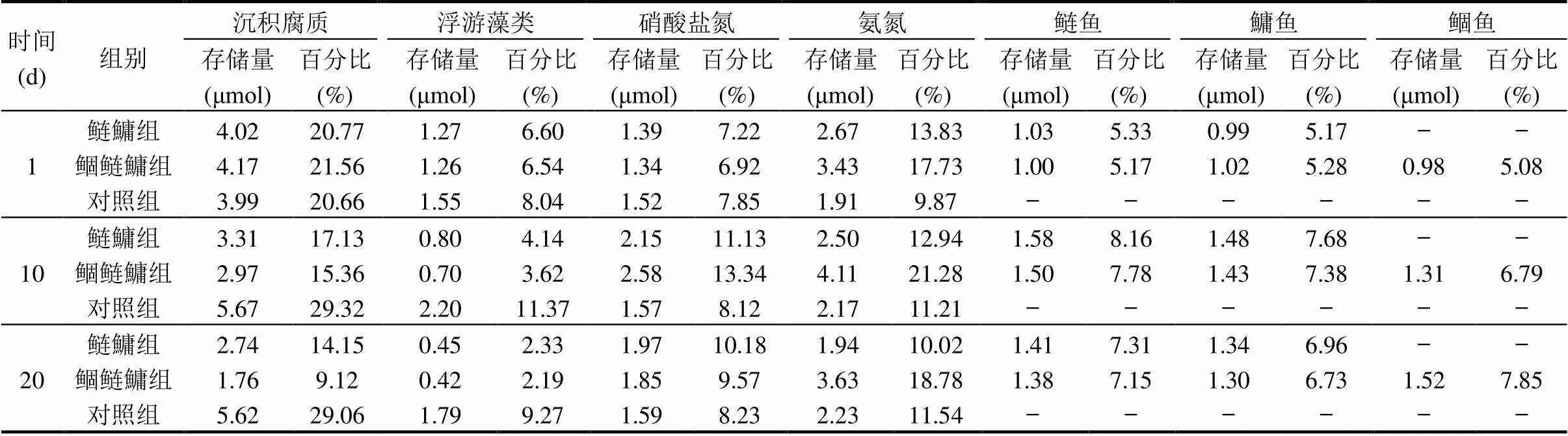
表2 实验各组合中不同相15N存储量及其百分比 Table 2 15N storage and its percentage of different phases in each combination of the text
4 结论
4.1 鲴鱼与鲢鱅鱼混养能够有效减缓鲢鱅鱼排泄活动对水质造成的负面影响,并能达到协同控藻的效果,到实验结束,鲴鲢鱅组TN,TP显著低于鲢鱅组(<0.05),分别为2.67,0.13mg/L,Chl.a和藻细胞密度也达到最低值,分别为25.32mg/m3,1.90´106cell/L,极显著低于对照组(<0.01).
4.2 鲴鱼因食物来源和鱼体吸收消化率的差异性,使得其与鲢鱅鱼相比能更有效的吸收和存储15N.实验期间,δ15N(鲴)值一直呈上升趋势,到实验结束, δ15N(鲴)值达到最大值307.65‰,显著高于δ15N(鱅)值和δ15N(鲢)值(<0.05).
4.3 同位素标记物微囊藻进入系统后,一部分经鲢鱅鱼摄食同化成为鱼类有机体组成部分,又通过鱼类分泌,排泄等方式进入水体,水体中含氮营养盐被浮游藻类生长利用,一部分未被摄食的微囊藻沉淀和鱼类排泄物作为沉积腐质经鲴鱼摄食同化成其机体组成部分.
[1] Ke Z X, Xie P, Guo L G, et al. In situ study on the control of toxic Microcystis blooms using phytoplanktivorous fish in the subtropical Lake Taihu of China: A large fish pen experiment [J]. Aquaculture, 2007,265(1):127-138.
[2] 李元鹏,于惠莉,顾学林,等.鲢鳙鱼原位修复水库水质的试验[J]. 净水技术, 2017,36(10):52-56.Li Y P, Yu H L, Gu X L, et al. Experiment of reservoir water quality in-situ remediation with silver and bighead carps [J]. Water Purification Technology, 2017,36(10):52-56.
[3] Starling L D R M. Control of eutrophication by silver carp (Hypophthalmichthys molitrix) in the tropical Paranoá Reservoir (Brasília, Brazil): a mesocosm experiment [J]. Hydrobiologia, 1993, 257(3):143-152.
[4] 谷孝鸿,刘桂英.滤食性鲢鳙鱼对池塘浮游生物的影响[J]. 农村生态环境, 1996,(1):6-10+41.Gu X H, Liu G Y. Impact of Silver Carp and Head Carp in Fish Ponds on Plankton [J]. Rural Ecological Environment, 1996,(1):6-10,41.
[5] 侯冠军,宋光同,陈 静,等.虾蟹混养池塘套养细鳞斜颌鲴试验[J]. 水产养殖, 2012,33(12):18-22.Hou G J, Song G T, Chen J, et al. Text of Shrimp, crab andpolyculture ponds [J]. Journal of Aquaculture, 2012,33(12):18-22.
[6] 凌 俊,江 河,胡 王,等.池塘蟹、鳜、鲴、鳙健康混养增效模式[J]. 科学养鱼, 2013,(11):25-27.Ling J, Jiang H, Hu W, et al. Pond crab, scorpion, silver carp and bighead carp health polyculture efficiency model [J]. Scientific Fish Farming, 2013,(11):25-27.
[7] 陈 军,王煜恒,王会聪,等.投放不同密度的细鳞斜颌鲴对河蟹养殖水质和经济效益的影响[J]. 江苏农业科学, 2017,45(23):174-177.Chen J, Wang Y H, Wang H C, et al. Effects of different density ofon the water quality and economic benefits of crab farming [J]. Jiangsu Agricultural Sciences, 2017,45(23):174-177.
[8] 杨四秀.鲴鱼的生物学特性及养殖技术[J]. 内陆水产, 2004, (5):28-29. Yang S X. Biological characteristics and culture techniques of[J]. Inland Aquatic Products, 2004,(5):28-29.
[9] Burford M A, Preston N P, Glibert P M, et al. Tracing the fate of15N-enriched feed in an intensive shrimp system [J]. Aquaculture, 2002,206(3):199-216.
[10] Kang C K, Choy E J, Son Y, et al. Food web structure of a restored macroalgal bed in the eastern Korean peninsula determined by C and N stable isotope analyses [J]. Marine Biology, 2008,153(6):1181-1198.
[11] 王海霞,刘 瑀,关春江,等.营养条件对微藻碳,氮稳定同位素组成的影响[J]. 中国环境科学, 2014,34(3):727-733.Wang H X, Liu Y, Guan C J, et al. Effects of nutritional conditions on the stable carbon and nitrogen isotope of microalgae [J]. China Environmental Science, 2014,34(3):727-733.
[12] 王银平,谷孝鸿,曾庆飞,等.食微囊藻干粉鱼类对水环境的影响及氮素迁移转化规律[J]. 湖泊科学, 2015,27(3):475-485.Wang Y P, Gu X H, Zeng Q F, et al. Impacts of faeces from microcystis-dietary silver carp () and tilapia () on the aquatic environments and the transferring of fae[1]ces-sourced nitrogen [J]. J. Lake Sciences, 2015, 27(3):475-485.
[13] Bergner H, Götz K P, Simon M, et al.15N-labeling of fishes using15N isotopes in aquarium water and the effect of a different protein nutrient on the15N elimination after the labeling period [J]. Archiv für Tierernährung, 1993,45(2):139.
[14] 魏复盛.水和废水监测分析方法(第四版) [M].北京:中国科学出版社, 2002:200-284.Wei F S. Water and wastewater monitoring and analysis methods (Fourth edition) [M]. Beijing: China Science Press, 2002:200-284.
[15] 金相灿,屠清瑛.湖泊富营养化调查规范[M]. 北京:中国环境科学出版社, 1990:143. Jin X C, Tu Q Y. Lake eutrophication survey specification [M]. Beijing: China Environmental Science Press, 1990:143.
[16] 陈宇炜,陈开宁,胡耀辉.浮游植物叶绿素a测定的“热乙醇法”及其测定误差的探讨[J]. 湖泊科学, 2006,18(5):550-552.Chen Y W, Chen K N, Hu Y H. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method [J]. Journal of Lake Sciences, 2006,18(5):550-552.
[17] Dickman M. A new method for making permanent phytoplankton mounts [J]. Hydrobiologia, 1968,31(2):161-167.
[18] Lehmann M F, Bernasconi S M, Mckenzie J A. A method for the extraction of ammonium from freshwaters for nitrogen isotope analysis [J]. Analytical Chemistry, 2001,73(19):4717-4721.
[19] 吴俊森,王丽丽,贾瑞宝,等.同位素分析法测定硝酸盐氮预处理方法研究[J]. 山东建筑大学学报, 2012,27(1):8-10.Wu J S, Wang L L, Jia R B, et al. Study on pretreatment for measurement nitrate nitrogen in isotopic analysis method [J]. Journal of Shandong Jianzhu University, 2012,27(1):8-10.
[20] 朱雪霞.亿尾鲢鳙鱼苗可“灭”蓝藻120万吨[N]. 江苏科技报, 2015-02-13(A01). Zhu X X. Billions of silver carp and bighead carp fry can "kill" cyanobacteria 1.2 million tons [N]. Jiangsu Science and Technology News, 2015-02-13(A01).
[21] 崔福义,林 涛,马 放,等.水体治理中鲢鳙生物操纵作用的实验研究[J]. 南京理工大学学报(自然科学版), 2004,(6):668-672.Cui F Y, Lin T, Ma F, et al. Experimental study on the Biological manipulation of silver carp and bighead carp in water treatment [J]. Journal of Nanjing University of Science And Technology, 2004,(6):668-672.
[22] 范振强,崔福义,马 华,等.放养鲢鱼预处理高藻原水的除藻效能及特性[J]. 环境科学, 2008,(3):632-637.Fan Z Q, Cui F Y, Ma H, et al. Effectiveness and characteristics of treating algae-laden raw water by stocking silver carp [J]. Environmental Science, 2008,(3):632-637.
[23] 孙晓明,孟庆闻.鲢、鳙滤食及消化器官的发育,构造与食性的相互关系[J]. 水产学报, 1992,(3):202-212.Sun X M, Meng Q W. The relationship between the development of sputum, sputum filter and digestive organs, structure and diet of silver carp and bighead carp [J]. Journal of Fisheries of China, 1992,(3):202-212.
[24] 周 洁,林 峰.鲢、鳙的食性及其对藻类的消化利用[J]. 水生生物学报, 1990,(2):170-175+197-198. Zhou J, Lin F. The feeding habits of silver carp and bighead carp and their digestion and utilization of algae [J]. Acta Hydrobiologica Sinica, 1990,(2):170-175+197-198.
[25] 陈少莲,刘肖芳,华 俐.鲢、鳙在东湖生态系统的氮、磷循环中的作用[J]. 水生生物学报, 1991,(1):8-26.Chen S L, Liu X F, Hua L. The role of silver carp and bighead in the nitrogen and phosphorus cycles of the East Lake ecosystem [J]. Acta Hydrobiologica Sinica, 1991,(1):8-26.
[26] 王 嵩,王启山,张丽彬,等.水库大型围隔放养鲢鱼、鳙鱼控藻的研究[J]. 中国环境科学, 2009,29(11):1190-1195.Wang S, Wang Q S, Zhang L B, et al. Large enclosures experimental study on algal control by silver carp and bighead [J]. China Environmental Science, 2009,29(11):1190-1195.
[27] 刘 敏,徐敏娴,许迪亮,等.鲢、鳙非经典生物操纵作用的研究进展与应用现状[J]. 水生态学杂志, 2010,31(3):99-103.Liu M, Xu M X, Xu D L, et al. Research progress and application status of non-classical biological manipulation ofand[J]. Journal of Hydroecology, 2010,31(3):99-103.
[28] 李艳和,江 河,管远亮,等.细鳞斜颌鲴湖泊套养试验[J]. 安徽农业科学, 2005,(11):2085-2086.Li Y H, Jiang H, Guan Y L, et al.lake nesting test [J]. Anhui Agricultural Sciences, 2005,(11):2085-2086.
[29] 郭艳敏,高月香,张毅敏,等.鲴对食微囊藻鲢鳙排泄物及藻活性的作用研究[J]. 中国环境科学, 2016,36(12):3784-3792.Guo Y M, Gao Y X, Zhang Y M, et al. Effect ofon feces and microcystis activity from microcystis-dietary silver carp and bighead carp [J]. China Environmental Science, 2016,36(12):3784-3792.
[30] 胡湛波,刘 成,周权能,等.曝气对生物促生剂修复城市黑臭河道水体的影响[J]. 环境工程学报, 2012,6(12):4281-4288.Hu Z B, Liu C, Zhou Q N, et al. Effects of aeration to remediation of black-odorous urban river by using biostimulants [J]. Chinese Journal of Environmental Engineering, 2012,6(12):4281-4288.
[31] 吴 晗,张毅敏,周 创,等.温度对细鳞斜颌鲴生理学特性影响的研究[J]. 环境工程, 2015,33(5):23-27+89.Wu H, Zhang Y M, Zhou C, et al. Influence of temperature on physiological Characteristics of[J]. Environmental Engineering, 2015,33(5):23-27+89.
[32] Gribsholt B, Boschker S, Struyf E, et al. Nitrogen processing in a tidal freshwater marsh: A whole-ecosystem15N labeling study [J]. Limnology and Oceanography, 2005,50(6):1945-1959.
[33] 郭艳敏.鲢鳙鲴组合系统控制富营养化水体中蓝藻活性和氮素迁移转化的研究[D]. 南京:东南大学, 2017.Guo Y M. Studies on the variation of cyanophyta activity and nitrogen migration and transformation in biomanipulation process by silver carp,bighead carp and[D]. Nanjing:Southeast University, 2017.
[34] Burford M A, Glibert P M. Short-term nitrogen uptake and regeneration in early and late growth phase shrimp ponds [J]. Aquaculture Research, 1999,30(3):215-227.
[35] 吴轩浩,高佳逸,严杨蔚,等.无机氮和有机氮对铜绿微囊藻生长和产毒影响的比较[J]. 环境科学学报, 2015, 35(3):677-683.Wu X H, Gao J Y, Yan Y W, et al. Comparison of inorganic nitrogen and organic nitrogen on the growth and microcystin production of[J]. Acta Scientiae Circumstantiae, 2015,35(3):677-683.
[36] 李 柯.蓝藻分解所释放营养盐在沉水植被区的归趋[D]. 武汉:华中农业大学, 2011.Li K. The fate of nutrients released during the decomposing of cyanobacterial detritus in submerged macrophytes zones [D]. Wuhan: Huazhong Agricultural University, 2011.
Effects ofandpolyculture on water environment and nitrogen migration and transformation.
CHEN Ling-ling1,2, GAO Yue-xiang2, ZHANG Yi-min2*, ZHU Yue-ming2, KONG Ming2, XU Xue-ting2, WANG Yong-tao1, HUANG Tian-yin1
(1.School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, China;2.Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210000, China)., 2019,39(3):1181~1188
15N stable isotope tracer technique was employed to study the effects of(),(Silver carp) and(bighead carp) polyculture on water environment and nitrogen migration and transformation. The results showed thateach nutrient salt concentration in the,silver carpandbighead carp group decreased rapidly after a brief increase and at the end of the test, while TN, TP, NO3--N,NO2--N and PO43--P respectively reached 2.67, 0.13, 0.93, 0.026 and 0.0035mg/L. The nutrient concentration of the silver carp and bighead carp group generally maintained an increasing trend and was significantly greater than the corresponding value of the,silver carp and bighead carp group after the 10th day (<0.05), while TN, TP, NO3--N, NO2--N and PO43--P of it were 1.80, 1.69, 1.73, 1.72 and 1.83 times of that group when the experiment was over. Chl a and the cell density of algae in the fish group decreased significantly compared with the control group, while the silver carpandbighead carp group reaching 34.69mg/m3, 1.96´106cells/L and the, silver and bighead carpgroup reaching 25.32mg/m3, 1.9´106cells/L respectively at the end of the test, which were significantly lower than the control group (<0.05). The isotope analysis showed thatmarked15N was assimilated partly by thesilver carp and bighead carp body and entered the water body through fish secretion and excretion, then the nitrogen in water were absorbed by algae after being put into the water. In addition, somesedimentation and fish excrement were assimilated as the sedimentary humus into the body ofby ingestion.
stable isotope technique;;and;
X52
A
1000-6923(2019)03-1181-08
陈玲玲(1992-),女,江苏泰州人,苏州科技大学硕士研究生,主要从事水环境治理和流域生态保护研究方向.
2018-08-07
国家水体污染控制与治理重大专项课题(2017ZX07202006);中央级公益性科研院所基本科研业务专项(GYZX160105);长江经济带突发事故环境风险分级与防控对策研究(GYZX170104)
* 责任作者, 研究员, zym7127@163.com

