葡萄STS基因家族的鉴定与表达分析
陈洪强,夏 惠,王 进,邓群仙,梁 东,吕秀兰,*,唐礼平
(1.四川农业大学 园艺学院,四川 成都 611130; 2.广安市前锋区农业局,四川 广安 638019)
芪类化合物是一种重要的植物酚类物质,目前发现该类化合物只存在于少数植物中,如葡萄(Vitisvinifera)、花生(Arachishypogaea)、日本虎杖(Fallopiajaponica)、高粱(Sorghumbicolor)和松类植物(Pinus)[1]等。芪类化合物在植物中主要以白藜芦醇(resveratrol)及其糖基化、甲基化和氧化形成的衍生物等形式存在[2]。芪类化合物不仅在植物抵御逆境胁迫或病原菌侵染的防御反应中发挥重要作用[3],而且还具有多种有益于人体健康的生物学活性功能,在抗肿瘤、预防心血管疾病、控制血糖、保护神经系统和抗炎等方面发挥重要作用[4-5]。
芪类化合物的生物合成是通过苯丙氨酸代谢途径(Phenylpropanoid pathway)进行的。首先是苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)作用下生成肉桂酸(cinnamic acid),之后肉桂酸在肉桂酸-4-羟基化酶(cinnamate 4-hydroxylase,C4H)作用下生成4-香豆酸(4-coumaric acid),接着4-香豆酸通过4-香豆酰辅酶A连接酶(4-coumarate: CoA ligase,4CL)与泛酰巯基乙胺CoA连接,生成香豆酰CoA(4-coumaroyl-CoA),最后芪合成酶(stilbene synthases,STS)催化1个4-香豆酰辅酶A和3个丙二酰辅酶A(malonyl-CoA)生成白藜芦醇[2]。研究表明,在这个途径中,STS是合成芪类化合物的关键酶,该酶属于Ⅲ型聚酮合酶家族[6],在大多数合成白藜芦醇的植物中以基因家族的形式存在。如花生中有2 个STS基因被克隆[7],欧洲赤松(Pinussylvestris)中发现了4个STS基因[8],从日本红松(Pinusdensiflora)中也已获得了3个STS基因[9]。葡萄中也发现多个STS存在,早期通过Southern-blot试验证明葡萄基因组中有超过20个STS基因[10]。在黑比诺葡萄(Vitisviniferacv. Pinot noir)基因组测序完成之后,Parage等[11]和Alessandro等[12]分别发现了32个和33个STS基因全长,在毛葡萄(Vitisquinquangularis)品种丹凤-2中也发现了41个STS基因[13]。
葡萄是一种世界范围内广泛种植的水果,葡萄与以葡萄为原料的加工产品是食物中白藜芦醇类化合物旳主要来源。近十年来,葡萄种植在中国发展很快,目前已形成多个葡萄种植集中区,其中就包括以云南、贵州、广西和四川为主的西南产区[14]。本研究以四川盆地广泛种植的夏黑葡萄为试材,对其STS进行了全基因组鉴定,并检测STS基因家族成员在果实和叶片生长过程的表达特性,为深入研究芪类物质的生物合成奠定基础。
1 材料与方法
1.1 植物材料
供试材料为四川省崇州市桤泉镇四川农业大学科研基地4年生夏黑葡萄,单干四主蔓水平棚架,避雨栽培,株行距为1.5 m × 3.0 m。在葡萄谢花后20、30、40、50、60、70、80和90 d收集葡萄果实样品带回实验室。取果皮在液氮中速冻后存于-80 ℃备用。在花后90 d,在结果枝上分别取顶端、中部和基部叶片作为幼叶、成熟叶和衰老叶,液氮速冻后存于-80 ℃备用。
1.2 葡萄STS基因家族鉴定与序列分析
葡萄全基因组数据文件来源于葡萄基因组数据库(http://genomes.cribi.unipd.it/grape和https://phytozome.jgi.doe.gov/pz/portal.html)。在Pfam(http://pfam.xfam.org)中获取STS基因家族序列特征文件(PF00195和PF02797),使用HMMER软件并以PF00195和PF02797为种子序列检索比对葡萄基因组中的氨基酸序列文件(12X V2版),并候选E≤10-5的序列作为候选蛋白序列,删除重复序列、不完整序列和不能编码氨基酸的序列。对获得的葡萄STS成员根据其染色体定位顺序进行命名。利用MEME(http://meme.nbcr.net/meme)工具鉴定葡萄STS蛋白的保守基序,参数设置为基序数量8个。利用MEGA 6.0软件构建系统进化树,进化树生成算法为(Neighbor-Joining,NJ),校验参数Bootstrap重复1 000。
1.3 葡萄RNA的提取和STS基因的半定量表达
总RNA的提取参照RNeasy plant mini kit试剂盒(Qiagen)使用说明书进行,提取后使用DNase Ⅰ降解RNA中存留的DNA。用Nanodrop ND-2000 spectrophotometer(Thermo)进行定量,取1 mg总RNA,用RevertAid M-MuLV反转录酶(Fermentas)0.5 mg oligo(dT)18进行反转录。使用Taq DNA Polymerase(Promega)对反转录产物进行PCR扩增(引物见表3)。RT-PCR反应程序为95 ℃ 20 s,50 ℃ 30 s,72 ℃ 60 s,25个循环。扩增结束后在1.5%琼脂糖凝胶上进行电泳,使用凝胶成像系统拍照。
2 结果与分析
2.1 STS基因家族全基因组鉴定和序列分析
以PFAM数据库中的STS氨基酸保守序列文件(PF00195和PF02797)为种子序列,利用HMMER软件搜索葡萄基因组中的氨基酸序列数据,结果共发现了48个葡萄STS候选基因,根据它们在染色体上的相对位置依次命名为VvSTS1—VvSTS48,其中VvSTS1—VvSTS6位于10号染色体,而VvSTS7—VvSTS48位于16号染色体。对以上48个序列逐个进行人工序列分析,结合以前对葡萄STS基因序列的研究,发现VvSTS2、VvSTS8、VvSTS11、VvSTS12、VvSTS13、VvSTS14、VvSTS25、VvSTS26、VvSTS33和VvSTS34的开放阅读框不完整,有序列缺失现象;而VvSTS1、VvSTS3、VvSTS4、VvSTS18、VvSTS40和VvSTS44虽然序列长度符合,但不能翻译为正确的氨基酸序列。
除去以上序列,本文对剩余的32个STS基因序列进行了下一步的序列分析(表1)。分析结果表明,葡萄STS基因非常保守,均由2个外显子和1个内含子组成。所有基因的第1个外显子长度为178 bp,第2个外显子的长度为1 001 bp,但内含子长度变化较大,长度为138~389 bp。所有的STS基因开放阅读框长度一致,因此,葡萄STS基因均编码392个氨基酸。DNAMAN分析结果表明,葡萄STS基因家族成员氨基酸序列之间的一致性非常高,平均一致性为96.64%,最高一致性为99.7%(VvSTS35和VvSTS45、VvSTS35和VvSTS41、VvSTS45和VvSTS41),最低一致性为90.6%(VvSTS32和VvSTS38)。利用MEGA 5分析葡萄STS基因家族系统进化情况,根据进化关系将它们分为3组(图1):A组包括VvSTS5和VvSTS6,位于10号染色体;B组和C组含有的成员较多,均位于16号染色体。利用MEME在线工具分析不同STS基因家族成员的蛋白序列保守基序,共得到8个保守基序(图1),分别命名为Motif 1—Motif 8,这些基序为所有STS基因共有(表2)。
表1葡萄STS基因家族鉴定
Table1Identification ofSTSgene family in grape

基因名称Gene names外显子1染色体位置Location of exon 1 in chromosome外显子2染色体位置Location of exon 2 in chromosome内含子长度Length of intron/bp基因在染色体上的方向Direction of genein chromosomeVvSTS5chr10: 14298957..14299134chr10: 14299520..14300520387正向PlusVvSTS6chr10: 14304787..14304964chr10: 14305350..14306350387正向PlusVvSTS7chr16: 16239028..16239205chr16: 16239564..16240564360正向PlusVvSTS9chr16: 16268816..16268993chr16: 16269352..16270352360正向PlusVvSTS10chr16: 16276570..16276747chr16: 16277105..16278105359正向PlusVvSTS15chr16: 16335697..16335874chr16: 16336233..16337233360正向PlusVvSTS16chr16: 16344516..16344339chr16: 16344202..16343202138反向MinusVvSTS17chr16: 16347949..16347772chr16: 16347580..16346580193反向MinusVvSTS19chr16: 16368410..16368233chr16: 16367907..16366907327反向MinusVvSTS20chr16: 16387529..16387352chr16: 16387013..16386013340反向MinusVvSTS21chr16: 16398234..16398411chr16: 16398770..16399770360正向PlusVvSTS22chr16: 16406519..16406342chr16: 16406205..16405205138反向MinusVvSTS23chr16: 16409837..16409660chr16: 16409469..16408469192反向MinusVvSTS24chr16: 16413317..16413140chr16: 16412948..16411948193反向MinusVvSTS27chr16: 16468549..16468372chr16: 16468015..16467015358反向MinusVvSTS28chr16: 16478613..16478436chr16: 16478097..16477097340反向MinusVvSTS29chr16: 16493131..16492954chr16: 16492597..16491597358反向MinusVvSTS30chr16: 16505168..16504991chr16: 16504636..16503636356反向MinusVvSTS31chr16: 16509479..16509302chr16: 16508942..16507942361反向MinusVvSTS32chr16: 16511216..16511393chr16: 16511602..16512602210正向PlusVvSTS35chr16: 16527862..16527685chr16: 16527326..16526326360反向MinusVvSTS36chr16: 16557435..16557258chr16: 16556945..16555945314反向MinusVvSTS37chr16: 16588984..16588807chr16: 16588447..16587447361反向MinusVvSTS38chr16: 16608730..16608553chr16: 16608176..16607176378反向MinusVvSTS39chr16: 16617258..16617081chr16: 16616702..16615702380反向MinusVvSTS41chr16: 16624624..16624447chr16: 16624086..16623086362反向MinusVvSTS42chr16: 16629091..16628914chr16: 16628536..16627536379反向MinusVvSTS43chr16: 16645747..16645570chr16: 16645190..16644190381反向MinusVvSTS45chr16: 16675524..16675347chr16: 16674986..16673986362反向MinusVvSTS46chr16: 16684264..16684087chr16: 16683709..16682709379反向MinusVvSTS47chr16: 16699842..16699665chr16: 16699303..16698303363反向MinusVvSTS48chr16: 16711818..16711641chr16: 16711281..16710281361反向Minus
2.2 STS基因家族的表达
为了分析葡萄STS基因家族成员在果实生长过程中的表达,本研究结合遗传进化树的聚类结果,选择VvSTS5、VvSTS10、VvSTS16、VvSTS17、VvSTS19、VvSTS27、VvSTS35、VvSTS36和VvSTS42作为代表,通过半定量RT-PCR进行了基因表达研究,所用引物见表3。
半定量RT-PCR的结果(图2)表明:在果实生长过程中,A组的VvSTS5在花后20~30 d表达量逐渐降低,花后40 d基本恢复到花后20 d的水平,但随后表达量再次下降;花后70~80 d表达水平达到最高,花后90 d略有下降。B组中,VvSTS10和VvSTS42的表达水平在花后20~80 d基本不变,只是在花后90 d略有下降;VvSTS35和VvSTS27的表达水平均在花后20、40和80 d较高,其余时期表达水平较低,但VvSTS35的表达水平总体上低于VvSTS27;VvSTS36的表达水平在花后20 d较高,随后逐渐下降,直到花后50 d开始升高直至花后80 d达到最高水平。C组的VvSTS19和VvSTS17在整个果实生长过程中表达水平一直较高,特别是花后20、40和80 d;VvSTS16的表达变化趋势与B组的VvSTS36基本一致。总体来说,大多数葡萄STS基因在花后20~40 d和花后70~80 d的表达水平较高。

图1 葡萄STS基因家族系统进化和蛋白保守基序Fig.1 Phylogenetic tree and amino acid motifs of STS proteins in grape
表2葡萄STS基因家族氨基酸序列保守基序
Table2Motifs sequence ofSTSgenes in grape

序号Motif No.序列Consensus sequenceMotif 1LVYQSDYADGTFRVT Motif 2LKAJKEYGRAKSKATHLVIDT Motif 3GNLREVGLTFHLWPNVPTLISENIEK-CLTQAFDPLGISDWNSLFWIAHPG Motif 4MRKKSLKGEKATTGEGLDWGVLFGFG-PGLTIETVVLHSVPM Motif 5HPGIGAYLANSLNJEQEVIRA Motif 6KDLAENNAGAR Motif 7EVPKLGKEMotif 8SEGAJD
A,丙氨酸;C,半胱氨酸;D,天冬氨酸;E,谷氨酸;F,苯基丙氨酸;G,甘氨酸;H,组氨酸;I,异亮氨酸;K,赖氨酸;L,亮氨酸;M,蛋氨酸;N,天冬酰胺;P,脯氨酸;Q,谷氨酰胺;R,精氨酸;S,丝氨酸;T,苏氨酸;V,缬氨酸;W,色氨酸;Y,络氨酸。
A, Alanine; C, Cysteine; D, Aspartic acid; E, Glutamic acid; F, Phenylalanine; G, Glycine; H, Histidine; I, Isoleucine; K, Lysine; L, Leucine; M, Methionine; N, Asparagine; P, Proline; Q, Glutamine; R, Arginine; S, Serine; T, Threonine; V, Valine; W, Tryptophan; Y, Tyrosine.
2.3 不同时期叶片中STS基因家族的表达
STS基因家族在不同时期叶片中的表达模式可以分为3种类型(图3):(1)VvSTS10、VvSTS19、VvSTS27和VvSTS35在不同时期叶片中表达水平基本不变;(2)VvSTS5和VvSTS16的表达趋势一致,即在成熟叶和衰老叶中的表达水平要显著高于幼叶;(3)VvSTS17、VvSTS36和VvSTS42在成熟叶中的表达水平要显著高于幼叶和衰老叶。总体来看,葡萄STS基因在成熟叶和衰老叶中的表达水平要高于幼叶。
3 讨论
迄今为止,人们已经从花生、高粱、松树和葡萄等一些植物中获得了多个STS基因。在花生[7]和松树[8-9]中,STS是由2~5个成员构成的基因家族,而高粱的基因组中却只发现了1个STS基因[15]。但是,自葡萄基因组测序完成后,多个研究结果表明,STS基因在葡萄中数量较多,达到40余个,而且大部分具有完整开放阅读框[11-13]。在本研究中,我们也从葡萄基因组中鉴定出48个可能的STS基因,经过序列分析,最终确定了32个能编码完整STS蛋白的序列用于后续研究。
表3半定量RT-PCR引物
Table3Primers used for semi-quantitative RT-PCR
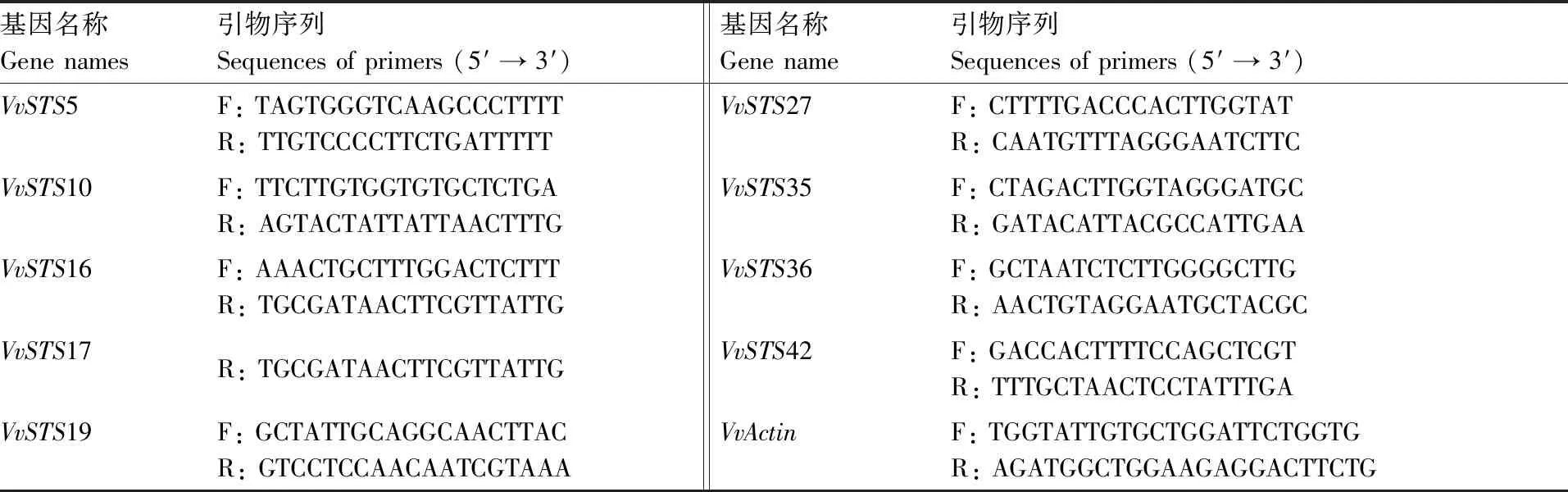
基因名称Gene names引物序列Sequences of primers (5′ → 3′)基因名称Gene name引物序列Sequences of primers (5′ → 3′)VvSTS5F: TAGTGGGTCAAGCCCTTTTR: TTGTCCCCTTCTGATTTTTVvSTS27F: CTTTTGACCCACTTGGTATR: CAATGTTTAGGGAATCTTCVvSTS10F: TTCTTGTGGTGTGCTCTGAR: AGTACTATTATTAACTTTGVvSTS35F: CTAGACTTGGTAGGGATGCR: GATACATTACGCCATTGAAVvSTS16F: AAACTGCTTTGGACTCTTTR: TGCGATAACTTCGTTATTGVvSTS36F: GCTAATCTCTTGGGGCTTGR: AACTGTAGGAATGCTACGCVvSTS17R: TGCGATAACTTCGTTATTGVvSTS42F: GACCACTTTTCCAGCTCGTR: TTTGCTAACTCCTATTTGAVvSTS19F: GCTATTGCAGGCAACTTACR: GTCCTCCAACAATCGTAAAVvActinF: TGGTATTGTGCTGGATTCTGGTGR: AGATGGCTGGAAGAGGACTTCTG

20、30、40、50、60、70、80、90代表花后天数(d)。20, 30, 40, 50, 60, 70, 80 and 90 meant days after full bloom (DAFB).图2 葡萄STS基因在果实生长过程中的表达Fig.2 Expression patterns of STS genes during development of grape berries

Y,幼叶;M,成熟叶;S,衰老叶。Y, Young leaves; M, Mature leaves; S, Senescent leaves.图3 葡萄STS基因在不同时期叶片中的表达Fig.3 Expression patterns of STS genes in different status leaves of grape
STS基因家族成员在葡萄中数量众多,这种现象其实在葡萄中比较常见,特别是一些次生代谢相关基因家族。比如,在葡萄中发现了13个苯丙氨酸解氨酶基因,但在拟南芥、水稻和杨树中的数量却只有4~8个[16]。葡萄中萜烯合成酶和类黄酮-3’,5’-羟化酶基因家族成员的数量也分别达到35和13个[16-17]。以前的研究[11-13]和本研究均发现,绝大部分STS基因位于16号染色体上一个450~500 kb的区段,在这个区段中存在着大量旁系同源区域,而这些旁系同源区域正是由于基因复制而形成的[12]。葡萄基因组的研究结果也表明,17.5%的葡萄染色体是通过复制形成的,而且还发现16号染色体中的片段复制比例在所有染色体中最高,达到了25.08%[18]。因此,我们认为葡萄次生代谢相关的许多基因家族成员众多的这种现象主要和葡萄基因组的多次复制有关,多次复制导致基因丢失和基因重组现象的发生,也进而影响基因的拷贝数,这也是基因组和遗传体系进化的主要动力之一[19-20]。
在赤霞珠[21]和蛇龙珠[22]葡萄果实生长过程中,白藜芦醇含量在花后40 d以前、转色至始熟期含量较高,呈双峰曲线。Shi等[13]在毛葡萄和欧洲葡萄的研究中也发现同样的趋势。Gatto等[23]的研究也发现,从转色期到始熟期是白藜芦醇快速积累期。STS是合成白藜芦醇的关键酶,本研究的结果表明,大多数的STS基因在花后20~40 d和花后70~80 d表达水平较高,尤其是VvSTS5、VvSTS19、VvSTS26、VvSTS27和VvSTS35等,这样的结果也表明以上几个STS基因与果实生长过程白藜芦醇的生物合成密切相关。另外,在栽培实践中,葡萄成熟期一般都会进行控水,这会在一定程度上使葡萄受到干旱胁迫,而STS是一种胁迫诱导型表达基因,因而果实成熟期STS表达水平较高。
在本研究中,我们发现大多数的葡萄STS基因在成熟叶或衰老叶中的表达水平要高于幼叶,或者至少与幼叶的表达水平相当。Alessandro等[12]也发现很多葡萄STS基因在衰老叶中的表达水平要高于幼叶。叶片向成熟和衰老发展的过程受到精密调控,在这个过程中叶片细胞会对一些衰老基因、内源信号和外界环境产生响应[24]。这些外界环境往往会是一些非生物逆境(干旱、高温)和生物逆境(病原菌),在这些逆境的作用下,具有胁迫响应特性的STS基因表达水平也会升高。另一方面,成熟和衰老过程中会产生更多的脱落酸、乙烯、水杨酸和茉莉酸等内源激素,一些试验证明这些内源激素可以提高STS基因的表达和芪类化合物的合成[25-26]。Xu等[27-28]还发现,葡萄STS基因启动子序列中存在很多响应脱落酸、乙烯、水杨酸和茉莉酸的顺式作用元件。因此,我们认为在成熟和衰老过程中产生的越来越多的上述内源激素,会不断增强STS基因启动子的活性,从而促进STS基因的表达。

