高质量酒曲的制备工艺及酒曲活力评价
张翠翠,郭 波,陈雅轩,余永强,周世水*
(1.华南理工大学生物科学与工程学院,广东广州 510006;2.广东省石湾酒厂集团有限公司,广东佛山 528200)
酒的质量很大程度上取决于酒曲质量。酒曲中含有多种微生物及其产生的复杂酶系,是中国白酒酿造必不可少的糖化剂、发酵剂和生香剂[1]。
酒曲作为糖化剂,具有丰富的淀粉酶。常见的淀粉酶可分为α-淀粉酶(也称液化酶)、β-淀粉酶、葡萄糖淀粉酶(也称γ-淀粉酶,简称糖化酶)和异淀粉酶等[2]。米根霉是大曲中的主要根霉,含有极为丰富的糖化型淀粉酶[3]。黑曲霉是产生葡萄糖淀粉酶的典型菌株,大多数黑曲霉的糖化酶能水解80%以上的淀粉[4]。黑曲霉和米根霉能将淀粉转化为可发酵性糖,是糖化菌种。
根据制曲工艺不同,将酒曲可分为大曲、小曲、麸曲等。其中,麸曲因其制作周期短、出酒率高、节约粮食、成本低等优点而被广泛应用,但用量一旦加大,麸皮本身带有的涩感会影响蒸馏白酒的口感。笔者以黑曲霉和米根霉为菌种制曲,以提高酒曲质量为目的优化培曲条件,并用甜米酒和米酒相关指标来评价酒曲活力,以期为后续白酒生产提供建设性指导。
1 材料与方法
1.1材料
1.1.1菌种。酿酒酵母、黑曲霉和米根霉均由华南理工大学发酵工程实验室保存;酒曲来自A酒厂和B酒厂。
1.1.2培养基。①酵母浸出粉胨葡萄糖培养基:葡萄糖 20 g/L,酵母浸膏 10 g/L,蛋白胨 20 g/L。②PDA培养基:用于黑曲霉和米根霉的培养。马铃薯200 g/L,葡萄糖 20 g/L,琼脂 15~20 g/L。③米酒发酵培养基:称取20 g糯米装入250 mL高形烧杯中,加入50 mL水浸泡8 h,115 ℃下灭菌20 min。
1.1.3仪器与设备。TGL-18C高速台式离心机,为上海安亭科学仪器厂产品;UV-2700紫外可见分光光度计,为岛津仪器(苏州)有限公司产品。
1.2方法
1.2.1酒曲制作和制曲条件优化。将制曲原料装入250 mL三角瓶,0.1 MPa灭菌30 min,分别接入7.5×107CFU/mL的黑曲霉和米根霉孢子液后培养。以糖化酶酶活和液化酶酶活为指标,进行装料量(6、10、14、18、22 g),培曲时间(1、2、3、4、5、6 d),原料组成(大米、大麦芽、麸皮,其中大米∶麸皮=1∶1,大米∶大麦芽=1∶1,大麦芽∶麸皮=1∶1,大米∶麸皮∶大麦芽=1∶1∶1)优化试验。
1.2.2甜米酒生产工艺流程。甜米酒生产工艺流程如图1所示。其中黑曲霉曲与米根霉曲按1∶5的比例混合,接种时酒曲添加量为1%(质量百分比)。

图1 甜米酒生产工艺流程Fig.1 The production process of sweet rice wine
1.2.3米酒发酵。采用“1.2.2”方法将米酒糖化一段时间,接入酿酒酵母3%(v/v)发酵一段时间后测定酒精度。
1.2.4糖化发酵试验。测定酒厂A和酒厂B的酒曲与该试验酒曲的糖化酶和液化酶酶活大小,并在相同试验条件下进行糖化发酵试验,测定生成的总糖、还原糖含量和发酵后酒精度。
1.2.5酒曲活力评价。选取不同液化酶酶活的米根霉曲和不同糖化酶酶活的黑曲霉曲各5种,标记为1#~5#,不同酒曲组合发酵试验,选取黑曲霉1#,分别混合米根霉曲1#~5#配制酒曲;同理选取米根霉曲1#,分别混合黑曲霉曲1#~5#配制酒曲。按照“1.2.2”方法进行甜米酒试验,再按照“1.2.3”方法进行米酒发酵试验。根据测得的糖化酶和液化酶酶活及总糖、还原糖含量、酒精度,综合评价酒曲活力。
1.3测定项目与方法
1.3.1酶活。粗酶液的制备按照文献[5]的方法进行。液化酶酶活的测定参照文献[6]的方法;糖化酶酶活的测定参照文献[7]的方法。
1.3.2总糖含量和酒精度。参照文献[8]的方法测定总糖含量和酒精度。
1.3.3还原糖含量。参照文献[9]的方法测定还原糖含量。
2 结果与分析
2.1糖化酶和液化酶酶活测定结果
2.1.1米根霉曲和黑曲霉曲产酶酶活比较。由图2可知,黑曲霉曲的液化酶活性低,糖化酶活性高,而米根霉曲则相反。在以下试验中用黑曲霉曲测定糖化酶酶活,用米根霉曲测定液化酶酶活。

图2 黑曲霉曲和米根霉曲产酶酶活的比较Fig.2 Comparison of enzyme activities between A.niger and R.oryzae
2.1.2装料量对糖化酶和液化酶酶活的影响。米根霉曲和黑曲霉曲的生长环境需要一定的氧气、温度和湿度,三角瓶独特的内部环境能保证曲菌生长所需条件。米根霉和黑曲霉生长繁殖需要足够的空气,而且酶的生成量也与空气供给量有关。瓶内底层原料堆积高度也会影响曲菌与空气的总接触面积。由图3可知,装料量为10 g时对二者酶活的影响最大,其中米根霉曲液化酶酶活达到56 U/g,黑曲霉曲糖化酶酶活达到1 140 U/g。

图3 不同装料量对液化酶和糖化酶酶活的影响Fig.3 The effects of different loading amount on the activities of liquefaction enzyme and glucoamylase
2.1.3酒曲培养时间对液化酶和糖化酶酶活的影响。 曲霉菌是一边生长一边产酶,曲霉培养的最终目的是使其酶活较高,以便获得较高的起酵力。酒曲培养时间会影响米根霉和黑曲霉菌丝体和孢子的数量。若培养时间过长,曲霉的营养物质减少,不利于曲霉的生长和产酶。菌丝体较多而含孢子数较少的根霉曲产品由于具有较高的糖化酶活性,接种后有利于根霉孢子的萌发和菌丝体的前期生长[10]。由图4可知,黑曲霉曲的最佳培养时间为5 d,米根霉曲的最佳培养时间为4 d。
2.1.4酒曲原料对液化酶和糖化酶酶活的影响。曲霉菌在生长过程所需的碳源以淀粉最佳,曲霉的菌体及其所含酶类是由蛋白质组成,制曲需要足够的氮源[11]。制曲原料麸皮中含有丰富的淀粉、粗蛋白和灰分等营养物质,足以供制曲需要。麸皮还含有多种维生素和金属离子,在发酵过程中既可为菌株生长提供碳源,又能提供氮源,其中还含有一定量的果胶,为糖化酶的产生起到一定的诱导作用[4];大米的主要营养物质为蛋白质、脂肪和淀粉,而大麦芽含有丰富的酶类,经高温灭菌后可提供丰富的氮源。由图5可知,黑曲霉曲糖化酶酶活最高的制曲原料为麸皮∶大麦芽(1∶1),米根霉曲液化酶酶活最高的制曲原料为麸皮。
2.2糖化发酵试验结果
2.2.1甜米酒糖化试验。采用“1.2.2”中甜米酒制作方法,每隔2 h测定甜米酒中总糖含量,绘制糖化曲线。米根霉和黑曲霉有边生长边产酶糖化的特点,产糖化型淀粉酶将糯米中淀粉最终转变为可发酵性糖。由图6可知,在糖化前期,因为酒曲液化酶酶活和糖化酶酶活较高,生成可发酵性糖的增长速度较快;在糖化中期,随着糯米中淀粉浓度的下降和糖分提高,对曲霉生长产生抑制作用,糖化速度逐渐减慢,18 h总糖含量达到最大值,为17.5%;在糖化后期,米根霉和黑曲霉生长量达到最大值,在产糖化型淀粉酶的同时也能产酸,会将可发酵性糖转变为酸类物质,导致总糖含量下降。如果进行先糖化后发酵试验可在糖化18 h后接入酿酒酵母,以最大程度产生乙醇。
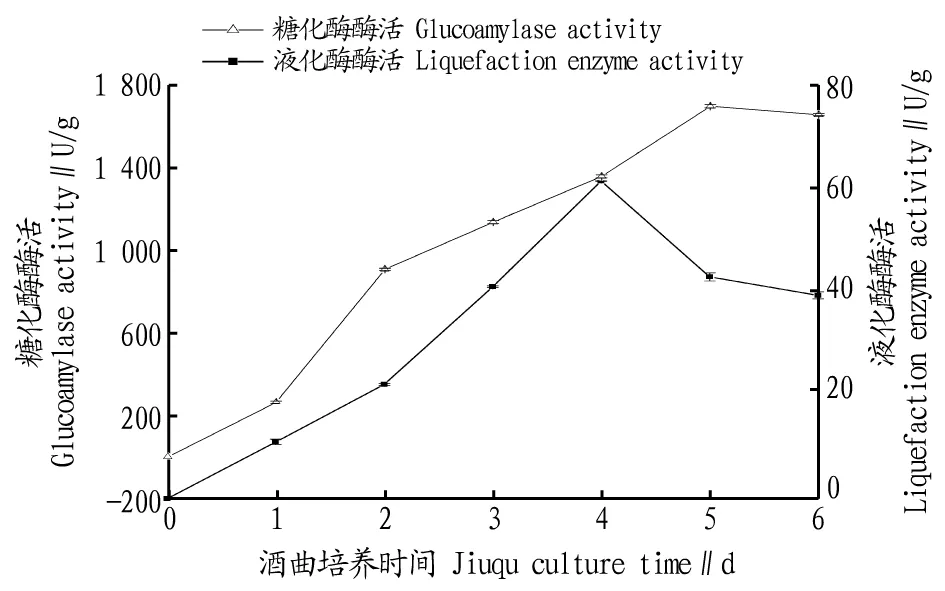
图4 酒曲培养时间对液化酶和糖化酶酶活的影响Fig.4 The effects of culture time of jiuqu on the activities of liquefaction enzyme and glucoamylase

图5 酒曲原料对液化酶和糖化酶酶活的影响Fig.5 The effects of jiuqu’s raw materials on activities of liquefaction enzyme and glucoamylase
2.2.2米酒发酵试验结果。甜米酒糖化18 h后,接入酿酒酵母进行米酒发酵试验,结果见图7。曲霉菌除具有较强的糖化力外,还兼有一定的发酵力[12]。由图7可知,在没有酿酒酵母接入时也会产生少量的乙醇,酒精度在发酵3 d前增长速度快,此后增长速度趋慢。随着发酵的推进,增加乙醇量会对酿酒酵母产生抑制作用,发酵体系也会利用分解乙醇产生酸或醛等其他代谢物质,酒精度增加一定量后会慢慢下降。
2.3不同酒曲对比试验结果由图8可知,米根霉曲液化酶酶活高于A厂和B厂酒曲。米根霉曲液化酶酶活比A厂酒曲高179.5%,比B厂酒曲高163.1%。

图6 甜米酒糖化曲线Fig.6 The saccharification curve of sweet rice wine

图7 米酒发酵产酒精度的变化曲线Fig.7 The variation curve of alcohol content produced by rice wine fermentation

图8 不同酒曲的液化酶酶活大小比较Fig.8 Comparison of liquefaction enzyme activities among different jiuqu
由图9可知,黑曲霉曲糖化酶酶活高于A厂和B厂酒曲;黑曲霉曲糖化酶酶活比A厂酒曲高12.4%,比B厂酒曲高122.1%。
由图10可知,在相同试验条件下以该研究中酒曲为对照组进行糖化发酵试验,糖化18 h后对照组还原糖含量最高,发酵3 d后对照组酒精度最高。其中该试验酒曲产生的还原糖含量比添加A厂酒曲生成的还原糖含量高11.9%,比添加B厂酒曲生成的还原糖含量高169.2%;发酵酒精度比添加A厂酒曲生成的酒精度高6.4%,比添加B厂酒曲生成的酒精度高30.1%。
2.4糖化酶和液化酶酶活与总糖含量、还原糖含量、酒精度的关系分析在甜米酒糖化18 h接入酿酒酵母,按照“1.2.5”中试验组合进行米酒发酵,3 d后蒸馏测定酒精度。由表1可知,在不同酒曲组合中,加入相同的黑曲霉曲使糖化酶酶活不变的情况下加入不同液化酶酶活的米根霉曲,结果发现起始液化酶酶活高的试验组分解淀粉生成麦芽糖、糊精等物质的数量多,起始糖化酶酶活力相同的情况下最终转变为可发酵性糖数量较多,从而米酒发酵产酒精度高。

图9 不同酒曲的糖化酶酶活比较Fig.9 Comparison of saccharification enzyme activities among different jiuqu

图10 不同酒曲糖化发酵试验结果的比较Fig.10 The comparison of saccharification and fermentation experiment results among different jiuqu
Table1Relationshipbetweenliquefactionenzymeactivityandtotalsugarcontent,reducingsugarcontentandalcoholcontent

组别Group液化酶酶活Liquefaction enzyme activityU/g总糖含量Total sugarcontent%还原糖含量Reducing sugar contentg/L酒精度Alcohol content%①80.06816.982.71118.1②55.21916.771.15917.1③28.30016.665.87916.8④18.29116.460.79816.5⑤15.53015.655.75616.4
由表2可知,在不同酒曲组合中,当米根霉曲不变时加入糖化酶酶活不同的黑曲霉曲,结果发现起始糖化酶酶活高的试验组可发酵性糖的含量较高,米酒发酵产酒精度高。
由表1、表2可知,甜米酒培菌糖化过程中,米根霉和黑曲霉边生长、边产酶、边糖化,起始酶活高的试验组最终生成可发酵性糖多。在甜米酒试验的基础上添加酿酒酵母,起始酶活高的试验组发酵产酒精度高。因此,通过甜米酒和米酒发酵试验可确定酒曲起始酶活,用于判断酒曲活力。
表2糖化酶酶活与总糖含量、还原糖含量和酒精度的关系
Table2Relationshipbetweenglucoamylaseactivityandtotalsugarcontent,reducingsugarcontentandalcoholcontent

组别Group糖化酶酶活Glucoamylase activityU/g总糖Total sugar%还原糖Reducing sugarg/L酒精度Alcohol content%①2 451.60817.574.09717.5②1 698.50117.273.70017.4③1 018.10815.866.23716.9④1 324.54417.172.82717.3⑤1 090.82116.770.84217.0
3 结论
笔者研究高质量酒曲与酒曲中黑曲霉的糖化酶活、米根霉的液化酶酶活的关系,在保证氧气、湿度和温度的条件下,250 mL三角瓶装料量10 g时米根霉曲和黑曲霉曲的生长产酶酶活较高,其中黑曲霉曲培养5 d,制曲原料为麸皮∶大麦芽(1∶1)时获得糖化酶酶活最高,达到1 640 U/g;米根霉曲培养4 d,培曲原料为麸皮时获得液化酶酶活最高,达到56 U/g。该研究中酒曲酶活均高于A厂酒曲和B厂酒曲。
将制备的酒曲进行甜米酒试验,糖化时间为18 h时总糖含量最高达到17.5%,继续进行米酒发酵试验,发现米酒前3 d酒精度增加速度最快,发酵5 d酒精度达到18.4%。该研究酒曲糖化后还原糖含量为88 g/L,均高于A厂和B厂酒曲,3 d后发酵酒精度为13.4%,也高于添加A厂和B厂酒曲。因此,不同酒曲组合试验结果表明起始糖化酶和液化酶酶活高,开始的糖化力较快,糖化速度快,产生可发酵性糖的数量较多,发酵产乙醇多。
酒曲质量与液化酶、糖化酶酶活有关,改变酒曲培养条件可以提高酒曲中液化酶和糖化酶酶活;通过测定酒曲的起始酶活以及甜米酒糖化和米酒酒精发酵,可综合判定酒曲的活力。

