围术期长期血糖控制对糖尿病SD大鼠术后伤口愈合的对比研究
向川,蔡龙,梁智勇,李帅杰
(山西医科大学第二医院骨科,山西 太原 030001)
糖尿病(Diabetes mellitus,DM)是一种因胰岛素分泌相对或绝对不足或靶细胞对胰岛素敏感性降低引起的以糖代谢紊乱为主,严重威胁人类健康的代谢障碍性疾病。据统计,目前全球约有2.85亿DM患者,预计2030年将达到4.39亿人[1]。在DM的诸多并发症中,伤口愈合能力受损是其中的一个典型并发症。如果伤口愈合不良或迁延不愈,则可能会出现致残,严重影响患者的生活质量[2]。目前临床中针对DM患者伤口不愈合的治疗方法有很多,且获得了较好的疗效。但临床工作中发现DM患者围手术期围术期内控制血糖水平后,术后仍出现一部分伤口愈合不良的现象。这可能是因长期的高血糖引起机体血管损伤,从而引起组织缺氧缺血,特别是微血管损伤[3-5]。因此,为提高DM病人的生活质量,血糖水平对术后伤口愈合的影响及其预防已成为如今探讨的焦点和亟需解决的问题。
伤口愈合过程是一个多分子、多细胞共同参与、彼此间相互协调的复杂且精细的过程,正常的伤口愈合由四阶段组成(凝血期、炎症期、增生期、修复期),它们连续发生并又相互交错,没有明显界线[6]。现已有许多研究证明,DM伤口愈合中的重要特征是炎症反应的紊乱以及促炎因子的大量释放和促伤口愈合因子的减少,最终致使伤口迁延不愈。炎症分子会受到血糖的调节,白介素-6(interleukin,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)能够明显抑制伤口愈合,主要由巨噬细胞产生,高血糖症能够增加炎症介质的释放,从而抑制胶原沉积和形成,并诱导大量成纤维细胞凋亡,最终使伤口难以愈合[7-8]。
如今,血糖过高容易引起各种并发症已达成共识,中华麻醉学分会指南指出,围术期血糖降低到一定水平,可以有效降低手术及麻醉风险[9]。但也有研究者发现,虽然围术期降低血糖水平能够有效降低伤口感染和不愈合的发生率,但临床工作中仍有部分患者伤口出现不愈合的现象。基于此,探求血糖控制时间对局部伤口的影响具有现实的意义。
1 材料与方法
1.1 动物 2月龄健康雄性SD大鼠,180~200g,由山西医科大学实验动物中心提供。
1.2 主要试剂 链脲佐菌素(streptozotocin,STZ)、ELISA试剂盒、兔抗F4/80单克隆抗体和山羊抗TNF-α多克隆抗体、兔抗热休克蛋白47(heat-shock protein 47,HSP47)多克隆抗体均购自Bioword。其它生化试剂均为进口分装。
1.3 主要方法
1.3.1 DM大鼠伤口模型建立 2月龄健康雄性SD大鼠适应性喂养2周禁食(不禁水)16 h后,一次性腹腔注射STZ进行造模,剂量60 mg/kg。STZ临用前用pH值为4.4、浓度为0.1 mmol/L的柠檬酸缓冲液配成2%STZ溶液。0.1 mol/L柠檬酸缓冲液调配:柠檬酸2.1 g、双蒸水100 mL、柠檬酸钠2.94 g、双蒸水100 mL,柠檬酸与柠檬酸钠溶液按1.3︰1比例混合均匀,用NaOH调pH值至4.4,高温高压灭菌,4℃冷藏备用。注射STZ 72 h后,尾静脉取血,随机血糖≥16.7 mmol/L确认为DM大鼠动物模型。稳定4周喂养后根据实验分组情况造模。以1.5%戊巴比妥钠(45 mL/kg)腹腔注射麻醉,15 min后将大鼠麻醉后俯卧于手术板上,四肢固定,背部剃毛,75%酒精常规消毒;用打孔器在大鼠背部锁骨下0.5 cm的背中线两侧分别打一圆孔,深达皮下筋膜层,直径0.5 cm。手术完毕后辅料敷贴固定。
1.3.2 动物分组 a)对照组A组:正常血糖SD大鼠按上述方法制作伤口模型作为对照,分别于造模后第1天、第3天、第7天、第14天(每个时间段3只)心脏取血并处死大鼠,提取创口样本。b)实验组:按上述方法制作DM模型,伤口造模前以及造模后均给予中效胰岛素(鱼干精蛋白锌胰岛素)皮下注射,4~8 U/d。根据血糖情况调整用量,每天分1~2次注射,控制随机血糖在13 mmol/L以下。将实验组分为B组:术前血糖控制1 d;C组:术前血糖控制3 d;D组:术前血糖控制7 d;E组:术前血糖控制1个月。在相同部位制作相同大小的伤口,分别于相同时点采取标本。
1.3.3 伤口愈合的形态学分析 a)计算机分析伤口愈合大体图像,计算创面愈合率。伤口愈合率(%)=(伤口初始面积-伤口形成后第n天的面积)/创面初始面积×100%;b)提取伤口样本并制作石蜡切片,常规HE染色,观察伤口的组织学变化。
1.3.4 ELISA检测 a)标本的采取、收集和保存:SD大鼠心脏采血,离心1 500 rpm,15 min。取上清液,-80℃保存。b)试剂的准备:从冰箱中取出试剂盒,降至与室温平衡后使用,自配的缓冲液应用pH计测量校正。蒸馏水或去离子水应为新鲜高质量的。c)加样:4次加样步骤(标准品、标本、酶结合物、底物),加样时注意不要溅出,不产生气泡,应加于酶标板底部。d)保温:塑料封贴纸封盖,水育箱中25℃温育。e)洗涤:ELISA就是靠洗涤实现分离游离的和结合的酶标记物。通过洗涤以清除残留在板孔中没能与固相抗原或抗体结合的物质,以及在反应过程中非特异性地吸附于固相载体的干扰物质。聚苯乙烯等塑料对蛋白质的吸附是普遍性的,而在洗涤时又应把这种非特异性吸附的干扰物质洗涤下来。可以说在ELISA操作中,洗涤是最主要的关键技术,应引起操作者的高度重视,操作者应严格按要求洗涤。f)显色和比色:采用酶标比色仪,测定吸光度OD值(A460 nm)。
1.3.5 免疫组织化学染色 a)组织切片进行脱蜡、水化,滴加3% H2O2室温孵育10 min。b)5%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h。c)滴加兔抗F4/80单抗体(稀释度1∶100)或兔抗HSP47多抗体(稀释度1∶400),在保湿盒内4℃孵育过夜;d)PBS洗涤切片,于存在生物素标记的IgG保湿盒内孵育0.5 h;e)滴加SP试剂,保湿盒内孵育1 h;f)DAB显色,苏木素复染,脱水、透明、封片。染色过程中阴性对照中的Ⅰ抗体为PBS。g)光学显微镜(×400)下每个标本随机选择10个损伤区视野,计算阳性染色细胞数。

2 结 果
2.1 DM大鼠伤口愈合形态学分析
2.1.1 伤口愈合率 糖尿病大鼠血糖控制组与正常对照组相比,从伤口造模后的第1天开始,伤口愈合率即出现明显差异性(40.44% vs 52.89%),且发现围术期内血糖控制组的愈合率低于长期血糖控制组;在伤口造模后的第14天,实验组中围术期内严格控制血糖的DM大鼠创面均未完全愈合,而正常对照组大鼠(A组)和长期血糖控制组大鼠(E组)伤口都已基本完全愈合。且随着术前血糖控制的时间越长,伤口愈合率会逐渐增加(见图1)。
2.1.2 组织形态学观察 a)正常组SD大鼠:皮肤进行切创造模后,切口愈合的初始阶段(第1~3天)即可看到切口已有大量的炎性细胞浸润,且在切创后的第7天左右,炎性细胞开始减少,但成纤维样细胞明显增多,且组织内并可见大量的新生毛细血管,这些结构共同组成新鲜肉芽组织,随后由于间质细胞增多,逐渐转变为瘢痕组织,达到伤口愈合。见图2。b)围术期内控制血糖SD大鼠组(即B、C、D组):切创后的SD大鼠,虽然术前血糖得到了短期的控制,但在切口愈合的初始阶段,皮肤愈合过程出现了紊乱,炎性细胞浸润程度明显低于正常组,但在术后的第5~7天左右,此时的炎性细胞大量浸润,其内只可见散在的少部分成纤维细胞和新生毛细血管。见图2。c)长期血糖控制SD大鼠组:由于切创造模前已给予长期的血糖控制,在切口愈合初期,部分炎性细胞浸润,且于愈合中期阶段,炎性细胞浸润程度较围术期内控制血糖组有改善,经过长期降糖,切口愈合过程后期有许多成纤维细胞及新生毛细血管生成,共同形成肉芽组织,随后向瘢痕组织逐渐转变(见图2)
2.2 ELISA检测TNF-α、IL-6水平
2.2.1 ELISA检测血清中TNF-α含量结果 与正常对照组相比,糖尿病大鼠组于切创造模后切口愈合的初始阶段起,血清中TNF-α的水平均明显增高,表现为高炎症反应(P<0.05);在术后切口愈合的中期阶段,实验组SD大鼠血清的TNF-α水平均出现下降趋势,但正常组TNF-α水平开始升高,且相比于围术期血糖控制组和长期血糖控制组,有明显差异性(P<0.05);在切口愈合第14天,与围术期控制血糖组相比,正常组血清中TNF-α水平明显增高(P<0.05),但和长期血糖控制组比较,差异无统计学意义(P>0.05,见表1)。
2.2.2 ELISA检测血清中IL-6含量结果 与对照组相比,糖尿病大鼠组于切创造模后切口愈合的整个阶段内,血清中IL-6的水平均明显增高,表现为高炎症反应;在术后切口愈合的后期阶段,切口愈合的第14天,与围术期控制血糖组相比,正常组血清中IL-6的水平明显较低(P<0.05),但和长期血糖控制组比较,差异无统计学意义(P>0.05,见表2)。
2.3 伤口愈合过程中巨噬细胞浸润特点
2.3.1 免疫组化检测伤口局部巨噬细胞浸润程度结果 实验采用F4/80免疫标记巨噬细胞并染色后观察到,与正常对照组相比,围术期控制血糖组切口组织愈合初期阶段巨噬细胞明显偏低(P<0.05),在切口愈合的中后期阶段,巨噬细胞浸润明显增多,表现为一种高炎症反应(P<0.05)。但与正常对照组相比,长期控制血糖组巨噬细胞浸润仍有增高倾向,两者相比差异有统计学意义(P<0.05,见表3)。
2.3.2 检测成纤维细胞数量结果 成纤维细胞修复软组织损伤,与周围新生毛细血管形成肉芽组织多发生于伤口愈合的中后期阶段,所以本研究中采用HSP47抗体免疫标记成纤维细胞观察第7天(见图3)以及第14天发现,与正常对照组相比,围术期控制血糖组切口组织内成纤维细胞数量均偏低(P<0.05),但与围术期控制血糖组相比,长期控制血糖组切口组织内成纤维细胞数量有所增加(P<0.05),并且与正常组比较差异无统计学意义(P>0.05,见表4)。
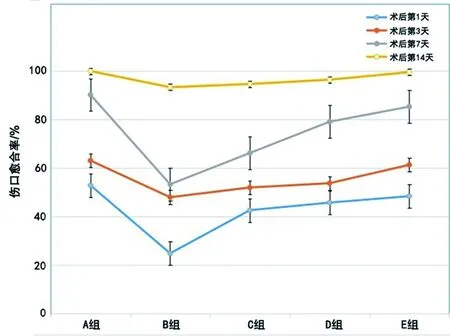
图1 不同时间段内各组SD大鼠伤口愈合情况
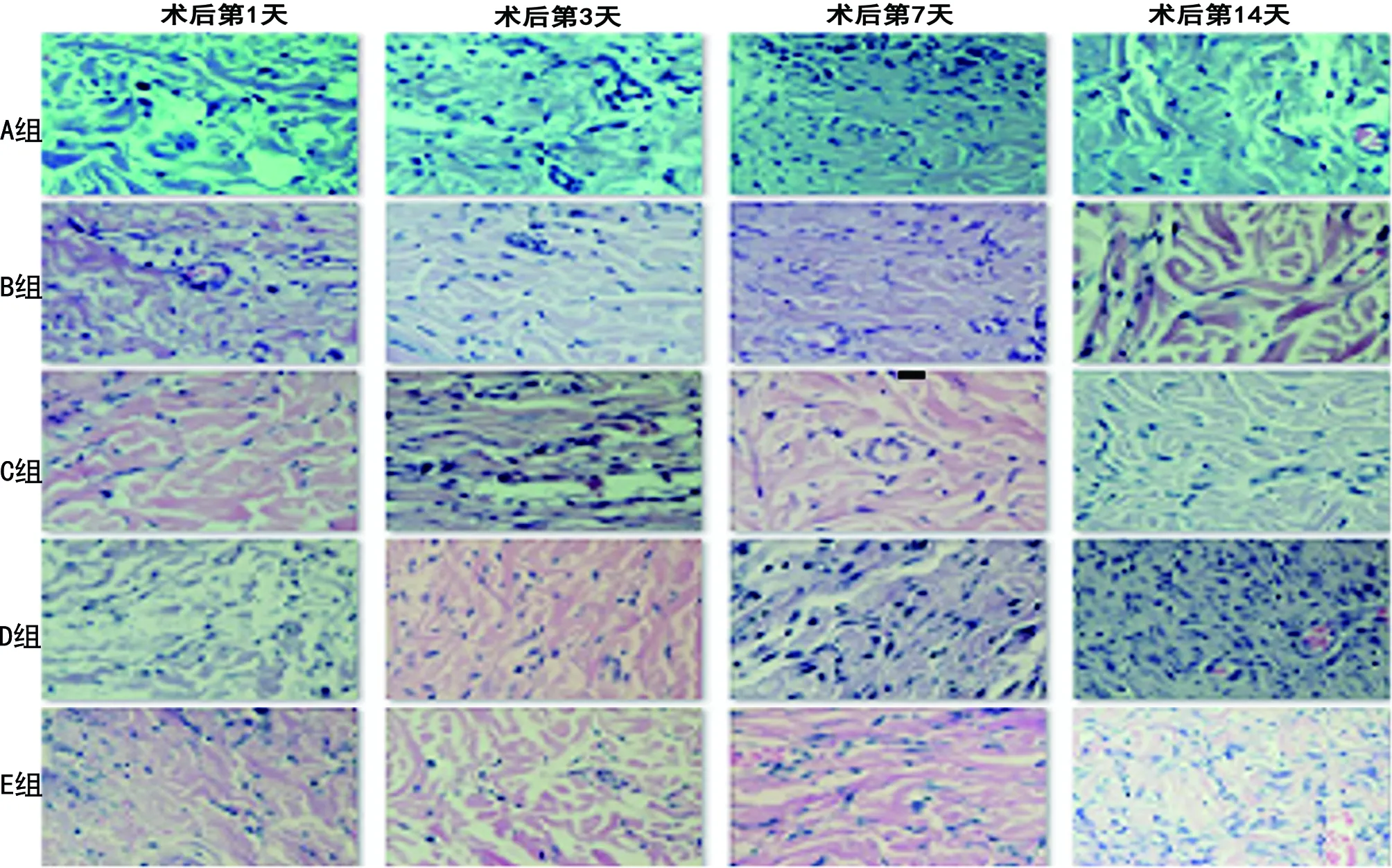
图2 不同时间段内各组SD大鼠切口皮肤局部组织HE染色情况(×200,比例尺10 μm)
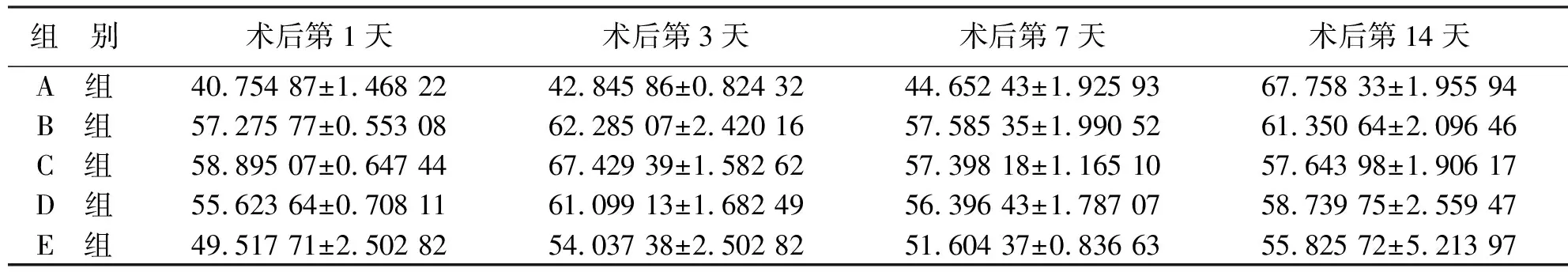
组 别术后第1天术后第3天术后第7天术后第14天A 组40.754 87±1.468 2242.845 86±0.824 3244.652 43±1.925 9367.758 33±1.955 94B 组57.275 77±0.553 0862.285 07±2.420 1657.585 35±1.990 5261.350 64±2.096 46C 组58.895 07±0.647 4467.429 39±1.582 6257.398 18±1.165 1057.643 98±1.906 17D 组55.623 64±0.708 1161.099 13±1.682 4956.396 43±1.787 0758.739 75±2.559 47E 组49.517 71±2.502 8254.037 38±2.502 8251.604 37±0.836 6355.825 72±5.213 97
表2 不同时间内各组大鼠血清中IL-6水平比较

表3 各组SD大鼠在伤口愈合不同阶段切口局部巨噬细胞浸润数量的比较
3 讨 论
正常伤口愈合过程中需要适度的炎症反应来促进胶原蛋白以及肉芽组织的生成,但是DM伤口易出现愈合困难的现象,这可能是因高血糖反应引起的的炎症反应紊乱所致。伤口愈合过程中局部浸润的巨噬细胞会释放许多的促炎细胞因子(TNF-α、IL-6等),启动伤口修复的进程。巨噬细胞作为清道夫可吞噬、清除细菌和坏死组织,避免感染的发生[10]。但DM会发生持续性炎症反应,导致促炎因子的过度释放,抑制伤口愈合。有研究报道称,DM可以引起TNF-α以及IL-6的分泌增多,从而抑制胶原沉积并诱导成纤维细胞的凋亡,不利于伤口的愈合[8],而系统的降低血糖或TNF-α可显著促进伤口的愈合[11-12]。
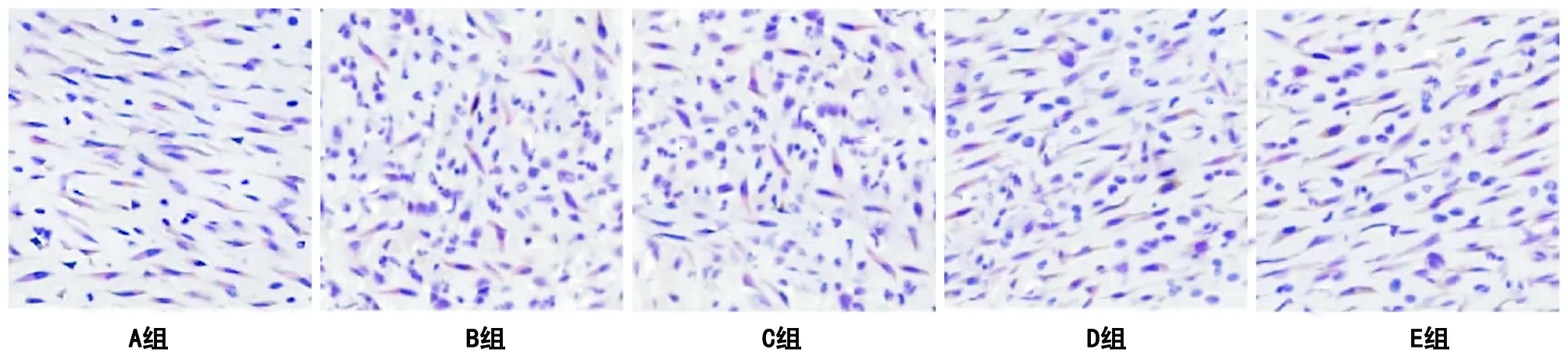
图3 各组SD大鼠在术后第7天时的切口局部成纤维细胞表现(×400,比例尺20 μm)
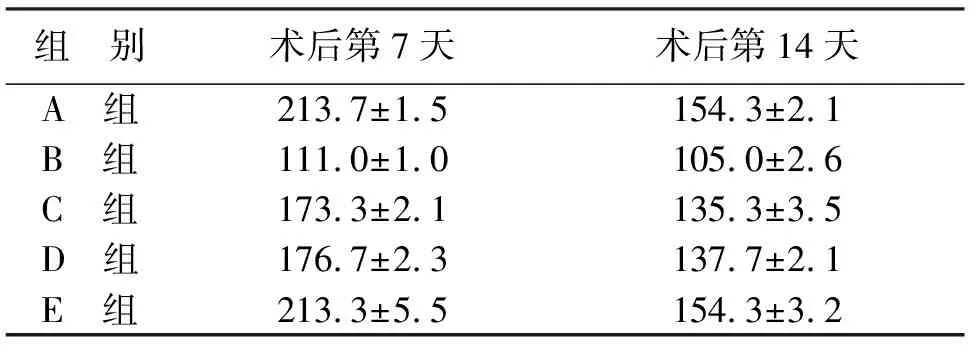
组 别术后第7天术后第14天A 组213.7±1.5154.3±2.1B 组111.0±1.0105.0±2.6C 组173.3±2.1135.3±3.5D 组176.7±2.3137.7±2.1E 组213.3±5.5154.3±3.2
本研究通过与对照组相比较后发现,实验组中DM大鼠的伤口愈合均出现了延迟,且伤口愈合程度与术前血糖控制时间的长短相关。术前血糖控制时间越长,伤口越易愈合。研究还发现实验组在伤口造模后的前期(第1~3天)较对照组局部巨噬细胞浸润较少,但血清中TNF-α、IL-6的含量很高,表现为高炎症状态。在伤口愈合的中、后期,正常组炎症因子开始升高,但此时实验组均出现下降趋势,此种炎症反应的紊乱抑制了各阶段的伤口愈合过程。实验组内相比较发现,术前控制血糖时间越长,伤口愈合的前期巨噬细胞和成纤维细胞浸润发生时间和数量越趋近正常组,越有助于伤口的愈合。而且术前血糖控制时间最长的大鼠,血清中TNF-α、IL-6的含量明显偏低,这可能降低了中期成纤维细胞凋亡的发生,最终促进伤口的愈合。这说明术前控制血糖时间与伤口愈合呈正相关,此外这这或许还可以说明临床中为什么DM患者围术期内经合理的控制血糖后仍有部分患者会出现伤口不愈合或愈合困难的现象,但其具体机制仍待进一步的实验研究去证实。

