HBV DNA高敏检测试剂盒的性能验证和临床应用评价
余学高 邓间开 何小洪 陈培松 崔丹荔 黄彬★
乙型肝炎病毒(hepatitis B virus,HBV)感染是严重的公共卫生问题。全球约有20亿人曾感染过HBV,其中超过10%为慢性HBV感染者[1]。每年约有80万人死于HBV感染所致的相关疾病[2]。HBV DNA定量检测在早期诊断HBV感染、判断疾病活动性、制定抗病毒治疗方案、治疗监测以及判断治疗终点中均起到重要作用[3]。
近年来亚太肝病研究学会、欧洲肝病研究学会和我国发布的慢性乙型肝炎防治指南均推荐用高敏检测方法检测HBV DNA载量,前两者发布的指南明确要求检测方法的灵敏度应达到10~15 IU/mL[4-5]。而目前国内各单位常用的HBV DNA定量检测方法的灵敏度在100~1 000 IU/mL之间,不能很好地满足临床对慢性乙肝患者管理的要求。因此,应采用高灵敏度的HBV DNA试剂对患者血清/血浆中的HBV DNA进行检测,以满足临床对慢性乙肝治疗监测和判断治疗终点等的需要。Pre-NAT全自动核酸检测系统采用磁珠法进行HBV核酸提取、纯化,采用转移磁珠、防倒吸、尿嘧啶N糖基化酶-脱氧尿嘧啶核苷三磷酸(uracil N glycosylase-deoxyuridine nucleoside triphosphate,UNG-dUTP)等有效防污染措施,结合HBV DNA高敏定量检测试剂对血清/血浆中的HBV DNA进行定量检测。本研究对基于Pre-NAT系统的HBV DNA高敏定量检测试剂盒进行方法学性能验证与临床检测性能评价。
1 材料与方法
1.1 标准品
定值高浓度HBV假病毒颗粒(7.5×1010IU/mL)由美国Perkin Elmer医学诊断事业部上海浩源公司提供。
1.2 临床样本
收集2018年5月至7月间在中山大学附属第一医院检测的HBV DNA高值样本和阴性样本,用于制备高/中/低值混合血清。收集慢性乙型肝炎患者血清64份,涵盖不同的病毒载量范围。
1.3 仪器与试剂
Pre-NAT全自动核酸提取仪由美国Perkin Elmer公司提供,COBAS AmpliPrep/COBAS TaqMan 48病毒载量系统购自瑞士罗氏公司,ABI ViiA7型荧光定量PCR仪购自美国Life Technologies公司,低温高速离心机购自德国Eppendorf公司;HBV DNA高敏检测试剂盒由美国Perkin Elmer医学诊断事业部上海浩源公司提供,其说明书声明的灵敏度为 20 IU/mL,线性范围为 20~(1.0×109)IU/mL;COBAS AmpliPrep/COBAS TaqMan HBV核酸检测试剂盒购自瑞士罗氏公司,其说明书声明的灵敏度为 20 IU/mL,线性范围为 20~(1.7×108)IU/mL。
1.4 方法
1.4.1 精密度评价
参考 EP15-A2[6]文件。每天重复检测高(108IU/mL)、中(105IU/mL)、低(103IU/mL)3个水平的混合血清各5次、连续测5天,由公式①计算批内不精密度(within-run imprecision,sr),由公式②计算室内不精密度(within-laboratory imprecision,s1),并分别与由公式③、公式④计算得出的厂家声明的批内标准偏差(performance claim repeatability standard deviation,σr)和厂家声明的室内标准偏差(manufactur's claim of laboratory required standard deviation,σl)进行比较,若小于厂家提供的标准偏差,结果可以接受。若大于厂家提供的标准偏差,则进行统计学分析。Sr:批内不精密度;sl:室内不精密度;D:实验天数;n:实验次数;Sb:批间不精密度;x:总均值;σr:厂家声明的批内标准偏差;σl:厂家声明的室内标准偏差;CVr:厂家声明的批内变异系数;CVl:厂家声明的室内变异系数。1.4.2 正确度评价
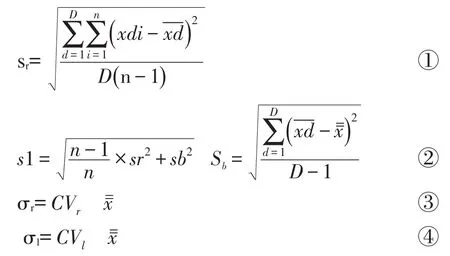
参考EP15-A2[6]文件。收集乙型肝炎患者血清20份,每天分别用高敏检测试剂和COBAS AmpliPrep/COBAS TaqMan系统检测,每天检测5个样本,连续测4天,由公式⑤计算偏倚标准差(standard deviation of bias,Sb),并与厂家声明的偏倚进行比较。Sb:偏倚标准差;bi=试验方法结果i-比较方法结果i;:平均偏倚;n:实验次数。

1.4.3 分析测量范围(analytical measurement range,AMR)评价
参考EP6-A[7]。将定值高浓度标准品(7.5×1010IU/mL)用HBV阴性血清作系列稀释,稀释后HBV DNA 浓度分别为 109、108、107、106、105、104、103、102、50、25、20、10、5、2.5 IU/mL,与阴性质控品一同重复检测3次。采用平均斜率法进行线性评价。
1.4.4 临床可报告范围(clinical reportable range,CRR)评价
参考EP6-A[7]。选择浓度在厂家说明书声明的分析测量范围内的高值标本5份,用阴性血清分别进行 1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640稀释并检测,根据预期值和实测值计算稀释回收率,回收率在90%~110%为合格,确定最大稀释度。将定值高浓度标准品(7.5×1010IU/mL)系列稀释为100、50、25、20、10、5 IU/mL并进行检测,连续检测6天,每天检测1次,计算重复检测变异系数(coefficient of variation,CV),得出功能灵敏度(即天间重复测量时变异系数为20%的检测限)。结合功能灵敏度、分析测量范围及最大稀释度确定临床可报告范围。
1.4.5 最低检测限评价
参考 EP17-A[8]。将定值高浓度标准品(7.5×1010IU/mL)用HBV阴性血清系列稀释为100、50、25、20、10、5、2.5 IU/mL 并进行检测,重复检测6次,计算HBV DNA检出率及与理论值的偏倚。
1.4.6 仪器间比对及相关性评价
参考EP9-A2[9]。选取临床慢性乙肝患者血清样本44份,样本浓度尽量覆盖试剂盒的线性检测范围,分别用高敏试剂和COBAS AmpliPrep/COBAS TaqMan系统检测,分析2种方法的相关性。
1.5 统计学分析
采用Microsoft Excel 2010和MedCalc等软件进行统计学分析。计算计量资料的均数、方差、标准差和CV,线性范围采用平均斜率法,2种定量检测结果比对采用Deming回归分析相关性。P<0.05为差异有统计学意义。
2 结果
2.1 精密度评价
批内精密度:高、中、低值标本的批内不精密度 sr分别为 0.069、0.085、0.059,均分别小于厂家声明的标准差 σ(0.799、0.592、0.398)。室内精密度:高、中、低值标本的室内不精密度sl分别为0.083、0.138、0.117,均分别小于厂家声明的标准差σ(0.799、0.592、0.398)。
2.2 正确度评价
采用高敏试剂和COBAS AmpliPrep/COBAS TaqMan检测系统同时检测20例患者标本,所得结果作偏倚图(见图1),可知2种检测方法的结果一致,偏倚标准差(standard deviation of bias,Sb)为 0.25 lg值,小于厂家声明的偏倚0.45 lg值。
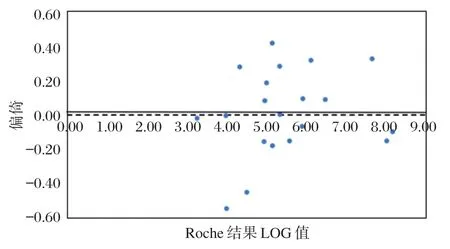
图1 高敏试剂和COBAS AmpliPrep/COBAS TaqMan检测系统检测结果的偏倚图Figure 1 Bias diagram of the results of high sensitivity test kit and COBAS AmpliPrep/COBAS TaqMan Detection system
2.3 分析测量范围评价
对各梯度浓度测量结果做平均斜率法以验证分析测量范围。计算各组测量结果的变异系数CV,与厂家声明的精密度(10%)比较。以预期浓度lg值为X,测量浓度均值lg值为Y,做散点图(图2),为直线关系,然后作直线回归。回归方程为y=1.027 7x-0.082,斜率b1=1.027 7,在0.97~1.03 之间,截距b0=0.082,r2=0.999 6。该方法在实验所涉及的浓度范围内25~(1.0×109)IU/mL成线性。
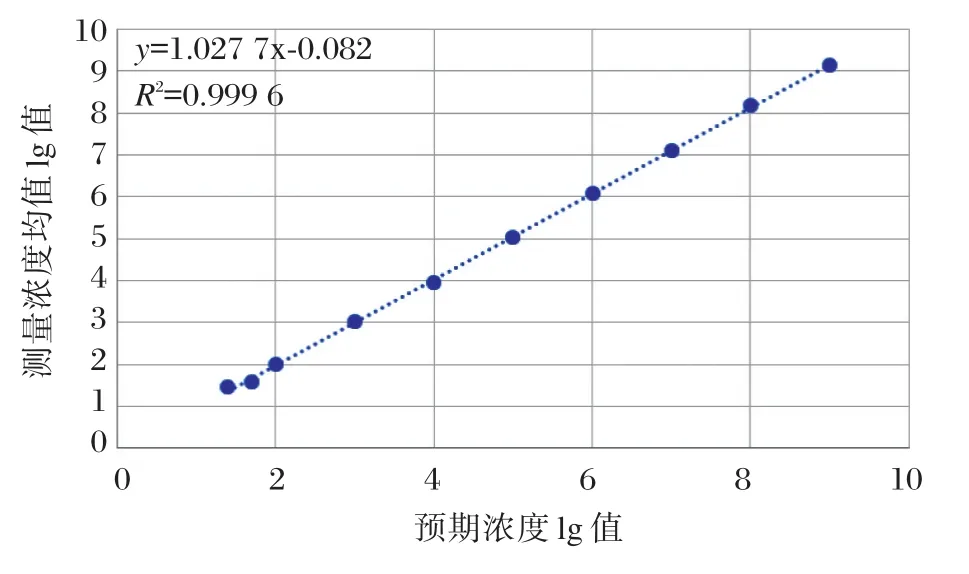
图2 HBV DNA定量预期值和测量均值散点图Figure 2 HBV DNA quantitative expected value and measured mean scattered plot
2.4 临床可报告范围评价
2.4.1 回收率及最大稀释度
对3个标本的原血清和各稀释度血清进行检测后,计算稀释回收率:稀释回收率=(实测值/预期值)×100%,回收率在90%~110%为合格,得出最大稀释度为1∶80。
2.4.2 功能灵敏度
对各浓度的样本重复检测6次,计算CV,10 IU/mL浓度组的CV为18.10%,小于20%,符合厂家声明的功能灵敏度(20 IU/mL)。
2.4.3 临床可报告范围
临床可报告范围上限为分析测量范围上限乘以最大稀释度,结合上述实验得到的功能灵敏度10 IU/mL,高敏试剂的临床可报告范围为10~(8.0×1010)IU/mL。
2.5 最低检测限评价
高敏试剂对 100、50、25、20、10、5 IU/mL 6个浓度水平样本的检出率均为100%,2.5 IU/mL浓度水平检出率为66.67%,最低检测限为5 IU/mL,符合厂家声明的检测下限(20 IU/mL)。
2.6 仪器间比对及相关性评价
将44份慢性乙肝患者血清样本同时用高敏试剂和COBAS AmpliPrep/COBAS TaqMan系统检测,对测定结果做Deming回归分析,回归方程为y=0.987 6x+0.189 4,相关系数r=0.975 4(P<0.05),可知高敏试剂和 COBAS AmpliPrep/COBAS TaqMan检测系统的相关性好,结果见图3。
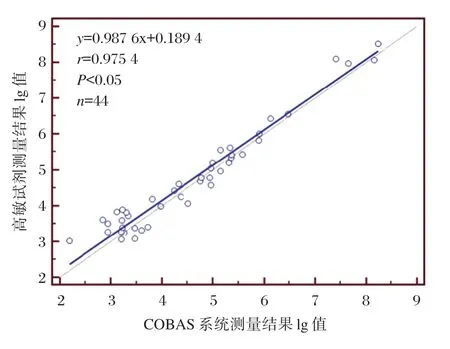
图3 Deming线性回归图Figure 3 Deming linear regression diagram
3 讨论
HBV感染的病原学诊断方法目前主要有免疫学方法检测HBV的血清学标志物和分子生物学方法检测HBV核酸[10-11]。免疫学方法检测病毒抗原或抗体仅提供HBV感染的间接证据,其出现晚于HBV DNA的出现,且在病毒感染的窗口期不能检测到抗体,这在很大程度上限制了免疫学方法的应用[12]。采用分子生物学方法检测HBV DNA,可为早期诊断HBV感染、判断病毒复制程度、进行HBV基因分型及耐药性检测等提供更多的信息[13-16]。荧光定量PCR法定量检测HBV DNA,能准确地反映HBV DNA的复制水平,在治疗监测、判断治疗终点等中有重要的应用价值[17-18]。最新国际和国内的乙型肝炎防治指南推荐使用高敏检测方法检测HBV DNA,以帮助判断治疗终点。如亚太肝病研究学会建议,对于应用核苷酸类药物治疗的HBeAg阳性者,当HBeAg发生血清学转换,且HBV DNA至少12个月低于检测水平(10~15 IU/mL)时,可考虑停药[4-5]。我国药物监督管理局在2013年《乙型肝炎病毒DNA定量检测试剂注册申报资料技术指导原则》中将HBV DNA的最低检测限定为不大于30 IU/mL[19]。高敏HBV DNA定量检测在临床中的作用越来越重要,未来将逐步取代传统低敏试剂检测[20]。
区别于传统的手工提取核酸方法,Pre-NAT全自动核酸提取系统可自动进行核酸提取、扩增前PCR反应体系构建等全过程,所需的人工操作仅为样本与试剂的准备和摆放。Pre-NAT系统分为4大模块,包括样本加载、试剂分装、核酸提取和PCR体系构建等模块。其采用独家专利的聚乙烯醇磁珠,在低盐环境下展现出对DNA的独特吸附能力,对蛋白的结合非常弱,并且转移磁珠的方法减少了液体或气溶胶暴露而产生的污染,保证了核酸提取的得率、纯度、安全性和稳定性。另外,Pre-NAT系统还具有样本通量大(96),满通量处理时间较短(140 min)、样本用量少和紫外灯防污染等特点,能够很好地提高实验效率和质量,节约劳动力,减少手工操作带来的污染和误差。
本研究主要参考CLSI的EP6-A、EP9-A2、EP15-A2和EP17-A等文件[6-9],对基于Pre-NAT全自动核酸提取系统的HBV DNA高敏定量检测试剂盒进行性能验证。本研究得到的数据显示:高、中、低值标本的批内不精密度sr和室内不精密度sl均分别小于厂家声明的标准差σ,表明精密度通过验证,可以在临床应用。实验室对正确度的评价过程实际上就是偏倚计算的过程,根据检测数据计算得出的偏倚小于厂家声明的偏倚,表明该实验方法得到的偏倚满足要求,正确度通过验证。本研究采用平均斜率法回归分析进行分析测量范围(AMR)的评价,根据统计结果得知预期值与测量值之间相关性较好,且在25~1.0×109IU/mL内成线性,与厂家声明的线性范围20~(1.0×109)IU/mL相较,AMR下限不符合厂家声明,考虑可能是由高值标准品稀释到相应低浓度水平引起的误差,需要后续补充试验进一步验证。高敏试剂盒检测低限为25 IU/mL,与罗氏COBAS系统检测灵敏度(20 IU/mL)几乎相当,比目前国内常用HBV定量试剂盒更灵敏,达到2013年国家食品药品监督管理总局技术评审中心提出的HBV DNA最低检测限应小于30 IU/mL的要求[19]。本研究主要设计了两方面实验以验证Pre-NAT系统的临床可报告范围(CRR),包括最大稀释度的确定和功能灵敏度的验证。最大稀释度的确定主要通过计算回收率,依据结果可知1∶160稀释度组的回收率已超过合格范围,因此选择1∶80作为最大稀释度,其乘以AMR上限即为CRR上限。因此本实验得到的功能灵敏度为10 IU/mL,低于厂家声明的功能灵敏度20 IU/mL。由最低检测限实验结果可见,5 IU/mL浓度水平及以上的检出率均为100%,符合厂家声明的检测下限(20 IU/mL)。方法学比对中选择COBAS AmpliPrep/COBAS TaqMan 48病毒载量系统作为比较方法,选用Deming线性回归分析法,使用统计软件得出回归方程为y=0.987 6x+0.189 4,r=0.975 4,(P<0.05),可知两者相关性较好,说明2种方法的结果具有可比性。另外,本研究未涉及Pre-NAT系统及该试剂盒抗干扰能力的评价,期待后续实验补充完善。
综上所述,对基于Pre-NAT全自动核酸提取系统的HBV DNA高敏定量检测试剂盒的精密度、正确度、分析测量范围、临床可报告范围、最低检测限及方法学比对等性能进行验证,均表现良好,与厂家声明基本一致,达到了应用于临床的要求,也为分子生物学检验实现自动化作出了贡献。

