左卡尼汀联合血液透析对尿毒症患者Treg/Th17细胞、血清炎症因子和肾功能指标的影响
鲁冰 任东升 栗明
尿毒症在肾内科常见,是肾脏疾病发展至晚期的终末阶段,发病率、致死率高。目前医疗水平尚无法经药物治愈尿毒症,多采用血液透析或肾脏移植,以减轻患者肾脏代谢负担,维持患者生命[1-2]。但血液透析为侵入性操作,且多数患者由于摄食不足,内源性左卡尼汀合成较少,导致血液透析过程中易出现营养不良、心功能受损等并发症,进而影响患者免疫功能,加剧机体炎症反应及肾功能损伤,增加疾病死亡率[3]。补充外源性左卡尼汀可辅助改善尿毒症血液透析患者代谢异常及炎症状态[4]。本研究旨在探究左卡尼汀联合血液透析对尿毒症患者调节性T细胞(Regulatory T cell,Treg)/辅助性T细胞17(T helper T cell 17,Th17)、血清炎症因子及肾功能指标的影响,以期为尿毒症患者的临床治疗提供参考,报道如下。
1 资料与方法
1.1 一般资料
筛选2016年6月至2018年7月河南省南阳市中心医院收治的80例尿毒症患者。纳入标准:①确诊为尿毒症;②病情稳定,行血液透析治疗时间≥3个月;③患者及其家属知情同意。排除标准:①心脑血管疾病;②药物引起的肾脏损害;③合并感染、恶性肿瘤及精神障碍;④重度营养不良。根据随机数表法分为观察组和对照组,各40例。观察组男27例,女13例;年龄27~68岁,平均(48.73±6.21)岁;原发病:肾小球肾炎 19例,糖尿病肾病9例,高血压肾病5例,多囊肾病4例,其他3例。对照组男30例,女10例;年龄29~70岁,平均(50.04±8.02)岁;原发病:慢性肾小球肾炎18例,糖尿病肾病11例,高血压肾病4例,多囊肾病5例,其他2例。2组性别、年龄及原发病比较无显著差异(P>0.05),具有可比性。
1.2 治疗方法
1.2.1 血液透析
对照组给予普通血液透析治疗,采用德国费森4008S型血液透析机,一次性聚砜膜透析器(德朗B-16P),标准碳酸氢盐透析液,血流量200~300 mL/min,透析液流量500 mL/min,常规肝素抗凝,透析时间4 h/次,3次/周,治疗期间常规给予静脉补充铁剂、口服叶酸、维生素等。
1.2.2 左卡尼汀治疗
观察组除给予普通血液透析治疗外,于每次透析结束前联合左卡尼汀治疗,将2 g左卡尼汀注射液(常州兰陵制药有限公司,国药准字H20000543)加入到20 mL 0.9%氯化钠溶液中稀释,静脉缓慢注射2~3 min。治疗疗程3个月。
1.3 观察指标
1.3.1 主要仪器与试剂
EPICS XL2流式细胞仪购自美国贝克曼库尔特有限公司,7600-020全自动生化分析仪购自日本株式会社日立制作所,VIDAS荧光免疫分析仪购自法国生物梅里埃股份有限公司,BC-5390全自动血细胞分析仪购自深圳迈瑞生物医疗电子股份有限公司,检测试剂盒均购自南京建成生物工程研究所。
1.3.2 Treg/Th17细胞水平检测
于治疗前和治疗3个月后各采集2组晨间空腹肝素抗凝外周静脉血3 mL,采用Ficoll淋巴细胞分离液梯度离心分离外周血单核细胞(peripheral blood mononuclear cells,PBMCs),以 1640 培养液混悬制调整至浓度为3×106个/mL,采用流式细胞仪检测Treg和Th17细胞比例。将PBMCs细胞混悬液滴加至24孔板,每孔加50 mg/mL PMA、1 μmol/L离子霉素和500 ng/mL模能霉素,37℃CO2培养箱培养4 h,离心(1 500 r/min,10 min),PBS冲洗,室温避光孵育20 min,采用PerCP标记抗CD4抗体,FITC标记抗CD25抗体,对细胞表面染色,固定透化后加入PE标记抗Foxp3抗体与FITC标记抗IL-17抗体,4℃避光孵育30 min,上机检测,分析结果。
1.3.3 实验室指标检测
于治疗前和治疗3个月后各采集2组晨间空腹肝素抗凝外周静脉血3 mL,检测以下指标。①营养指标:使用全自动血细胞分析仪检测血红蛋白(hemoglobin,Hb)、血浆总蛋白(total plasma protein,TP)、白蛋白(albumin,Alb)、前白蛋白(prealbumin,PA)水平。②炎症因子:使用酶联免疫吸附法检测血清白细胞介素-6(interleukin-6,IL-6)、白细胞介素-17(Interleukin-17,IL-17)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CPR)水平。③肾功能指标:检测血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)。同时收集24 h尿液,检测24 h尿蛋白定量。
1.3.4 并发症统计
统计2组并发症发生情况,包括低血压、心脏病变、肌肉痉挛及乏力。
1.4 统计学分析
应用SPSS 20.0软件处理数据,计数资料以n(%)表示,行χ2检验;Treg/Th17细胞水平、营养指标、炎症因子及肾功能指标均以表示,行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Treg/Th17细胞水平比较
治疗前2组Treg/Th17细胞水平比较无显著差异(P>0.05);治疗后观察组Treg细胞、Th17细胞、Treg/Th17细胞水平均显著低于对照组,差异有统计学意义(P<0.05),见表1。
表1 2组治疗前后Treg/Th17细胞水平比较(±s)Table 1 Comparison of Treg/Th17 cell levels between the 2 groups before and after treatment(±s)

表1 2组治疗前后Treg/Th17细胞水平比较(±s)Table 1 Comparison of Treg/Th17 cell levels between the 2 groups before and after treatment(±s)
与治疗前比较,*P<0.05;与观察组比较,△P<0.05。
组别观察组(n=40)对照组(n=40)时间治疗前治疗后治疗前治疗后Treg细胞(%)7.25±1.84 2.18±1.50*7.33±2.05 4.26±2.78*△Th17细胞(%)36.22±8.46 13.38±6.44*36.10±8.20 23.15±7.05*△Treg/Th17细胞0.20±0.08 0.16±0.04*0.21±0.07 0.18±0.05*△
2.2 营养指标比较
治疗前2组营养指标比较无显著差异(P>0.05);治疗后观察组PA、Hb、TP、Alb营养指标改善情况均显著优于对照组,差异有统计学意义(P<0.05),见表2。
表2 2组治疗前后营养指标比较(±s,g/L)Table 2 Comparison of nutritional indicators between the 2 groups before and after treatment(±s,g/L)
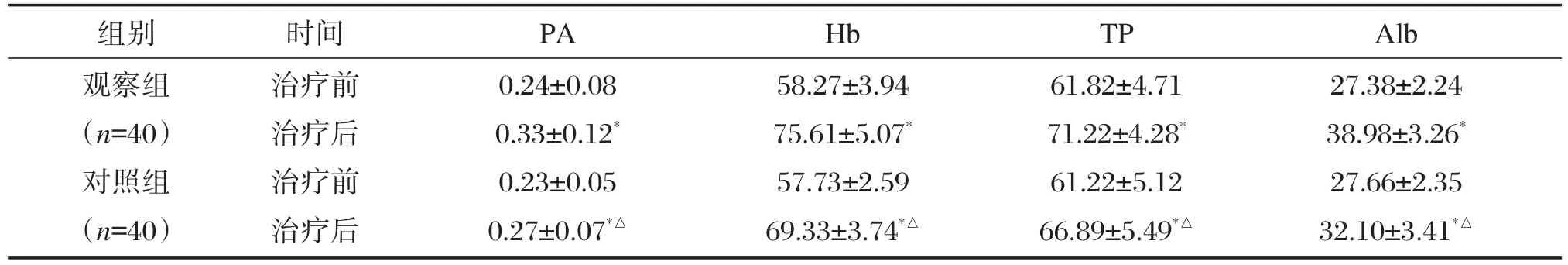
表2 2组治疗前后营养指标比较(±s,g/L)Table 2 Comparison of nutritional indicators between the 2 groups before and after treatment(±s,g/L)
与治疗前比较,*P<0.05;与观察组比较,△P<0.05。
组别观察组(n=40)对照组(n=40)时间治疗前治疗后治疗前治疗后PA 0.24±0.08 0.33±0.12*0.23±0.05 0.27±0.07*△Hb 58.27±3.94 75.61±5.07*57.73±2.59 69.33±3.74*△TP 61.82±4.71 71.22±4.28*61.22±5.12 66.89±5.49*△Alb 27.38±2.24 38.98±3.26*27.66±2.35 32.10±3.41*△
2.3 血清炎症因子比较
治疗前2组炎症因子比较无显著差异(P>0.05);治疗后观察组 IL-6、IL-17、TNF-α、hs-CPR水平均显著低于对照组,差异有统计学意义(P<0.05),见表3。
表3 2组治疗前后血清炎症因子比较(±s)Table 3 Comparison of serum inflammatory factors between the 2 groups before and after treatment(±s)
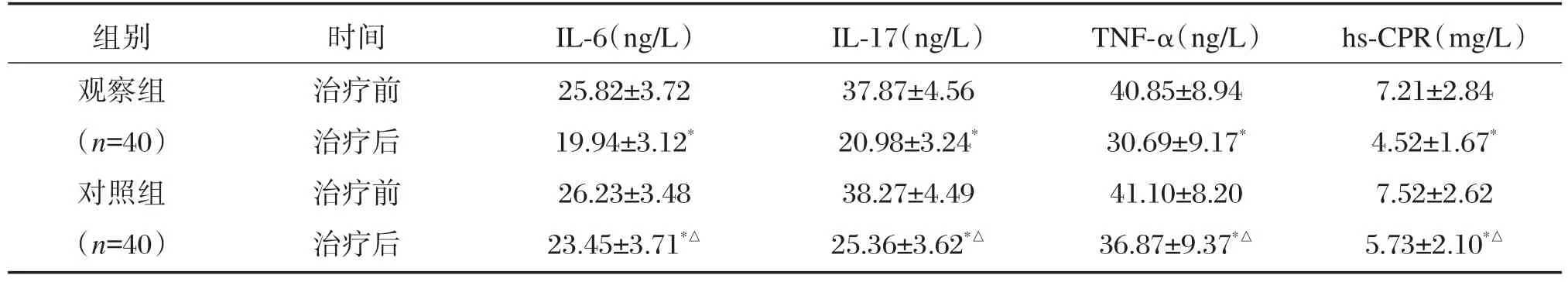
表3 2组治疗前后血清炎症因子比较(±s)Table 3 Comparison of serum inflammatory factors between the 2 groups before and after treatment(±s)
与治疗前比较,*P<0.05;与观察组比较,△P<0.05。
组别观察组(n=40)对照组(n=40)时间治疗前治疗后治疗前治疗后IL-6(ng/L)25.82±3.72 19.94±3.12*26.23±3.48 23.45±3.71*△IL-17(ng/L)37.87±4.56 20.98±3.24*38.27±4.49 25.36±3.62*△TNF-α(ng/L)40.85±8.94 30.69±9.17*41.10±8.20 36.87±9.37*△hs-CPR(mg/L)7.21±2.84 4.52±1.67*7.52±2.62 5.73±2.10*△
2.4 肾功能指标比较
治疗前2组肾功能指标比较无显著差异(P>0.05);治疗后观察组 SCr、BUN、24 h尿蛋白定量水平显著低于对照组,差异有统计学意义(P<0.05),见表4。
表4 2组治疗前后肾功能指标比较(±s)Table 4 Comparison of renal function indicators between the 2 groups before and after treatment(± s)
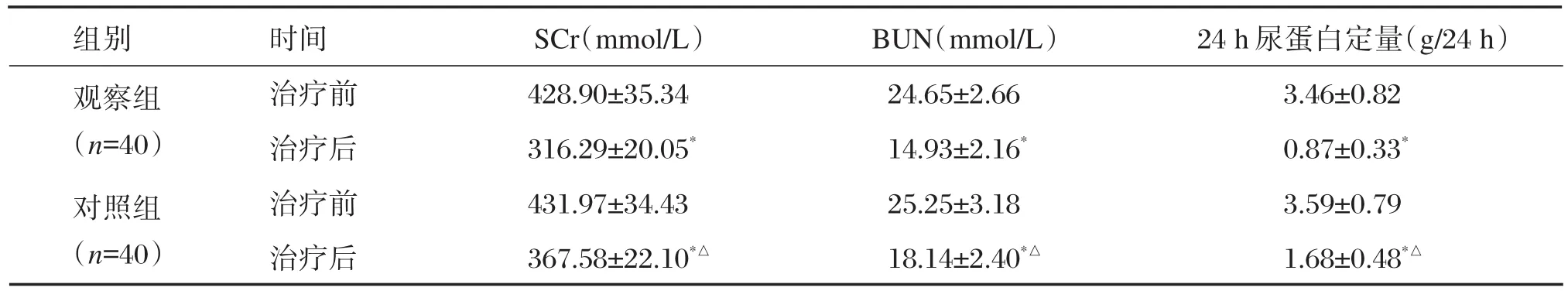
表4 2组治疗前后肾功能指标比较(±s)Table 4 Comparison of renal function indicators between the 2 groups before and after treatment(± s)
与治疗前比较,*P<0.05;与观察组比较,△P<0.05。
组别观察组(n=40)对照组(n=40)时间治疗前治疗后治疗前治疗后SCr(mmol/L)428.90±35.34 316.29±20.05*431.97±34.43 367.58±22.10*△BUN(mmol/L)24.65±2.66 14.93±2.16*25.25±3.18 18.14±2.40*△24 h尿蛋白定量(g/24 h)3.46±0.82 0.87±0.33*3.59±0.79 1.68±0.48*△
2.5 并发症比较
2组并发症主要表现为低血压、心脏病变、肌肉痉挛及乏力等,观察组并发症发生率为12.50%显著低于对照组的32.50%,差异有统计学意义(P<0.05),见表5。
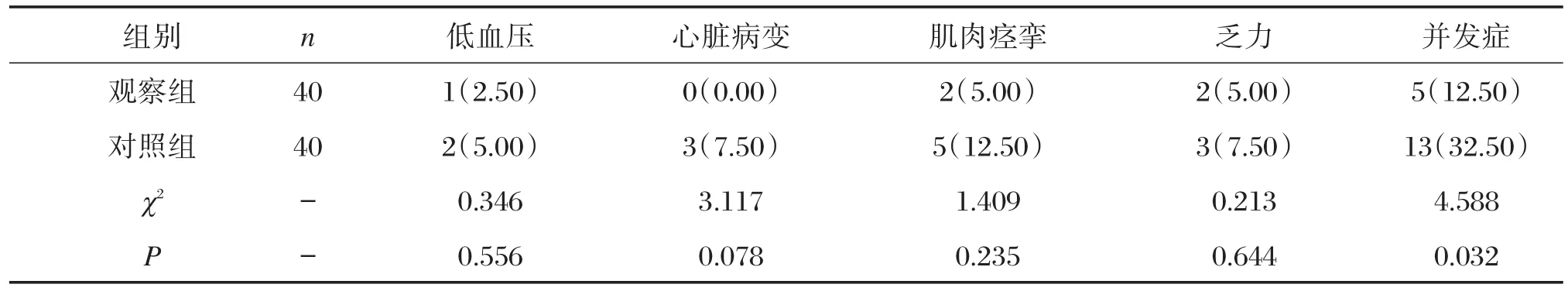
表5 2组并发症比较[n(%)]Table 5 Comparison of complications between the 2 groups[n(%)]
3 讨论
肾脏是人体的主要排泄器官,通过清除体内代谢废物及毒素,排出身体内的废物和多余水分。而尿毒症患者肾结构损害和纤维化,肾功能进行性下降导致其肾脏功能几乎完全丧失,毒素在身体内大量蓄积,严重危害身体健康[5]。血液透析是治疗尿毒症的常用方法,可滤除体循环内的大、中分子毒性物质,起到一定程度的肾脏替代作用,延长患者生存时间[6]。临床应用中发现尿毒症患者肾功能损伤呈慢性、进行性、不可逆性加重,可导致多器官、多系统病理损伤,而长期血液透析治疗患者免疫功能低下,可诱发并加重炎症反应[7-8]。王明波等[9]学者认为该病理过程可能与获得性免疫及自主免疫调节机制减弱相关,但其具体发病机制目前尚未完全明确。
单核细胞是重要的免疫性活性细胞,其分离出的Treg和Th17细胞与机体免疫功能密切相关[10]。Th17细胞可通过促进中性粒细胞募集、活化,促进IL-6、IL-17、TNF-α细胞因子大量释放,介导促进炎症反应。研究发现,IL-6、IL-17、TNF-α细胞因子在自主免疫性疾病及炎症反应中高表达[11]。Berthelot[12]研究发现血液透析尿毒症患者外周血IL-6、IL-17、TNF-α细胞因子水平表达亦明显高于健康正常人。Treg细胞是重要的免疫调节细胞,可抑制效应性CD4+T细胞增生、活化,诱导免疫耐受。Treg/Th17维持平衡状态有利于维持机体免疫稳态,起到维持体内内环境稳定的作用[13]。若Treg/Th17失衡可诱导疾病发生甚至恶化。
左卡尼汀主要存在于原核及真核细胞中,源于食物摄入、肾小管重吸收、肉碱合成、组织内外转运等因素合成,可通过运载长链脂肪酸进入线粒体,为β氧化代谢提供能量,同时还可清除线粒体中毒性产物,具有多种生理功能[14]。左卡尼汀缺乏可导致体内脂肪酸堆积、产能缺乏,进而导致营养不良相关并发症[15]。血液透析尿毒症患者由于进食差,导致摄入量减少,左卡尼汀合成不足;再加上肾功能严重损伤,导致肾小球对滤过肉碱重吸收作用减弱,排泄增加;另外,左卡尼汀相对分子质量较小(162),水溶性好,导致其透析过程丢失较多。以上多因素作用导致血液透析尿毒症患者体内左卡尼汀严重缺乏。因此,有学者认为在常规血液透析治疗基础上,通过补充外源性左卡尼汀或可起到改善患者肾功能,提高其免疫功能的作用[16]。本研究结果中观察组治疗后PA、Hb、TP、Alb营养指标改善情况显著优于对照组,Treg、Th17、Treg/Th17细胞、IL-6、IL-17、TNF-α、hs-CPR及SCr、BUN、24 h尿蛋白定量水平均显著低于对照组,提示外源性补充左卡尼汀可显著改善血液透析尿毒症患者机体微环境及免疫功能,维持较好的营养状态,减轻炎症反应及肾功能损伤,与路静芬等[17]、Higuchi等[18]国内外相关研究基本一致。同时本研究还发现,观察组并发症发生率显著低于对照组,提示外源性补充左卡尼汀具较高安全性,笔者认为其原因或与患者营养状况及免疫功能得到有效改善相关。
综上所述,左卡尼汀联合血液透析可显著改善尿毒症患者Treg/Th17细胞功能,降低血清炎症因子水平,减轻肾功能损伤,其作用机理可能与纠正患者营养不良及细胞免疫紊乱有关。但本研究样本量较少,未展开长时间随访分析,可能导致研究结果偏差,仍需大量科学、严谨的临床实验进一步补充、论证及完善,为尿毒症患者的血液透析治疗提供更多依据,更好地改善患者生存质量,延长患者生存时间。

