泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布的研究
彭胡 唐克彬 颜彪 邱厚兵 朱彬
冠心病是常见的心血管疾病,当发生冠状动脉粥样硬化后就会使管腔出现狭窄、痉挛或阻塞,进而导致心肌缺血、缺氧或坏死,而出现心脏疾病[1]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗冠心病常见方法,具有一定的改善心肌的血流灌注效果。冠心病进行PCI治疗后患者的基因分布也是当前研究比较多的内容。通过CYP2C19代谢的药物主要有冠心病介入治疗药物中的氯吡咯雷有关。氯吡咯雷需要经过CYP2C19酶的代谢才会发挥作用,氯吡格雷抵抗主要与CYP2C19基因突变有关[2]。在我国汉族人群中,CYP2C19基因多态性的主要的突变位点为CYP2C19*2(T-C)和CYP2C19*3(T-C),而携带CYP2C19*2/CYP2C19*3基因的患者与氯吡格雷抵抗的发生呈正相关[3]。而且不同地区的冠心病PCI治疗患者CYP2C19基因多态性分布存在一定差异,关于泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布未见详细报道,是否与我国汉族人群的CYP2C19基因分布一致需要对此进行分析,因此本研究对此进行研究,旨在说明泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布。
1 资料与方法
1.1 一般资料
选取2018年1月至2018年11月泸州地区冠心病PCI治疗120例患者的CYP2C19基因多态性分布进行研究,作为试验组,纳入标准:①确诊为冠心病且接受PCI手术治疗;②年龄45~80岁;③CYP2C19基因资料齐全;④均为汉族无血缘关系。经过本医院伦理学并签订患者知情同意书。排除标准:①对阿司匹林和氯毗格雷有禁忌症的患者;②合并严重肝、肾等器官功能损害的患者;③凝血功能异常的患者;④既往有出血性疾病史的患者。选取本地区汉族健康人群108例,作为阴性对照组,2组研究对象在一般资料方面无统计学意义(P>0.05)。具体见表1。
1.2 试剂与仪器
全血基因组DNA提取试剂及CYP2C19基因检测试剂盒均由苏州旷远生物分子技术有限公司提供,DNA提取试剂包括缓冲液L1(提取核酸)、L2(提取核酸)、WA(提取核酸)、WB(纯化核酸)、TE(纯化核酸)、纯化柱(纯化核酸)、收集管(收集废液)。CYP2C19基因检测试剂盒包括质控品2G、2A、3G、3A、反应酶、特异性引物和探针、内参引物和探针。核酸扩增仪包括ABI7500和ABI stepone Plus。高速冷冻离心机(eppendorf 5424R)。金属浴,漩涡振荡器。
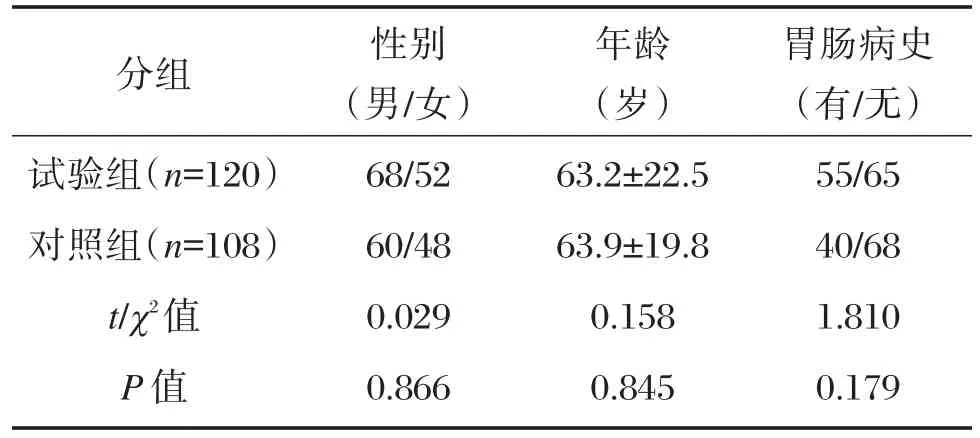
表1 2组对象的一般资料比较Table 1 comparison of general data for groups of objects
1.3 样本类型
采集受试者静脉全血2 mL,EDTA-K2抗凝。
1.4 方法
1.4.1 DNA提取
用移液器加300 μL缓冲液L1到1.5 mL离心管中然后加入混匀后的全血样本400 μL盖上管盖漩涡震荡30 s,加入L2缓冲液300 μL剧烈颠倒混匀5次再漩涡震荡30 s,13 000 rpm离心2 min,将全部上清液吸入至核酸纯化柱中,盖上管盖12 000 rpm离心30 s(2 mL离心管收集滤液),弃废液后在核酸纯化柱中加入500 μL缓冲液WA盖上管盖12 000 rpm离心30 s(2 mL离心管收集滤液),弃废液后在核酸纯化柱中加入600 μL缓冲液WB盖上管盖12 000 rpm离心30 s(2 mL离心管收集滤液),弃废液后13 000 rpm离心2 min,弃2 mL离心管,将核酸纯化柱置于洁净的1.5 mL离心管中,悬空向纯化柱膜中央加入60 μL 56℃预热的缓冲液TE,盖上管盖室温静置1 min。12 000 rpm离心30 s,将提取到的DNA-20℃保存6个月内备用。
1.4.2CYP2C19基因多态性位点基因型检测
基于NCBI数据库,针对CYP2C19基因得到相关基因位点外显子序列,并设计相关外显子的引物[4-5];各位点PCR引物序列如下:636T>C的上游引物为 5′-AGGTAACCAGTTCTCA-3′,下游引物为 5′-GAATTGGATGGGCA-3′,636 pb;681 C>A的上游引物为 5′-TAGGGTTAGTCCCA-3′,下游引物为 5′-TTCCGGTTAACCGA-3′,681 pb。然后用设计的引物序列对DNA进行PCR扩增。
1.4.3 PCR扩增
将试剂取出解冻后混匀并低速离心,在0.2 mL扩增管中分别加入23 μL 2G、2A、3G、3A 4种反应液,然后每管加入1 μL酶,1 μL提取的DNA模板,配成25 μL反应体系,瞬时离心后放入扩增仪扩增。扩增循环条件及荧光采集设置[6]:37℃ 2 min 去污染;95℃ 3 min 预变性;95℃ 30 s,56℃ 30 s,65℃ 45 s,10 个扩增循环;95℃ 30 s,56℃ 30 s※,65℃ 45 s,30个扩增循环,在本轮循环中56℃30 s※处设置FAM和ROX双通道采集荧光信号;25℃1 min,扩增结束。每次试验时,4种反应体系均做其对应质控品及空白对照检测快代谢型、中间代谢型和慢代谢型是根据细胞色素P450酶的代谢的程度而分型[7]。
1.5 统计学方法
采用SPSS 23.0统计软件对数据进行分析,CYP2C19基因分布频率采用例数+百分比(n%)表示,并进行卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组对象的CYP2C19基因分布情况
具体结果见表2,由表2可知试验组患者检测出CYP2C19的 6种基因型,*1/*1型(CC,CC),*1/*2型(CC,TC),*1/*3型(TC,CC),*2/*2型(CC,TT),*3/*3型(TT,CC),*2/*3型(TC,TC)明显高于对照组(P<0.05)。

表2 2组研究对象的CYP2C19基因分布情况[n(%)]Table 2 Distribution of CYP2C19 gene in the 2 group[n(%)]
2.2 2组对象的CYP2C19基因代谢型分布情况
具体结果见表3,由表3可知检测出CYP2C19的3种代谢型,快代谢型,中间代谢型,慢代谢型明显高于对照组(P<0.05)。
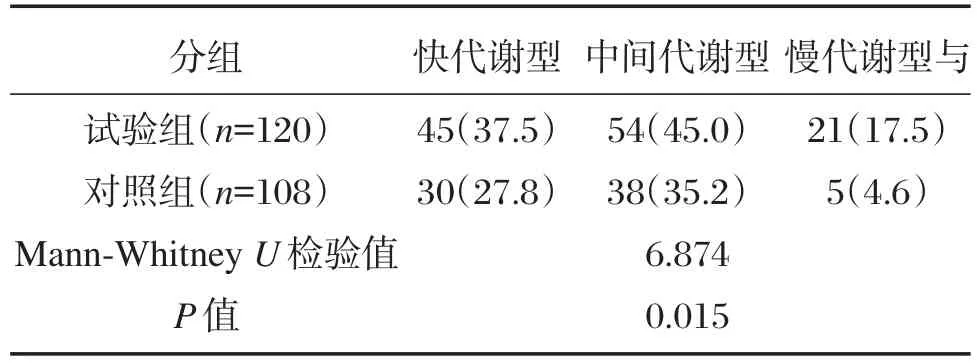
表3 2组研究对象的CYP2C19基因代谢型分布情况[n(%)]Table 3 Distribution of metabolic patterns of CYP2C19 gene in the 2 group[n(%)]
3 讨论
细胞色素 P450(cytochrome P450,CYP450)是人体内主要的药物代谢酶系,主要存在于肝脏微粒体中,其中CYP2C19是一种重要的药物代谢酶,参与多种药物的体内代谢[8]。目前已发现的在人群中CYP2C19基因多态性涉及到25个位点,其中可以导致氯吡格雷疗效减弱的*2和*3等位基因,这在亚洲人中最为常见,而且在我国的汉族比较常见。但是维族冠心病患者CYP2C19基因型及等位基因分布与汉族存在明显不同[9]。泸州地区大部分冠心病患者为汉族,因此本研究主要涉及的患者均为汉族,不对其他少数民族进行分析。
泸州地区属于四川省,该地区冠心病患者进行PCI治疗的患者比较多,而PCI治疗后容易发生不良心血管疾病,但是关于冠心病PCI治疗后发生不良事件的原因分析没进行基因方面的研究。有研究[10]显示冠心病PCI治疗后患者存在CYP2C19基因多态性,而且检测出的6个CYP2C19基因型与冠心病PCI治疗中的药物有关。其中研究比较多的药物是氯吡咯雷,已经被广泛的应用于冠心病PCI治疗中,而药效发挥需要CYP2C19酶的作用下有效[10],因此需要对此研究。对泸州地区的冠心病PCI治疗患者CYP2C19基因多态性分布的研究未见详细报道,因此本研究的结果对泸州地区冠心病的研究具有一定意义。
赵连爽[11]等人对沈阳地区冠心病患者氯吡格雷药物代谢相关CYP2C19基因多态性分布进行研究,研究结果显示沈阳地区冠心病拟行PCI治疗患者中约60%携带CYP2C19*2、*3功能缺失基因,而且与患者的性别和年龄无关。本研究的结果与此研究结果基本一致。孙亚勤等人[12]对北京地区汉族冠心病患者CYP2C19基因多态性进行研究,研究结果显示北京地区汉族冠心病患者携带CYP2C19基因中间代谢型最多,氯吡咯雷抵抗的患者携带慢代谢型基因型未存在氯吡咯雷抵抗的患者高,氯吡咯雷抵抗的患者发生支架内血栓事件率显著高于未存在氯吡咯雷抵抗的患者。本研究结果与此研究结果不同,可能的原因是在分组方面存在一定的不同,进而导致结果不同。李琳等人对武汉地区汉族冠心病患者CYP2C19基因多态性进行研究,研究结果显示武汉地区冠心病患者中,CYP2C19基因存在多态性,而CYP2C19基因类型分布及代谢型分布与国内其他地区(北京、河南)的结果一致[13]。本研究的结果说明了泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布与我国汉族冠心病PCI治疗患者基本一致。这说明了汉族患者无论在哪个地区,CYP2C19基因多态性分布基本一致。本研究的结果与南京及周边地区[14]、云南汉族地区[15]等关于冠心病PCI治疗患者CYP2C19基因多态性分布情况基本一致。这也说明了我国汉族均存在冠心病PCI治疗患者CYP2C19基因多态性,而且分布情况基本一致。但是均比健康人群存在一定差异,这为进一步研究冠心病的治疗提供一定参考。
本次研究对泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布进行分析,结果表明了汉族各省的冠心病PCI治疗患者CYP2C19基因多态性分布情况基本一致,这也说明了我国汉族冠心病PCI治疗患者CYP2C19基因多态性分布情况基本相同。
综上所述,对泸州地区冠心病PCI治疗患者CYP2C19基因多态性分布情况进行检测可以分析冠心病的发病情况,并对补充本地区冠心病PCI治疗患者CYP2C19基因多态性分布提供一定参考。

