乳腺癌患者血清性激素、IGF-1、VEGF和组织LOX水平与淋巴结转移的相关性分析
邢海霞 赵明燕 郭勇
乳腺癌为我国常见恶性肿瘤,随着大众饮食结构及生活习惯的改变,乳腺癌呈现发病年轻化趋势[1]。淋巴系统转移为乳腺癌转移的主要途径之一,转移状态是影响患者预后的重要因素[2]。故探析乳腺癌淋巴结转移发生的影响因素,有其必要性。近期有学者研究发现,乳腺癌患者可发生不同程度性激素代谢紊乱,性激素水平与患者淋巴结转移等临床特征具有一定相关性[3]。赖氨酰化酶(lysyl oxidase,LOX)是细胞外基质的主要成分,可氧化胶原蛋白及弹性蛋白上的特殊氨基酸残基,对细胞外基质发育、成熟及维持其稳定性具有重要作用。LOX与恶性肿瘤发生发展、侵袭转移关系密切[4]。另外,近年来,胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、血管内皮生 长 因 子(vascular endothelial growth factor,VEGF)与恶性肿瘤的关系受到学术界广泛关注,IGF-1可刺激乳腺癌细胞分裂,而增加其恶性程度及转移潜力;VEGF则为刺激血管和淋巴微管形成的信号蛋白,可促进恶性肿瘤细胞增殖[5]。基于此,本研究回顾性分析驻马店市中心医院86例行手术治疗的乳腺癌患者临床资料,以评估组织LOX表达情况、血清性激素及IGF-1、VEGF水平与乳腺癌淋巴结转移的相关性,为临床尽早诊治乳腺癌提供参考依据。
1 资料与方法
1.1 一般资料
回顾性分析2015年2月至2017年12月我院86例行手术治疗的乳腺癌患者临床资料,其中伴淋巴结转移者44例(转移组),无淋巴结转移者42例(无转移组),并将同期入院的40例乳腺良性肿瘤患者纳入良性组。纳入标准:经手术病理学检查确诊为乳腺癌或乳腺良性肿瘤者;年龄为18~65岁者;临床资料完整者。排除标准:伴严重感染、糖尿病等手术禁忌证者;既往放化疗或激素治疗者;合并其他恶性肿瘤者;妊娠或哺乳期妇女。3组患者均为女性。转移组年龄40~63岁,平均(51.15±9.65)岁;体质量指数(body mass index,BMI)18~24 kg/m2,平均(21.68±2.05)kg/m2。无转移组年龄 41~63岁,平均(50.84±9.17)岁;BMI 19~24 kg/m2,平均(21.92±1.94)kg/m2。良性组年龄 40~62岁,平均(50.22±9.36)岁;BMI 18~24 kg/m2,平均(22.04±2.11)kg/m2。3 组年龄、BMI等一般资料比较,差异无统计学意义(P>0.05)。
1.2 研究方法
转移组及无转移组乳腺癌患者均行改良乳腺癌根治术,良性组患者均予以弧形切口切除手术治疗。于术前,使用化学发光免疫法检测3组血清雌二醇(estradiol,E2)、睾酮(testosterone,T)、孕酮(progesterone,P)水平;使用酶联免疫分析法检测3组血清IGF-1、VEGF水平;通过灌胶、电泳、转膜、封闭后加抗体检测LOX在乳腺癌患者乳腺癌组织及良性组良性病变组织中表达情况,并利用发光法以目的条带面积灰度值做半定量检测LOX相对表达量。
1.3 试剂及仪器
化学发光免疫法试剂购自德国罗氏公司;酶联免疫分析法试剂购自美国R&D公司;LOX抗体试剂购自北京博奥森生物技术有限公司;化学发光仪购自德国罗氏公司;酶标仪购自澳大利亚博赛生物公司。
1.4 观察指标
3组患者术前血清E2、T、P、IGF-1、VEGF 水平及组织(乳腺癌患者取乳腺癌组织、良性组取良性病变组织)LOX相对表达量和术后4周时血清IGF-1、VEGF水平差异,同时分析乳腺癌患者术前血清E2、T、P、IGF-1、VEGF水平、组织LOX相对表达量与淋巴结转移的相关性。
1.5 统计学方法
数据处理用SPSS 19.0软件,计量资料以表示,多组间比较使用多因素方差分析,2组间采用独立样本t检验;计数资料以n(%)表示,采用χ2检验;相关性分析使用Spearman相关性分析法;P<0.05为差异有统计学意义。
2 结果
2.1 3组术前血清血清E2、T、P、IGF-1、VEGF水平及组织LOX相对表达量比较
3组术前血清T水平比较,差异无统计学意义(P>0.05);而血清E2、P、IGF-1、VEGF水平及组织LOX相对表达量比较,均为转移组高于无转移组及良性组(P<0.05),且无转移组高于良性组(P<0.05),见表1。
表1 3组术前血清E2、T、P、IGF-1、VEGF水平及组织LOX相对表达量比较(±s)Table 1 Comparison of preoperative serum levels of E2,T,P,IGF-1,VEGF and relative expression level of tissue LOX in the 3 groups(± s)
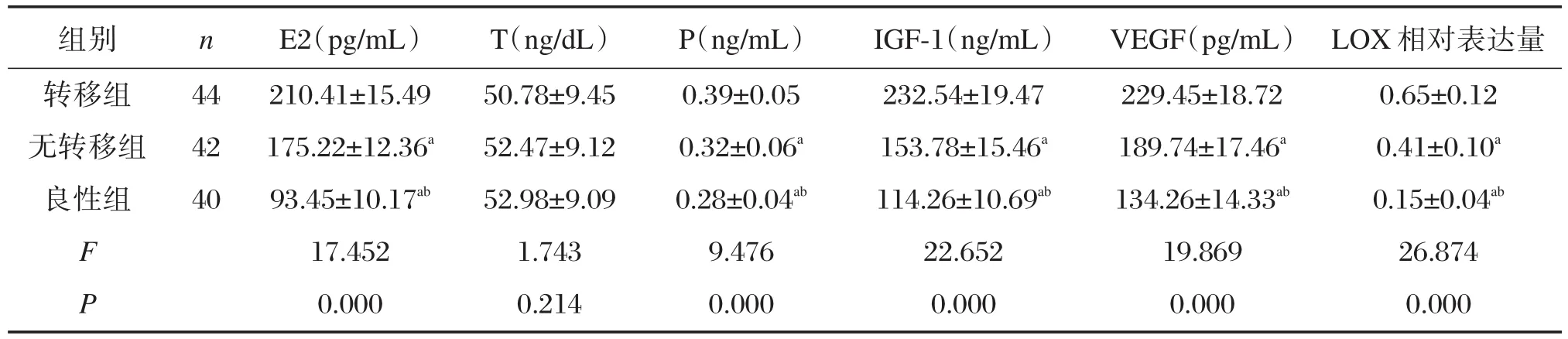
表1 3组术前血清E2、T、P、IGF-1、VEGF水平及组织LOX相对表达量比较(±s)Table 1 Comparison of preoperative serum levels of E2,T,P,IGF-1,VEGF and relative expression level of tissue LOX in the 3 groups(± s)
与转移组比较,aP<0.001;与无转移组比较,bP<0.001。
组别转移组无转移组良性组n 44 42 40 F P E2(pg/mL)210.41±15.49 175.22±12.36a 93.45±10.17ab 17.452 0.000 T(ng/dL)50.78±9.45 52.47±9.12 52.98±9.09 1.743 0.214 P(ng/mL)0.39±0.05 0.32±0.06a 0.28±0.04ab 9.476 0.000 IGF-1(ng/mL)232.54±19.47 153.78±15.46a 114.26±10.69ab 22.652 0.000 VEGF(pg/mL)229.45±18.72 189.74±17.46a 134.26±14.33ab 19.869 0.000 LOX相对表达量0.65±0.12 0.41±0.10a 0.15±0.04ab 26.874 0.000
2.2 转移组及无转移组手术前后血清IGF-1、VEGF水平比较
术前,无转移组血清IGF-1、VEGF水平低于转移组(P<0.05);术后4周时,2组血清 IGF-1、VEGF水平均较术前降低(P<0.05),且无转移组仍低于转移组(P<0.05),见表2。
表2 2组手术前后血清IGF-1、VEGF水平比较(±s)Table 2 Comparison of serum IGF-1 and VEGF levels before and after operation in the 2 groups(± s)

表2 2组手术前后血清IGF-1、VEGF水平比较(±s)Table 2 Comparison of serum IGF-1 and VEGF levels before and after operation in the 2 groups(± s)
组别n t P t P转移组无转移组44 42 27.284 26.581 0.000 0.000 12.888 14.821 0.000 0.000 t P IGF-1(ng/mL)术前232.54±19.47 153.78±15.46 20.712 0.000术后160.23±15.69 101.26±10.15 20.587 0.000 VEGF(pg/mL)术前229.45±18.72 189.74±17.46 10.161 0.000术后195.41±16.32 152.36±15.23 12.633 0.000
2.3 乳腺癌患者术前血清E2、T、P、IGF-1、VEGF水平及组织LOX与淋巴结转移的相关性分析
将乳腺癌转移定义为1,无转移定义为0,经Spearman相关性分析,发现乳腺癌患者血清T及P水平与其淋巴结转移无相关性(P>0.05),而血清E2、IGF-1、VEGF水平、乳腺癌组织LOX相对表达量与其淋巴结转移呈显著正相关(P<0.05),见表3。
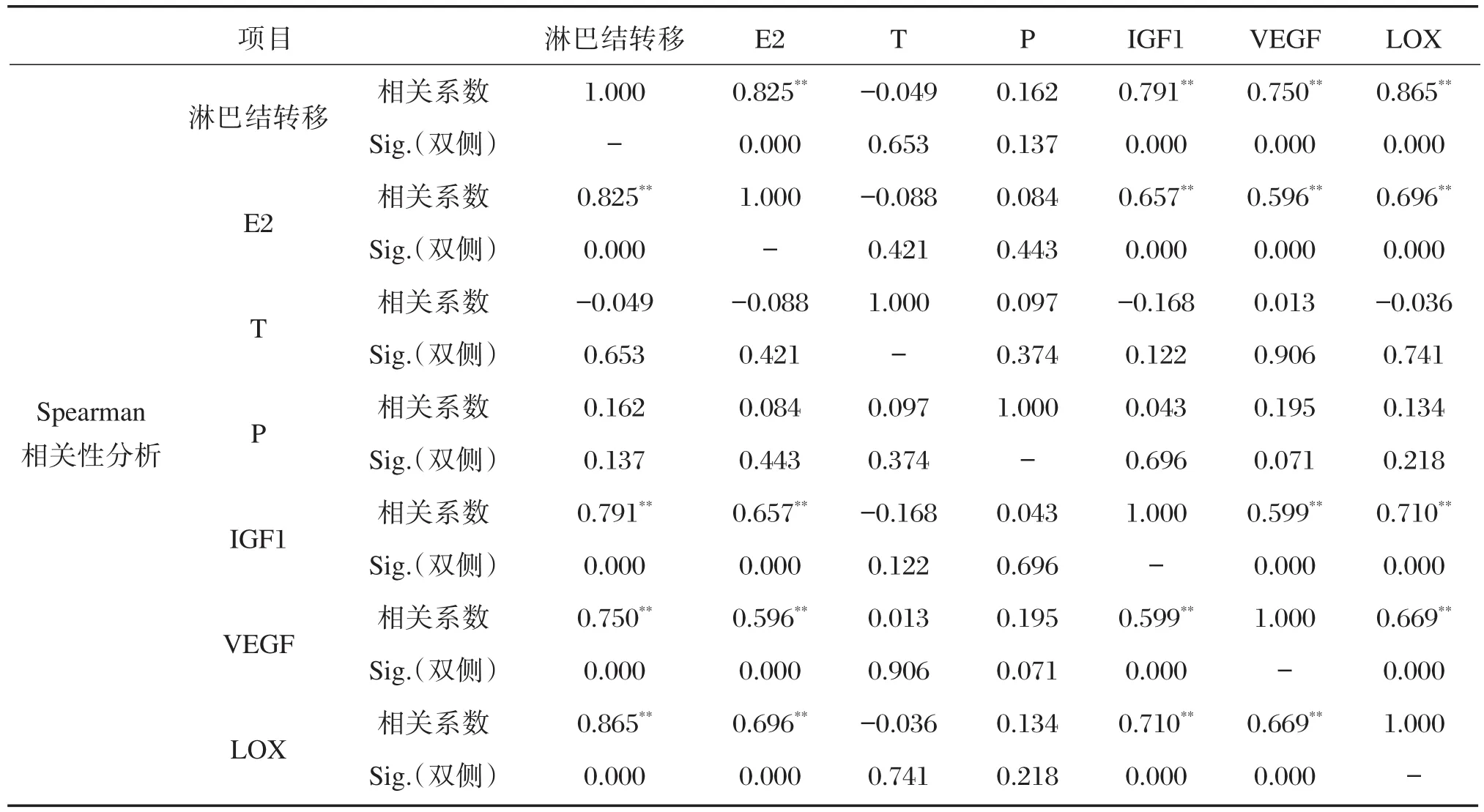
表3 乳腺癌淋巴结转移的相关性分析(n=86)Table 3 Correlation analysis of lymph node metastasis in breast cancer(n=86)
3 讨论
淋巴结转移在乳腺癌中发生率较高,淋巴结转移不仅影响手术疗效,亦是导致患者预后不良的重要因素[6]。目前,临床诊断乳腺癌患者是否发生淋巴结转移,多通过电子计算机断层扫描(computed tomography,CT)、钼靶等影像学检查,均可出现一定漏诊及误诊[7]。影像学检查常造成不同程度辐射损伤,使其使用受到一定限制。故利用血清学指标筛选出淋巴结转移风险较高者,对其予以重点监测,受到学术界广泛关注。
乳腺癌病因与遗传基因缺损、内源性性激素-免疫激素-细胞基因受体等生理病理变化有关,其中内源性性激素可促进乳腺局部E2合成增多,E2具有刺激乳腺导管上皮细胞增生等作用,可提高乳腺癌细胞增殖能力及转移潜力[8]。故乳腺癌患者血清E2水平与其淋巴结转移可能存在相关性。T、P等性激素能刺激乳腺细胞增殖,并促进乳腺上皮组织内生长因子合成,与乳腺癌恶性程度具有一定联系[9]。外国学者[10]研究发现,血清T水平与乳腺癌淋巴结转移状态呈正相关。而本研究结果显示,转移组血清E2、P水平均高于无转移组及良性组,但3组T水平比较,差异无统计学意义。提示E2、P能通过性激素代谢等生理病理反应,使乳腺癌细胞增殖,并增加淋巴结转移发生率。血清T水平则对乳腺癌增殖及淋巴结转移等情况影响较小,与上述外国学者研究结果不同。考虑造成该结果的原因有人种差异、内分泌代谢不同或检验方法不一致。
据文献报道,LOX可参与胃癌、乳腺癌等恶性肿瘤的发生发展,并推测其原因可能为LOX异常表达使细胞外基质结构及功能异常,进而破坏肿瘤转移的生理屏障,达到促进肿瘤转移的作用[11]。而本研究也发现,转移组乳腺癌组织LOX相对表达量显著高于无转移组,且转移组及无转移组的组织LOX相对表达量均高于良性组的良性病变组织,与上述报道结果一致。然而,组织LOX表达情况需要通过病理活检检出,在术前评估中受到一定限制。但也有学者指出,仍可利用术后病理组织检查LOX表达情况等方式,分析恶性肿瘤情况发展状态,对手术效果及患者预后情况作出预测[12]。
另外,日本学者 Mahdavi等[13]指出,IGF-1 不仅能作用于乳腺细胞基质,还能刺激乳腺癌患者雌激素活性,同时促进卵巢功能兴奋,使机体雌激素水平升高,并与雌激素产生协同作用,以促进乳腺癌细胞增殖,提高其转移潜能。本研究结果也显示,转移组术前血清IGF-1水平高于无转移组和良性组,与上述学者研究结果一致。说明血清IGF-1在恶性肿瘤增殖中具有重要作用,能通过促进乳腺癌细胞增殖等方式,刺激癌细胞淋巴结转移,进而影响患者预后。不仅如此,大量实验数据显示,VEGF不仅能导致乳腺组织血管增生,还能刺激癌周围间质淋巴管增生扩张,而促进癌细胞进入淋巴管,引起淋巴结转移[14]。本研究中,转移组术前血清VEGF水平高于无转移组及良性组,且无转移组血清VEGF水平高于良性组,与学术界研究结果一致[15]。这也初步证实,VEGF在乳腺癌转移中具有重要作用。提示血清VEGF水平较高的乳腺癌患者淋巴结转移风险较高,术后存在一定肿瘤复发、转移等风险,可造成患者预后不良。术后2组IGF-1、VEGF水平较术前降低,但无转移组仍低于转移组。分析其原因可能与手术虽然能降低IGF-1、VEGF表达,但伴淋巴结转移者术后存在较大的肿瘤复发风险,使IGF-1和VEGF仍然高表达有关。
除上述结论外,本研究还发现,血清E2、IGF-1、VEGF水平、乳腺癌组织LOX相对表达量与乳腺癌淋巴结转移呈显著正相关。该结果机制可能为:血清E2、IGF-1能通过协同刺激乳腺癌细胞增殖,提高其恶性程度及转移潜力[16];血清VEGF增加能同时刺激乳腺癌细胞增生、间质淋巴管扩张,使乳腺癌患者出现淋巴结转移[17];乳腺癌组织LOX的高表达可影响细胞外基质功能,促进乳腺癌细胞迁移,而刺激病情进展,增加淋巴结转移风险[18]。因此,临床在乳腺癌患者治疗前,可通过检测其血清E2、IGF-1、VEGF水平,观察其淋巴结转移情况,并联合手术组织病理检测乳腺癌组织LOX表达水平,综合评估患者病情,预测患者预后。
综上所述,乳腺癌患者血清E2、IGF-1、VEGF水平、乳腺癌组织LOX表达与淋巴结转移呈正相关,临床可根据血清E2、IGF-1、VEGF水平及乳腺癌组织LOX表达水平评估患者淋巴结转移及病情进展情况,预测患者术后恢复状况。

