代谢综合征对行根治术前列腺癌患者预后的影响
曾明坤 刘玲 张晓梅 马涛
前列腺癌是威胁男性健康的主要生殖系统恶性肿瘤,在全球范围内发病率为9.7%,而发达国家可达15.3%,我国前列腺癌发病率虽低于欧洲国家,但近年来随着人口老龄化及生活方式的改变也呈逐年上升的趋势[1]。既往研究表明,前列腺癌发生及发展除与年龄、种族及家族遗传史等固定因素相关外,肥胖、久坐、糖尿病、高血压及高营养摄入等诸多不确定因素也被证实与其相关[2-3]。超重、糖尿病、高血压等均为代谢综合征的重要组分,既往关于代谢综合症与前列腺癌发生的相关性研究较多,但其在癌症侵袭性及预后方面的影响还有待大样本的验证[4-5]。本研究以根治性前列腺切除术患者作为研究对象,分析代谢综合症与肿瘤侵袭性及术后复发之间的关系,旨在为前列腺癌治疗及预后评估提供理论依据。
1 资料与方法
1.1 一般资料
选择2013年1月至2016年12月于凉山彝族自治州西昌市人民医院行根治性前列腺切除术的92例前列腺癌患者纳入研究,纳入标准:参考中华医学会泌尿外科学会前列腺癌诊断指南[6],经病理检查确诊;临床资料完整;对本研究知情且签署同意书。排除标准:合并其他恶性肿瘤;因抗雄或去势治疗等情况导致肿瘤病理情况无法评估者;合并急、慢性肝肾功能障碍患者;有前列腺癌家族史者。
1.2 方法
临床资料收集:收集所有患者的体质量指数(body mass index,BMI)、空腹血糖、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL-C)、高密度脂蛋白(high density lipoprotein,HDL-L)等一般生化指标及前列腺特异性抗原(prostate specific antigen,PSA)等实验室指标。按照患者是否合并代谢综合征将患者分为前列腺癌合并代谢综合征(metabolic syndrome,MS)组(60例)及单纯前列腺癌组(32例)。代谢综合征诊断标准参考《中国成人血脂异常防治指南》[7]修订的组分量化标准:腹型肥胖腰围≥90 cm;空腹血糖≥6.1 mmol/L或餐后2 h血糖≥7.8 mmol/L;血压≥130/85 mmHg;TG≥1.7 mmol/L;HDL-L≤1.04 mmol/L,符合以上项目中3项或以上者可确诊为代谢综合征。其中前列腺癌合并MS组患者年龄范围49~78岁,平均年龄(58.62±8.94)岁;单纯前列腺癌患者年龄范围48~80岁,平均年龄(57.64±10.22)岁,组间比较差异无统计学意义(P>0.05)。
根据手术情况及病理诊断报告进行患者病理T分期(pathological staging,pT),根据肿瘤是否存在前列腺外浸润分为肿瘤前列腺外浸润期组(pT3~pT4期)及局限组(pT1~T2期);根据 Gleason评分[8]分为低危组(Gleason评分<8分)及高危组(Gleason评分≥8分)。
随访调查:对患者进行随访,随访以门诊随访及电话随访为主,第一年每3个月随访一次,之后每半年随访一次,连续随访3次未能取得联系则为失访,随访日期截止至2018年3月,随访内容为血清PSA水平,连续2次PSA水平≥0.2 μg/mL为生化复发[9],生化复发时间为接受根治术日期至随访发现生化复发的时间间隔。
1.3 统计学分析
采用SPSS 19.0进行数据的整理与统计学分析,计数资料采用χ2检验,计量资料以均数±标准差表示,组间比较采用t检验,MS对前列腺癌临床病理因素的影响采用Logistic多因素回归分析,患者术后生化复发采用Kaplan-Meier法及多因素Cox比例风险模型分析,检验水准α=0.05,以P<0.05表示差异具有统计学意义。
2 结果
2.1 2组患者临床资料比较
2组患者空腹血糖、BMI、HDL-C、PSA、Gleason评分、病理分期及切缘阳性比例等方面差异显著(P<0.05),详见表1。
2.2 MS对前列腺癌患者前列腺外浸润及Gleason评分≥8分的Logistic回归分析
经多因素Logistic回归分析矫正年龄、术前PSA水平、病理分期等因素后,合并MS的患者肿瘤前列腺外浸润的风险为非MS患者的2.314倍;合并MS的患者Gleason评分≥8分的风险是非MS患者的1.849倍,详见表2。
2.3 生存曲线分析
本研究最短随访时间为16个月,最长随访时间为61个月。采用Kaplan-Meier法构建生存曲线,经检验,前列腺合并MS组无生化复发生存时间显著短于单纯前列腺组(P<0.05),见图1。
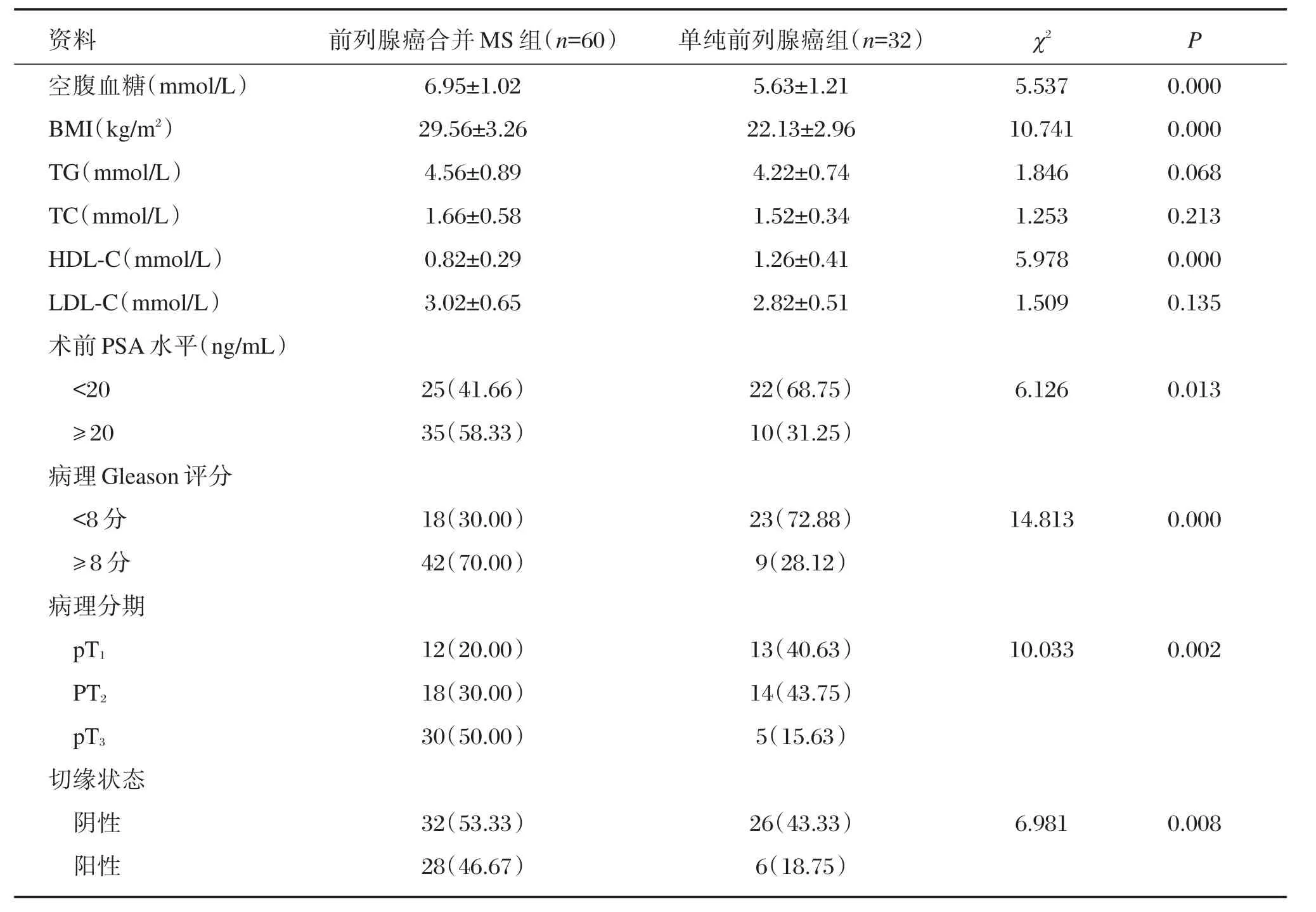
表1 2组患者临床资料比较Table 1 Comparison of clinical data between 2 groups of patients
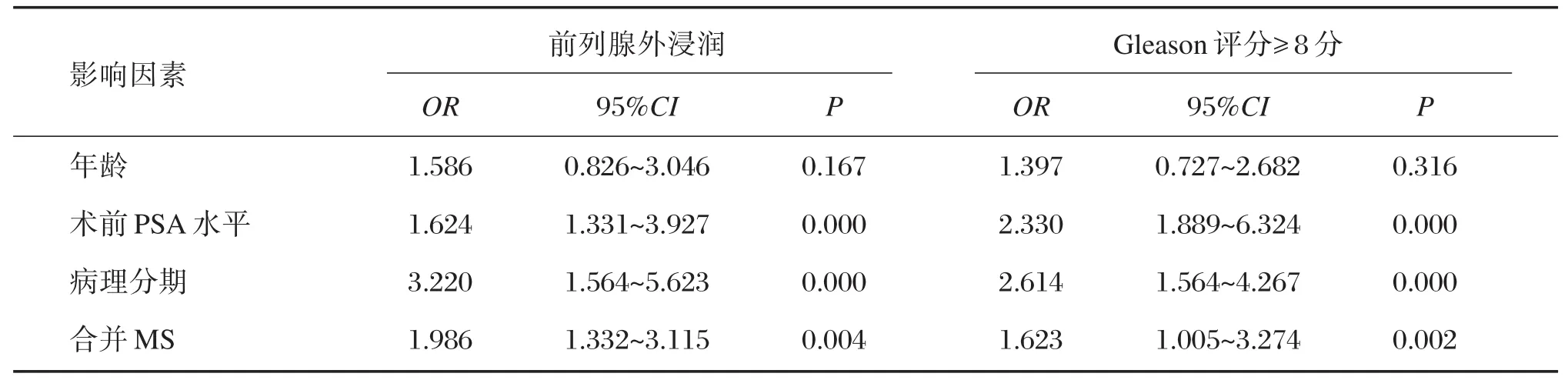
表2 MS与前列腺癌患者前列腺外浸润及Gleason评分≥8分的Logistic回归分析Table 2 Logistic regression analysis of extra-prostatic extracorporeal infiltration and Gleason score≥8 in patients with MS and prostate cancer
2.4 影响患者生化复发的Cox生存多因素分析
将各因素纳入Cox风险比例模型多因素分析显示,有无合并MS、Gleason评分、病理分期及切缘阳性为前列腺癌患者根治术后生化复发的影响因素(P<0.05);合并MS的患者根治术后生化复发风险为非MS患者的1.23倍,见表3。
3 讨论
MS是以中心性肥胖、糖尿病或糖调节功能损伤、胰岛素抵抗、血脂异常及高血压等为共同病理生理基础,多种代谢疾病合并出现的临床症候群[10]。部分学者认为MS为前列腺癌的新病因,但关于其与前列腺侵袭性及预后的相关研究仍存在一定争议[11-12]。
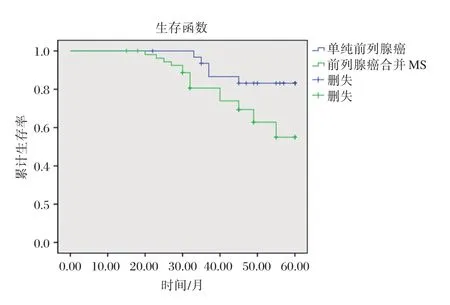
图1 采用Kaplan-Meier法分析2组患者生化复发情况Figure 1 Kaplan-Meier analysis of biochemical recurrence in the 2 groups of patients
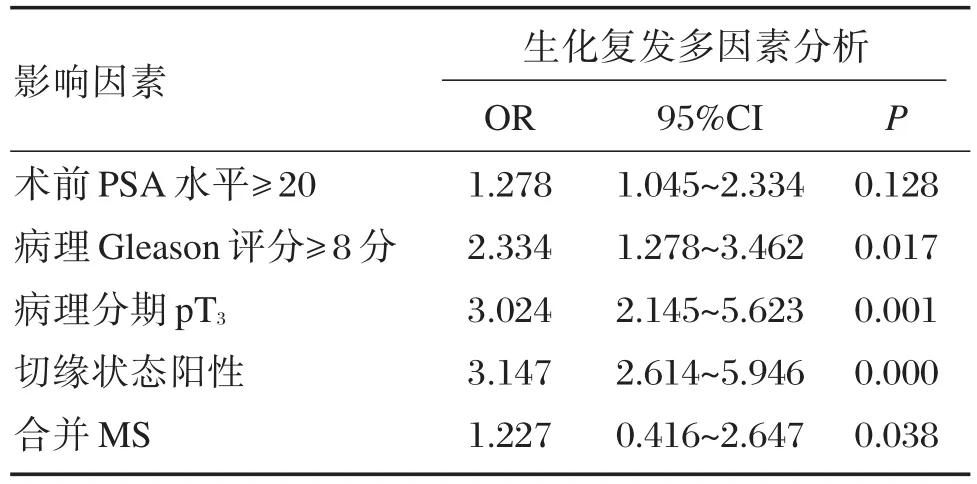
表3 影响患者生化复发的Cox多因素分析Table 3 Coxmultivariate analysis of patients with biochemical recurrence
本研究结果显示,合并及不合并MS的患者在术前PSA水平、病理Gleason评分、病理分期及切缘阳性率等方面具有明显差异。分析MS与诸多前列腺癌临床资料的关系,其中PSA为临床筛查前列腺癌的主要指标,其水平在一定程度上反映患者的病情进展程度,合并MS的患者PSA<20 ng/mL的比例多于不合并MS的患者,提示MS可能与血清PSA水平相关,也证实MS与前列腺癌进展程度的相关性;Gleason评分、病理分期及切缘阳性率也可一定程度反映肿瘤侵袭的程度,合并MS的患者具有更高的Gleason评分、病理分期及切缘阳性率,提示合并MS的患者肿瘤恶性程度更高,推测MS的发生可能可加速前列腺肿瘤的进展,使得合并MS的患者具有更高的恶性程度。既往关于前列腺癌侵袭性与MS的相关性研究结果不尽相同,de Nunzio等人[13]对195例前列腺癌患者进行研究发现,合并MS患者较非MS患者Gleason评分明显升高;郭耀川等人[14]证实代谢综合征与肿瘤前列腺外浸润及Gleason评分>8显著相关;但一项来自韩国的210例前列腺癌横断面调查中,MS与前列腺癌的病理分期及Gleason分级均无明显相关[15]。本研究与前者结果类似,另外,本研究中多因素Logistic回归也进一步证实MS对前列腺癌侵袭性的影响,进一步证实MS是前列腺癌进展的危险因素,结合前人关于MS与前列腺癌分子机制研究,推测可能与MS中多种交叉关联的代谢激素通路的相互作用有关,如糖尿病患者胰岛素样生长因子升高、肥胖患者瘦素、白细胞介素、脂联素水平异常等。
根治性前列腺癌术后生化复发受诸多因素的影响,目前临床证实影响因素主要有血清PSA水平、临床分期、Gleason评分、切缘状态、手术方法等,这些因素相互影响,共同作用决定患者的预后[16-17]。MS作为一种与前列腺癌发生发展相关的合并征,可能也与患者预后存在一定相关性。本研究生存分析结果提示合并MS的前列腺癌患者具有更短的生化复发时间,提示MS可能可在一定程度上提高根治术后生化复发率,降低患者预后。结合前人研究,分析MS与前列腺癌生化复发的关系,一方面,合并MS的前列腺癌患者肿瘤恶性程度更高,侵犯周围组织更多,术后肿瘤细胞极易再次复发;另一方面,合并MS的患者在根治术后机体也处于激素分泌失衡、炎性浸润状态中,长期的机体改变也可在一定程度上刺激肿瘤的生化复发。翟明慧等人[18]研究证实T分期≥T2、Gleason评分≥7分、治疗前PSA≥10 ng/mL及肥胖的前列腺癌患者生化复发风险较高。本研究与其研究结果类似,但本研究对MS不同组分对患者预后的研究仍存在一定限制,后期可进一步针对单一组分进行分析、总结。
综上,MS与前列腺癌发展相关,是影响根治性前列腺癌患者术后生化复发的危险因素。

