PPARGC1启动子甲基化与Ⅱ型糖尿病发病相关性分析
梁爽 王伟伟 孙力 邹广慧 董志武★
糖尿病(diabetes mellitus,DM)是临床上常见的代谢性疾病,其中Ⅱ型糖尿病(type 2 diabetes Mellitus,T2DM)约占 DM 的 90%[1]。而 T2DM 发病机制复杂,遗传与环境在T2DM过程中发挥着重要的作用[2]。近年来,表观遗传学研究已成为研究糖尿病发病机制的热点。表观遗传学指在不影响DNA序列的情况下基因修饰的改变,主要包括DNA甲基化、染色质修饰、基因组印记等[3],其中最常见的表观遗传修饰方式为DNA甲基化。DNA甲基化在胞嘧啶鸟嘌呤二核苷酸(cytosinephosphate-guanine,CpG)丰富的序列,也称为“CpG岛”,位于已知基因的启动子区域,其作用主要是导致基因表达的沉默[4]。
PPARGC1蛋白家族有3个成员:α,β和α相关协同激活因子,主要在富含线粒体的组织中表达,调节体内糖类与脂类代谢、脂肪酸β氧化、脂肪细胞分化等多种代谢过程[5]。有研究发现在多种糖尿病研究模型及人种中PPARGC1的异常表达,并参与了线粒体的生物形成和脂肪酸的β氧化等过程,是线粒体基因转录的关键因子[6]。另外研究显示PPARGC1参与T2DM的发病机制可能与患者胰腺PPARGC1启动子DNA甲基化水平升高,PPARGC1基因mRNA表达减少,从而引起胰岛素分泌减少相关[7]。因此,PPARGC1基因是研究T2DM发病机制的关键候选基因。
本研究旨在探讨T2DM的危险因素及PPARGC1启动子甲基化与T2DM发病的相关性,尝试从表观遗传学解释T2DM的发病机制。
1 对象与方法
1.1 研究对象
选取于2015年1月至2017年12月在上海市第六人民医院金山分院体检或住院期间诊断为T2DM的患者57例,将其归为糖尿病组;其中男22例,女35例,年龄 51~66岁,平均(59.00±3.01)岁;选取同期体检健康志愿者152例,确定为对照组;其中男 47例,女 105例,年龄 47~58岁,平均(51.00±3.23)岁。排除标准:既往明确诊断有除糖尿病以外的其他代谢性疾病,心脑血管疾病或肿瘤等疾病者以及妊娠期、哺乳期者。两组患者性别、年龄等一般资料上差异无统计学意义(P>0.05),具有可比性。本研究由我院伦理管理委员会批准[伦研批第(201401)],所有受试者均知情同意且签署知情同意书。
1.2 方法
1.2.1 标本处理
将体检当日或入院次日清晨空腹采集静脉血3 mL置于促凝剂分离胶管中,1 500 rpm离心10 min,检测血清中空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和脂蛋白a(lipoprotein a,LPPA)的水平,另采集静脉血2 mL置于EDTA·K3抗凝管,采用美国Qiagen公司的全血基因组DNA提取试剂盒进行全血基因组DNA提取。
1.2.2 重亚硫酸盐直接测序
从糖尿病组和对照组中各随机选取26名研究对象进行基因组DNA提取,取1 μg提取的DNA样本进行重亚硫酸盐处理。以修饰后的DNA为模板,用Pfu DNA Polymerase高温聚合酶扩增PPARGC-1α基因启动子基因片段。通过Snapgene软件设计扩增引物,上游引物5′-CCGTGGGATTCCGTCAATCCCTCC-3′,下游引物 5′-CTCTTTTACAGAGTATTTTTACGTAGTAC-3′。PCR产物经3%琼脂糖凝胶电泳,凝胶成像仪记录分析。将PCR纯化产物连接到pUC18-T载体上,待连接产物转化后进行蓝白斑实验筛选,筛选完利用M13+/-引物测序(ABI 3730XL测序仪,美国)。检测启动子基因片段中7个CpG位点,这些位点在基因序列中的位置为 28,53,86,217,252,348,354。
1.2.3 各生化指标的检测
所有研究对象于清晨空腹采集静脉血,离心分离血清。采用西门子全自动生化分析仪ADVIA2400(西门子公司,美国)及其配套相关试剂检测FPG、TG、TC、HDL-C、LDL-C和LPPA水平。所有检测均严格按照试剂盒说明书进行。
1.2.4 信息调查
参考以往研究,以调查问卷方式收集并确认患者资料。问卷项目包括个人一般情况及个人健康情况,如高血压、冠心病、脑血管疾病,是否有家族遗传病史等一般资料,T2DM诊断参考临床诊断标准[8]。
1.3 统计学分析
采用Epidata3.1建立数据库,数据实行双录入法。应用SPSS 25.0软件进行统计学处理。对数据进行Komogorov-Smirnov(K-S)正态性检验,计量资料采用t检验和秩和检验进行处理,并分别采用均数和标准差的形式表示。分类资料采用χ2检验进行分析。Logistic回归方法分析糖尿病发生的危险因素,P<0.05为差异具有统计学意义。
2 结果
2.1 糖尿病组与对照组单因素统计分析
K-S正态分析研究2组对象的临床特征,身体质量指数(body mass index,BMI)、腰围、收缩压、TC、HDL和LDL符合正态分布;而年龄、身高、体重、舒张压、FPG,TG和LPPA不符合正态分布。分别采用t检验和秩和检验进行统计分析。结果显示,与对照组相比,糖尿病组病人的BMI(t=2.968,P<0.05)、腰围(t=4.858,P<0.05)和体重(Z=2.858,P<0.05)均明显增高,且其平均年龄(Z=3.924,P<0.05)均大于正常对照(表1);对2组样本计数资料进行χ2分析,结果显示2组间糖尿病家族史差异有统计学意义(χ2=7.711,P<0.05),其他指标均显示P>0.05,差异无统计学意义。
2.2 糖尿病风险多因素回归分析
综合单因素统计分析结果,将单因素分析结果P<0.05的变量进行多因素Logistic回归分析。以是否患糖尿病为因变量(0=否,1=是),以糖尿病家族史(X1)、年龄(X2)、腰围(X3)、体重(X4)及BMI(X5)作为自变量进行Logistic回归分析。根据变量赋值方式的约定,入选因素的参数估计值为正,则该因素的量化值越大,越促进糖尿病的发生;否则即为保护因素。同时,其对糖尿病患病的影响大小可由标准化参数估计值的大小来反映。由表2可知,糖尿病家族史、年龄、腰围均为导致糖尿病发生的不利因素,其OR值均>1,糖尿病家族史OR值较大,意义更大。
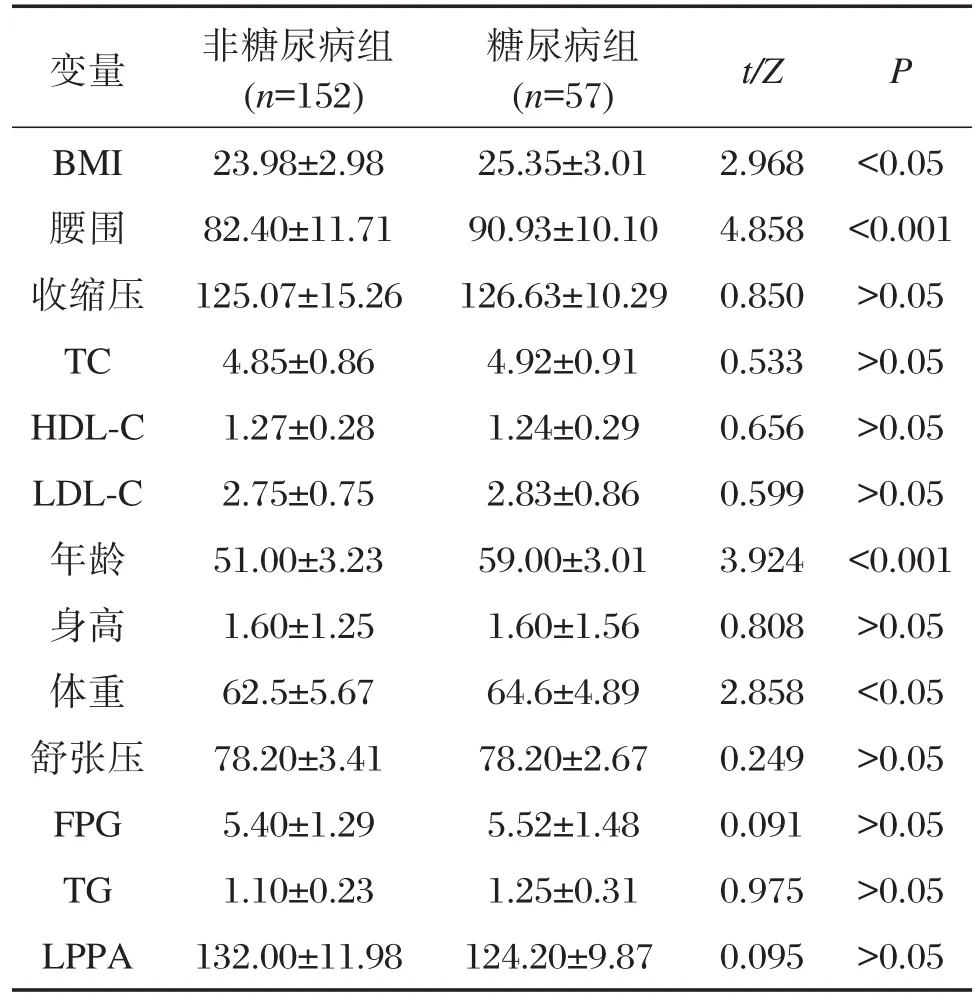
表1 糖尿病组和对照组各个指标的比较Table 1 The comparison of each index between the type 2 diabetes mellitus group and the control group
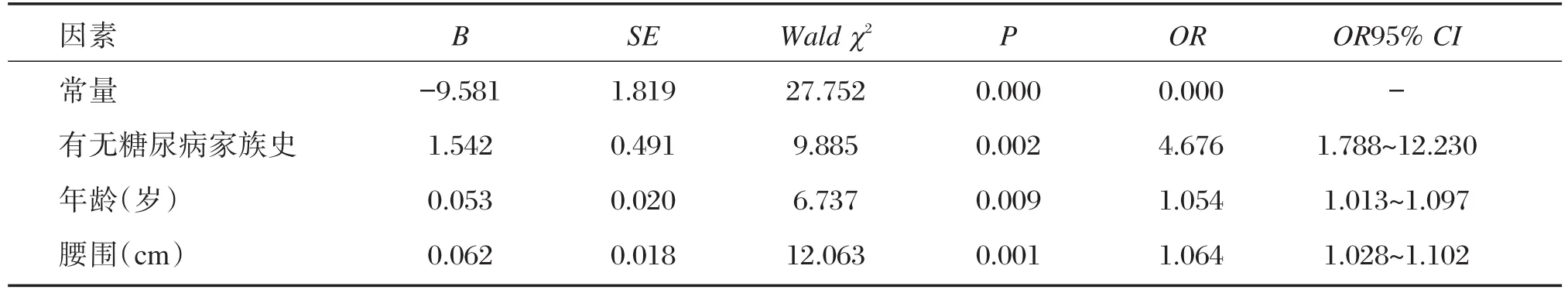
表2 糖尿病发生影响因素的Logistic回归Table 2 The result of Logistic regression analysis of risk factors for type 2 diabetes mellitus
2.3 PPARGC1基因启动子甲基化与糖尿病关系回归分析
以是否患糖尿病作为因变量(0=否,1=是),以年龄(X1)、身高(X2)、是否 久坐(X3)、PPARGC-1α甲基化(X4)及最近测量血糖和血脂时间(X5)作为自变量进行Logistic回归分析,结果显示甲基化水平与糖尿病患病呈低度正相关(表3)。
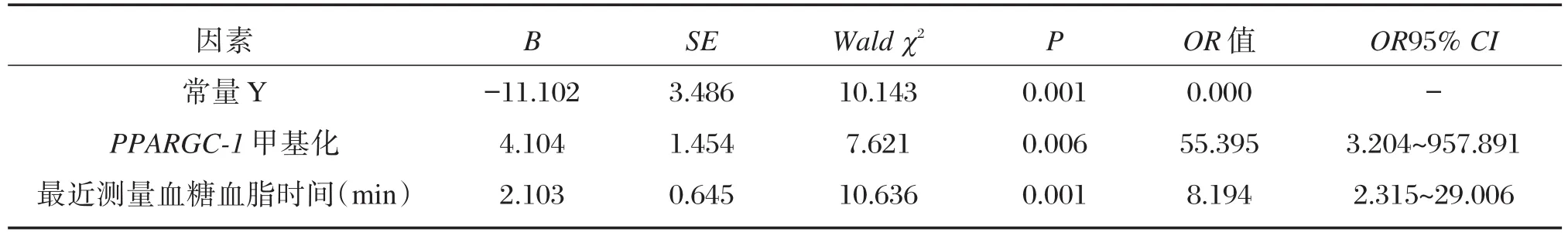
表3 糖尿病发生影响因素的Logistic回归Table 3 The result of Logistic regression analysis of risk factors for type 2 diabetes mellitus
3 讨论
T2DM患病率随着人口老龄化和人们生活方式的转变呈现逐渐递增的趋势。据国际糖尿病联盟数据显示,目前全球糖尿病患者约4.15亿并预计在2040年达到6.42亿[9]。近年来的研究调查结果显示,T2DM与遗传和环境因素关系密切[2],这两者通过表观遗传修饰的改变,特别是DNA甲基化,在连接遗传和环境因素的发病机制和进展中发挥作用,最终导致T2DM的发生发展[10]。有研究发现PPARGC1基因编码区突变与T2DM及相关代谢表型相关,其启动子变异也可能影响了PPARGC1的转录水平,从而参与T2DM疾病的发生[11]。
DNA甲基化水平受到环境、疾病、年龄和性别等因素的影响。已有研究证实,饮食、年龄及性别等环境因素与DNA甲基化修饰显著相关[12]。本研究通过对糖尿病组与对照组样本临床特征分析发现,2 组样本中,患者的 BMI(t=2.968,P<0.05)、腰围(t=4.858,P<0.05)和体重(Z=2.858,P<0.05)、年龄(Z=3.924,P<0.05)、糖尿病家族史(χ2=7.711,P<0.05)为糖尿病患病危险因素;与前期研究结果相符[13]。进一步统计分析结果糖尿病家族史(OR=4.676;95%CI:1.788~12.230;P<0.05)、年龄(OR=1.054;95%CI:1.013~1.097;P<0.05)、腰 围(OR=1.064;95%CI:1.028~1.102;P<0.05)均为导致糖尿病发生的不利因素;该结论也与其他相关研究结论相近[14-15],结果提示年龄、腰围,尤其糖尿病家族史对T2DM预防和控制有积极意义。
T2DM的发生是一个复杂的过程。目前认为T2DM是由胰岛素抵抗与胰岛素分泌不足的双重缺陷共同作用所导致[16]。有研究显示T2DM过程中存在糖代谢、脂肪代谢以及线粒体能量代谢等多系统和多通路代谢异常。Brons等[17]的研究表明高脂肪的摄入会诱导胰岛素抵抗及增加PPARGC1基因的DNA甲基化程度,提示T2DM过程中存在脂肪代谢异常。Jiang等[18]的研究则提示T2DM过程可能涉及糖代谢异常。因此,探索该过程中的效应分子,进一步揭示T2DM的发病机制,有利于在T2DM的预防和治疗领域为我们提供新的启发。PPARGC1因其能够调节糖脂代谢和线粒体能量代谢,进而损伤胰岛β细胞,使葡萄糖刺激的胰岛素分泌减少而参与T2DM的发生过程,受到广泛关注。本研究采用重亚硫酸盐修饰测序技术检测PPARGC1基因甲基化水平。该技术既可以明确甲基化的确切位置,也可以检测甲基化的程度,是目前公认的DNA样品甲基化检测的推荐方法[19]。PPARGC1基因启动子甲基化在糖尿病发生中具有重要作用,甲基化水平与糖尿病患病呈低度正相关,之前有研究表明PPARGC1启动子C等位基因多态性与T2DM发病微弱关联[20]。
PPARGC1最早作为调控脂肪细胞分化的过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptors,PPARγ)的辅激活因子被发现,其后相继发现了其对下游靶转录因子调控的生物学功能。目前国内外普遍认为PPARGC1基因是T2DM中的关键候选基因,因其在人体能量代谢的调节中起核心作用,PPARGC1启动子的甲基化会影响其分子的正常表达,进而导致T2DM症状。因此,阐明PPARGC1启动子甲基化与T2DM的关系,有望为胰岛素抵抗T2DM的治疗提供思路。

