Vimentin和Suivivin在子宫内膜腺癌中的表达及其相关性研究
梁利丹,焦丹丹
子宫内膜癌(endometrium carcinoma)为女性生殖系统的三大恶性肿瘤之一,其中子宫内膜腺癌占80%~90%,严重威胁女性生殖健康及生命[1-2]。Suivivin属于凋亡蛋白抑制因子家族 (inhibitor of apoptosis proteins,IAPS) 成员,即凋亡蛋白抑制因子,Ambrosini等[3]应用EPR-1 (effector cell protease receptor-1)的cDNA最先分离出来,是人类基因组编码的IAP家族成员之一。Suivivin是一种相对分子质量为16.5 kD的蛋白质,由142个氨基酸构成。Suivivin可引起细胞的增殖失调控、永生化,进而发生癌变,参与血管生成,为肿瘤细胞的浸润和转移提供路径。
Vimentin是波形蛋白,属于Ⅲ型中间丝蛋白之一。而中间丝蛋白是细胞骨架的重要结构[4],主要源于上皮细胞和间充质细胞,主要存在于白细胞、成纤维细胞等来源于中胚层的细胞中,与微管、微丝等构成了细胞骨架,对于调节及维持细胞功能起着重要的作用。Vimentin基因定位在染色体的10p13,DNA约为10 kb长度; 有研究显示Vimentin参与细胞迁移、黏附,参与细胞信号转导。Vimentin的存在有促进肿瘤细胞迁移的作用。
Vimentin和Suivivin在子宫内膜腺癌中的表达关系尚不明确,因此,本文采用免疫组化方法监测Vimentin和Suivivin在子宫内膜腺癌中的表达情况,以探讨二者与子宫内膜腺癌的相关性。现报道如下。
1 材料与方法
1.1材料收集我院2009年至2012年刮宫或者手术切除标本的存档蜡块,其中子宫内膜不典型增生27例(对照组)、子宫内膜腺癌58例(按照FIGO2009分期),均经病理确诊。以上标本均经4%甲醛固定,石蜡包埋切片,所有病例无其他恶性肿瘤。按照FIGO(2009) 分期标准及组织学分级标准:Ⅰ期16例,Ⅱ期25例,Ⅲ期17例;G1级25例,G2级16例,G3级17例。所有子宫内膜腺癌手术前未接受过性激素替代治疗或放、化疗。DAB酶底物显色剂,兔抗人Vimentin单克隆抗体(即用型),SP免疫组化试剂盒,兔抗人Suivivin单克隆抗体(即用型)及SP免疫组化试剂盒均购自福建迈新生物工程有限公司。
1.2检测方法采用免疫组化SP法将石蜡组织制作成4 μm, 经二甲苯梯度脱蜡,梯度乙醇脱苯至水化,进行热修复抗原,然后免疫组化染色,严格按照试剂说明书。Vimentin波形蛋白主要定位于细胞质内,以胞质内出现棕黄色的颗粒为阳性判断标准。Suivivin凋亡蛋白抑制因子主要定位于细胞质内,以细胞质内出现棕黄色颗粒为阳性判断标准。 均以福建迈新生物公司提供的阳性切片作为染色的阳性对照。将阳性细胞的百分比和染色强度进行综合评分,每个切片随机选取5个高倍镜视野(×400)进行观察,见图1-2。按照染色强度的深浅进行计分:0分为背景颜色一致或无染色,1分为淡黄色颗粒,2分为棕黄色颗粒,3分为黄褐色颗粒。按照阳性细胞数的百分比进行计分:0分无阳性细胞,1分为阳性细胞占1%~25%,2分为26%~50%,3分为>50%。颜色强度及阳性细胞数的分结果相加得分>2分者判为阳性,≤2分者为阴性。
1.3统计学方法Vimentin和Suivivin的免疫组化结果及与临床病理资料间关系使用是SPSS21统计学软件包,计数资料应用四格表χ2检验, 秩和检验分析进行统计分析Vimentin和Suivivin在子宫内膜腺癌中的表达的相关性分析。随访60个月,以死亡为终点事件,采用Kaplan-Meier生存分析法,并应用Log-rank检验,以P<0.05为显著性检验标准。
2 结果
2.1Vimentin在子宫内膜癌中的表达Vimentin阳性表达于胞质,其在子宫内膜不典型增生中的阳性率为3.70%,在子宫内膜腺癌中的阳性表达率为75.86%。子宫内膜腺癌中高中低分化的阳性表达率分别为56.00%、81.25%、100.00%,3组比较差异有统计学意义(P<0.05), Vimentin在Ⅰ期、Ⅱ期、Ⅲ期子宫内膜腺癌中的表达分别为56.25%、72.00%、100.00%,3组比较差异有统计学意义(P<0.05),与淋巴结转移相关(P<0.05),而与年龄无关(P>0.05)。在子宫内膜腺癌中分化越差、恶性程度越高、表达越强。
2.2Suivivin在子宫内膜腺癌中的表达Suivivin阳性表达为细胞膜/质,Suivivin在在子宫内膜腺癌中阳性表达于细胞质(阳性率25.92%)。子宫内膜腺癌中高中低分化Suivivin阳性率分别为64.00%、87.50%、100.00%,3组比较差异有统计学意义(P<0.05),Suivivin在Ⅰ期、Ⅱ期、Ⅲ期子宫内膜腺癌中的阳性率分别为50.00%、88.00%、100.00%,3组比较差异有统计学意义(P<0.05)。Suivivin的表达与组织学分级及FIGO分期相关(P<0.05),与淋巴结转移相关,而与年龄无关(P>0.05),见表1。
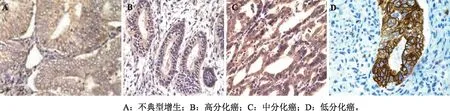
图1 Vimentin在不典型增生和子宫内膜腺癌组织中的表达(SP,×400)

图2 Suivivin在不典型增生和子宫内膜腺癌组织中的表达(SP,×400)
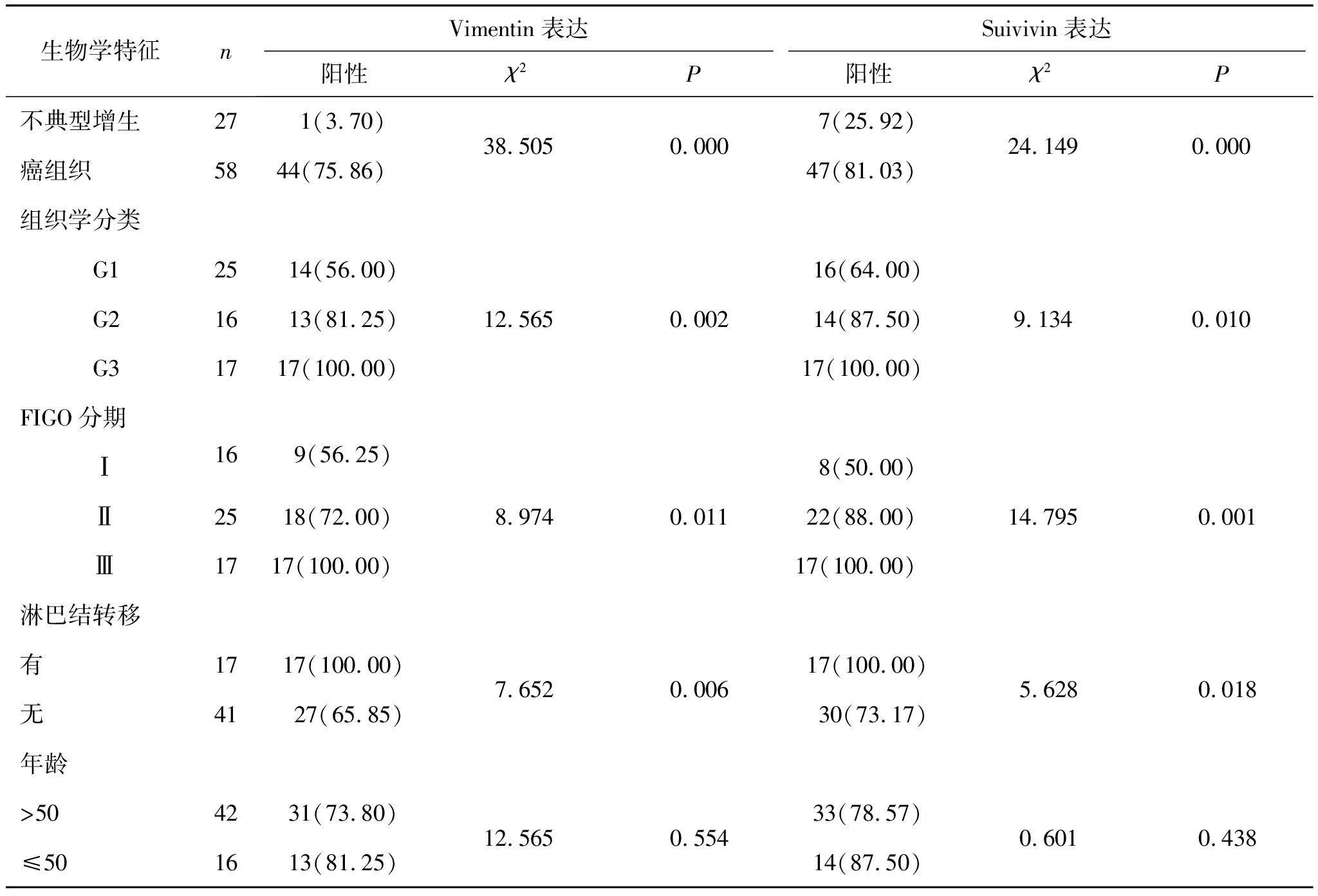
表1 Vimenitin和Suivivin在子宫内膜腺癌中的表达及临床生物学特性例(%)
2.3Vimentin蛋白和Suivivin蛋白在子宫内膜腺癌中表达的相关性在58例子宫内膜腺癌组织中,Vimentin和Suivivin在子宫内膜腺癌中的表达呈正相关(P>0.05),见表2。
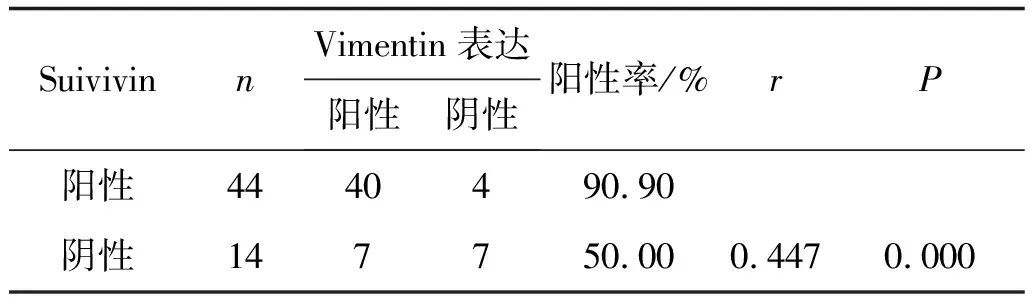
表2 Vimentin和Suivivin在子宫内膜腺癌中表达的相关性
2.4Vimentin和Suivivin的表达与预后分析将Vimentin和Suivivin的表达分为阳性组和阴性组,绘制了Kaplan-Meier生存曲线,Vimentin表达阳性组与阴性组相比较,差异有统计学意义(χ2=8.514,P<0.05)。Suivivin表达阳性组与阴性组相比较,差异有统计学意义(χ2=5.265,P<0.022),见图3-4。

图3 子宫内膜腺癌Vimentin表达与预后Kaplan-meier分析(P=0.008)

图4 子宫内膜腺癌Suivivin表达与预后Kaplan-meier分析(P=0.040)
3 讨论
子宫内膜癌为妇科常见的恶性肿瘤之一,其中腺癌病理类型占子宫内膜肿瘤的80%~90%,在全球范围内,子宫内膜癌在全球恶性肿瘤中排第六位[5-6]。子宫内膜腺癌发病的确切病因及病理生理机制尚不十分清楚,目前认为缺乏体力活动和肥胖是子宫内膜癌的两个重要的高危因素[7]。然而,肿瘤的发生发展是由多种癌基因、抑癌基因等共同参与,引发细胞增殖与凋亡失衡并长期累积的结果。
Vimentin在乳腺癌、肝癌、胃癌、结直肠癌中表达上调[8-9],并与它们的侵袭转移有关;Suivivin包含一个凋亡蛋白抑制因子家族成员的特征性BIR结构区(baculovirus IAP repeat, BIR ),而且Suivivin的羧基末端的结构域是由一个含有丰富的疏水基团的α-螺旋结构取代锌指结构的蛋白,且与纺锤体上的微管蛋白结合,发挥了凋亡抑制的作用[10]。另外,在BIR结构域中含有对凋亡有重要抑制作用的氨基酸的残基,即Cys84、Trp67 和Pro33。Suivivin可通过残基与caspase-3和caspase-7结合,并抑制其活性。Suivivin基因定位于染色体17q25,长度为14 700 bp,3个内含子、4个主要外显子和3个隐藏外显子(a、b、c)组成,外显子与内含子的比例不同,组成了不同的Suivivin的异构体,在细胞凋亡过程中发挥不同的调节作用[11]。
Suivivin是介导线粒体凋亡途径的重要的凋亡抑制因子,在凋亡的细胞中高度表达,当细胞接收到凋亡信息时,线粒体凋亡途径激活,可诱导大量的Suivivin释放,抑制胱氨酸的天冬氨酸蛋白水解酶介导的线粒体凋亡途径,抑制细胞的凋亡。Suivivin-ptEx2/3和Suivivin-2a等被发现[12-13],并且证实其在细胞凋亡过程中发挥重要的调节作用。有研究提示Suivivin在宫颈癌、肝癌、胃癌、胰腺癌中均表达升高,提示Suivivin过表达促进肿瘤发生发展。在大部分恶性肿瘤内Suivivin的表达均上调,然而抑制Suivivin能激活细胞的线粒体凋亡途径,从而诱导肿瘤细胞的凋亡[14]。因此,Suivivin蛋白为肿瘤治疗研究的新靶点提供理论依据。
在子宫内膜腺癌中,Vimentin和Suivivin的表达均增高,这提示了它们和子宫内膜癌有相关关系,而二者在子宫内膜癌中呈正相关,说明它们在子宫内膜腺癌的发生发展过程中起到协同作用。Vimentin和Suivivin有可能作为子宫内膜腺癌发生发展和预后的临床诊断指标,并为子宫内膜腺癌的靶向治疗提供信息,而且为子宫内膜腺癌的预后和复发提供理论依据。

