永川毛霉型豆豉在发酵过程中菌群动态变化规律
曾涛,罗沈斌,索化夷,2*
(1.西南大学 食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
豆豉属于我国的传统发酵豆制品。豆豉能产生多种功能活性物质[1-4],具有降血压[5-7]、抗氧化[8-11]、抗肿瘤等功效[12,13]。重庆永川豆豉属于毛霉型豆豉,采用开放式制曲,发酵过程有多种微生物的参与。真菌(细菌)菌落的构成和其动态变化是豆豉发酵正向进行的微生物基础,因此,研究豆豉发酵过程菌群动态变化是非常必要的。目前PCR-DGGE技术已经被广泛应用于各种豆豉菌群结构的研究中[14-19]。Chen C等[20]采用PCR-DGGE技术对不同品牌、不同产地的成品豆豉的菌群结构进行了研究,发现分别以总状毛霉、米曲霉和根霉为核心真菌的豆豉;嗜盐四联球菌和枯草芽孢杆菌是豆豉中的常见细菌菌株。Chen等[21]也采用PCR-DGGE技术研究了江西稻香园豆豉后发酵阶段的细菌和真菌群落的动态变化。嗜热解淀粉芽孢杆菌、乳酸乳球菌以及枯草芽孢杆菌为优势细菌菌株;在真菌水平上,米曲霉占绝对优势,并有多种酵母参与后发酵。Chen等[22]研究发现稻香园豆豉表面和深层发酵的豆豉的菌群结构是不一致的。而目前关于重庆永川豆豉发酵过程中菌落动态变化的研究还比较少见。
1 材料与方法
1.1 材料与试剂
制曲阶段的曲料:采集于永川豆豉厂,并采集添加了辅料(白酒、食盐、醪糟)的豆豉曲料,在实验中进行后发酵取样;Soil DNA Kit试剂盒、质粒小提试剂盒、2×Taq PCR MasterMix试剂:购于北京索莱宝生物科技有限公司;丙烯酰胺和甲叉双丙烯酰胺:于Sigma公司;T4连接试剂盒、Top10感受态细胞以及pLB零背景快速克隆试剂盒:购于北京天根生物有限公司。
1.2 豆豉的制作[23]
永川毛霉型豆豉的工艺流程:
筛选优质黄豆→浸泡→沥干水→常压蒸料→冷却→摊放在簸箕中自然发酵制曲→翻曲→下架→拌料(食盐含量13~14g/100g、醪糟3g/100g、白酒3g/100g)→入罐后发酵→成品豆豉。
取样后存放至-80℃冰箱进行保存。样本编号及对应取样时间见表1。

表1 实验样品及其对应的取样时间Table1 Experimental samples and their relative sampling time
1.3 豆豉发酵过程中微生物区系的测定方法
1.3.1 不同发酵时期的豆豉样品的总DNA提取
按照 Omega Soil DNA Kit试剂盒说明书进行提取。
1.3.2 永川毛霉型豆豉细菌16SrDNA V3区的巢式PCR扩增
以DNA为模板,用16SrRNA V3区通用引物[24-26]:338F(5′-ACT CCT CGG GAG GCA GCA G-3′)及518R(5′-ATT ACC GCG GCT GCT GG-3′),以25μL为体系(1μL模板;引物各1μL;12.5μL 2×Taq PCR MasterMix;9.5μL ddH2O),反应程序:94℃预变性5min,94℃变性50s,55 ℃退火1min,72℃延伸1min,30个循环,72℃延伸5min,进行第1次扩增。以PCR 产物作为模板,用引物338F(5′-ACT CCT CGG GAG GCA GCA G-3′)和 518R(5′-ATT ACC GCG GCT GCT GG-3′),并在引物338F的5′末端加上40bp的GC夹子(CGC CCG CCG CGC GCG GGC GGG GCG GGG GCA CGG GGG G),以50μL反应体系(2μL模板;引物各2μL;25μL 2×Taq PCR MasterMix;19μL ddH2O),采用降落PCR反应程序,94℃预变性5min,94℃变性30s,65~55℃退火30s(每个循环降低0.5℃),72℃延伸30s,20个循环,94℃30s,55℃30s,72 ℃ 30s,8个循环,72℃延伸7min,进行第2次扩增。
1.3.3 永川毛霉型豆豉细菌18SrDNA的巢式PCR扩增
以DNA 作为模板,用18SrRNA 引物[27]:NS1(F)(5′-GTA GTC ATA TGC TTG TCT C-3′)及Fung(R)(5′-ATT CCC CGT TAC CCG TTG-3′),以25μL反应体系(1μL模板;引物各1μL;12.5μL 2×Taq PCR MasterMix;9.5μL ddH2O),采用反应程序:94℃预变性5min,94℃变性50s,55℃退火1min,72℃延伸1min,30个循环,72℃延伸5min,进行第1次扩增。以PCR产物作为模板,用引物NS1(F)(5′-GTA GTC ATA TGC TTG TCT C-3′)及Fung(R)+(5′-ATT CCC CGT TAC CCG TTG-3′),并在引物Fung(R)+的5′末端加上40bp的GC夹子(CGC CCG CCG CGC GCG GGC GGG GCG GGG GCA CGG GGG G),以50μL反应体系(2μL模板;引物2μL;25μL 2×Taq PCR MasterMix;19μL ddH2O),采用降落PCR反应程序:94℃预变性5min,94℃变性30s,65~55℃退火30s(每个循环降低0.5℃),72℃延伸30s,20个循环,94℃30s,55℃30s,72℃30s,8个循环,72℃延伸7min,进行第2次扩增。
1.4 DGGE水平电泳分析
使用聚丙烯酰胺凝胶浓度为8%(丙烯酰胺∶甲叉双丙烯酰胺37.5∶1)进行制胶,细菌采用变性梯度为35%~65%,真菌采用变性梯度为20%~50%,进行DGGE电泳分析。在60℃缓冲液条件下,以130V,6h进行电泳检测。摇床脱色45min后置于紫外光谱检测仪下观察DGGE电泳结果。
1.5 PCR-DGGE切胶以及扩增产物进行克隆
切胶回收后,采用天根生化科技有限公司的pLB零背景快速克隆试剂盒说明书进行克隆。
1.6 质粒检测以及数据分析
待克隆过后的固体平板长出菌落后,挑取单个菌落到加入抗生素的LB液体培养基中,37℃恒温培养24h。培养结束后再按照北京索莱宝科技有限公司的质粒小提试剂盒说明书提取质粒,提取后放在-20℃冰箱保存,并用0.8%琼脂糖凝胶电泳进行检测。电泳检测合格后送到生工生物工程(上海)有限公司进行常规测序分析,将序列结果和NCBI数据库进行比对分析。数据采用Excel 2013进行处理。
2 变性梯度凝胶电泳(DGGE)分析结果
2.1 真菌水平变性梯度凝胶电泳图谱分析
对各发酵阶段的豆豉样品的真菌巢式PCR扩增样品进行DGGE电泳分析,可以切出17条明显的条带,分别编号为1~17,见图1。
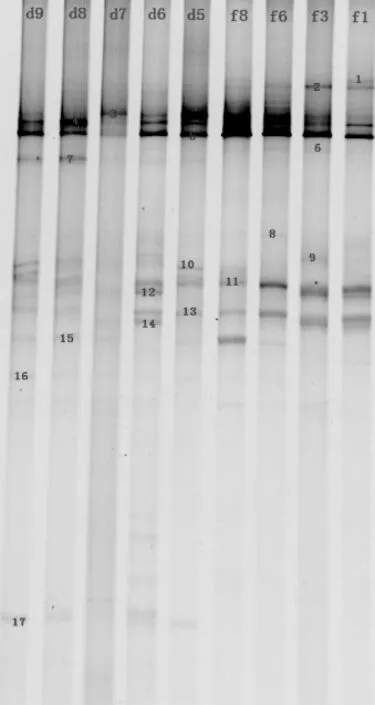
图1 不同豆豉样品中的真菌巢式PCR的DGGE电泳图谱Fig.1 DGGE electrophoretogram grams of nested PCR of fungi in different fermented soya beans samples
各个条带DNA样品经过克隆扩增得到的质粒序列与NCBI数据库进行比对,共得到14种不同的真菌,见表2。
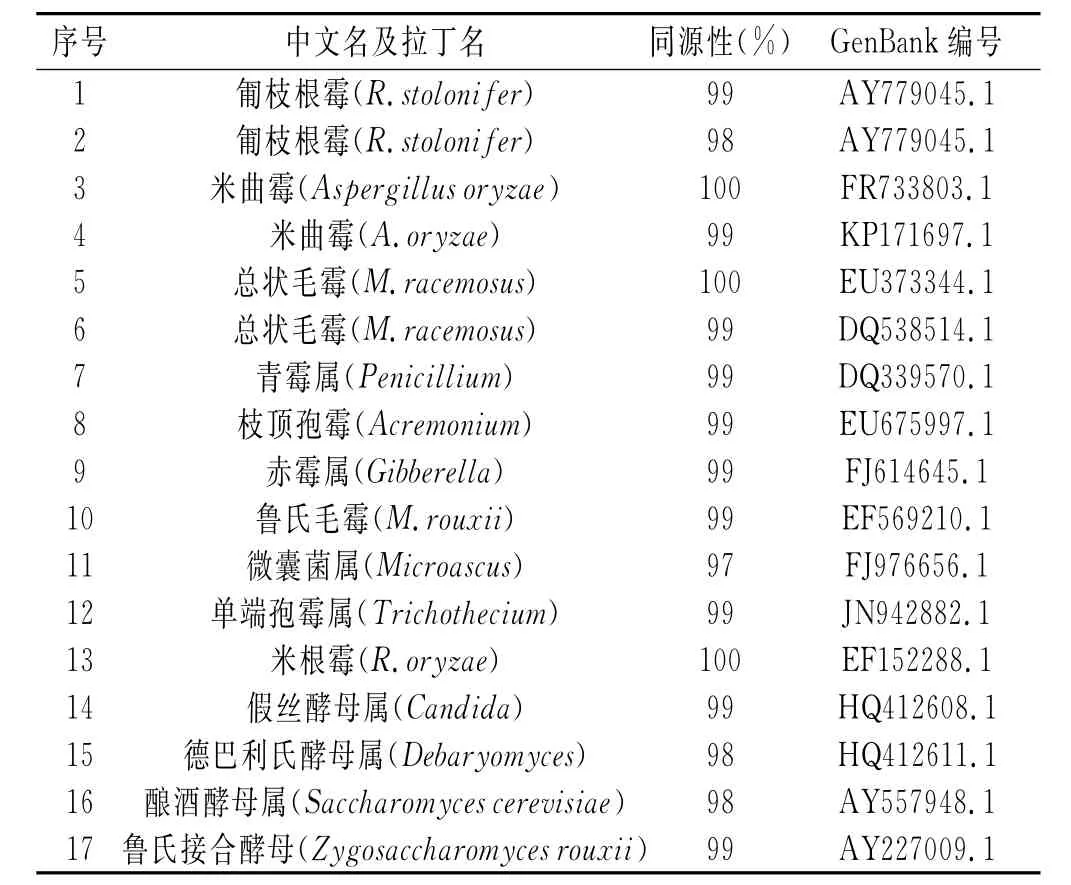
表2 豆豉发酵过程中真菌鉴定结果Table2 Identification results of fungi during fermentation of fermented soya beans
由图1可知,永川豆豉制曲阶段占主导地位的真菌是总状毛霉,此外,米曲霉、米根霉、匍枝根霉也辅助发酵。由于辅料的添加以及入罐发酵的缺氧环境,后发酵时期优势真菌菌株的丰度均下降。总状毛霉、米根霉等真菌具有产生蛋白酶、脂肪酶、糖化酶等多种酶系的能力[28],降解大分子的糖类和蛋白质,促进发酵的正向进行,为后发酵阶段的酵母和乳酸菌的生长提供了营养素。因此,后发酵阶段有一些耐盐的酵母参与发酵,如假丝酵母、德巴利氏酵母、酿酒酵母、鲁氏接合酵母等。酵母对成品豆豉中芳香物质的产生有重要影响,其生长和脂类、有机酸类形成密切相关。另外,发酵过程出现少量真菌类杂菌,如青霉属和赤霉属等。这表明永川毛霉型豆豉的开放式制曲发酵方式有杂菌引入的安全隐患。
2.2 细菌水平变性梯度凝胶电泳图谱分析
对各发酵阶段的豆豉样品的细菌巢式PCR扩增样品进行DGGE电泳检测,有23条明显条带,编号为1~23,见图2。

图2 不同豆豉样品中的细菌巢式PCR的DGGE电泳图谱Fig.2 DGGE electrophoretogram of nested PCR of bacteria in different fermented soya beans samples
经过克隆、测序、比对,共得到23株不同的细菌,具体见表3。

表3 豆豉发酵过程中细菌鉴定结果Table3 Bacterial identification results of fermented soya beans during fermentation

续 表
由图2可知,整体上后发酵阶段细菌群落结构的复杂程度更高一些。在制曲阶段,生长旺盛的真菌产生大量酶,降解大豆中大分子的营养素,促进后发酵中乳酸菌类的生长。永川毛霉型豆豉制曲阶段占主导优势的细菌是乳酸乳球菌,由于辅料的添加,其在后发酵阶段后期几乎消失;后发酵阶段主要由魏斯氏菌、乳杆菌属、明串珠菌、枯草芽孢杆菌等共同参与。由于大量的乳酸菌的繁殖,产生的乳酸可以抑制一些杂菌的生长和真菌毒素的产生。另外,随着发酵的进行,pH下降,酸化是风味形成的重要前提条件。枯草芽孢杆菌具有产生蛋白酶的能力,可以有效促进发酵的正向进行。另外,后发酵阶段还出现了大豆中常见的根瘤菌和慢生根瘤菌。同样地,豆豉在发酵过程中出现了费格森埃希菌、新鞘脂菌等细菌类杂菌[29]。
3 结论
永川豆豉制曲阶段总状毛霉(M.racemosus)一直占据绝对的优势,同时还有匍枝根霉(R.stolonifer)、米根霉(R.oryzae)、米曲霉(A.oryzae)等常见工业真菌辅助发酵。后发酵阶段有假丝酵母(Candida)、酿酒酵母(S.cerevisiae)、鲁 氏 接 合 酵 母 (Zygosaccharomyces rouxii)、德巴利氏酵母(Debaryomyces)多种酵母参与发酵。参与后发酵的酵母种类和稻香园豆豉菌群研究结果基本一致。在细菌水平上,制曲阶段乳酸乳球菌(L.lactis)占优势,而拌料后急剧减少,枯草芽孢杆菌(B.subtilis)等耐盐性强的菌株成为优势菌株。永川豆豉鲜香味美、入口即化的优良品质是由整个发酵期真菌菌落和细菌群落共同的协作结果。发酵过程中也出现了青霉(Penicillium)、费格森埃希菌(Escherichia fergusonii)、新鞘脂菌(Novo sphingobium)等杂菌,说明可能是原料或者环境中的杂菌被携带进入发酵过程。

