沉锂反应条件对碳酸锂纯度及杂质影响的研究
尹记帅,孙文亮,郝如斯,王 晓
(青海大学化工学院,青海西宁810016)
碳酸锂是制备多种锂化合物的原料,在锂盐产品中用途最广[1]。按原料来源的不同,碳酸锂的生产可分为盐湖卤水提取和矿石提取[2]。矿石提取工艺成熟,但能耗高、污染严重、成本高。盐湖卤水提锂,碳酸锂含量高、成本低,但技术难度大,尤其是制备电池级碳酸锂。从盐湖卤水中提锂制备电池级碳酸锂将是未来主要的研究方向[3]。
目前碳酸锂产品的类别大致可分为工业级碳酸锂(纯度≥98.5%)、电池级碳酸锂(纯度≥99.5%)和高纯级碳酸锂(纯度≥99.9%)。电池级碳酸锂虽然应用广泛,但制备技术还需要提高。盐湖提锂的方法主要有溶剂萃取法、吸附法、煅烧浸取法和沉淀法[4]。在这些方法中,沉锂工序是生产碳酸锂的最后工序也是最重要的工序[5],而沉锂过程生产工艺单一且研究较少[6]。碳酸钠与富锂卤水中的氯化锂在适宜条件下反应,由于碳酸锂具有逆溶解度特性,温度升高其溶解度降低,从而使碳酸锂结晶析出。富锂卤水经过浓缩后已经达到氯化钠饱和,锂浓缩液中存在氯化钠微晶[7];碳酸钠溶液在输送过程中会降温,易造成碳酸钠微晶出现。两种溶液在沉锂反应过程中,在碳酸锂晶体中包裹了氯化钠微晶与碳酸钠微晶,这种现象就是包晶。包晶会导致碳酸锂中钠和氯含量升高,使碳酸锂的纯度降低。笔者拟通过对青海盐湖佛照蓝科锂业股份有限公司(简称蓝科锂业)提供的富锂卤水与碳酸钠的反应过程进行研究,优化反应条件,以减轻包晶现象,提高Li2CO3纯度,减少杂质含量,最终实现电池级碳酸锂的生产。
1 实验部分
1.1 试剂和仪器
试剂:无水碳酸钠(分析纯),富锂卤水[蓝科锂业提供:ρ(Li+)=17.376g/L,ρ(Na+)=25.654 g/L,ρ(Mg+)=0.22 mg/L,ρ(B)=110.40 mg/L,ρ(Cl-)=90.17 g/L],邻苯二甲酸氢钾(基准级),氯化钾(基准级),无水碳酸钠(基准级)。
仪器:DF-101S集热式恒温磁力搅拌器,电动强力搅拌机,TAS-990原子吸收分光光度计,UPDI-20T纯水机,电子天平,WJL-602激光粒度分析仪,JSM-6610LV扫描电子显微镜。
1.2 实验方法
配制一定浓度的碳酸钠溶液;在三口烧瓶内加入氯化锂母液。用蠕动泵以固定的流量向三口烧瓶内加入碳酸钠溶液,控制进料时间为30 min,反应总体积为400 mL。加料结束后保持原有的温度和搅拌转速继续反应30 min。将反应后得到的悬浮液迅速取出,用沸水洗涤3次,用抽滤泵抽滤。得到的样品在电热恒温干燥箱中在250~260℃下干燥5 h取出,放入干燥皿内。
采用单因素实验,分别以反应温度、碳酸钠浓度、加料方式、搅拌转速、碳酸钠加入量为变量进行反应,考察各因素对碳酸锂纯度和杂质含量以及产品粒度的影响。由于在前期工序中基本除去了其他干扰离子(如钙离子等),而包晶现象的产生主要是由于氯化钠微晶包裹在碳酸锂晶体内,所以选择测定钠、氯含量来考察反应条件对沉锂过程中包晶现象的影响;另外选择测定镁、硼含量来考察反应条件对其他杂质含量的影响。
1.3 纯度及杂质含量检测方法
纯度及杂质含量的检测方法取自GB/T 23853—2009《卤水碳酸锂》,略有改动。
1)主含量的测定。称取约0.6 g已于250~260℃干燥至质量恒定的试样(精确到0.000 2 g),置于锥形瓶中,加入50 mL无二氧化碳的水,加入10滴溴甲酚绿-甲基红混合指示液,用盐酸标准溶液滴定至溶液由绿色变为暗红色,煮沸2 min,冷却后继续滴定至暗红色为终点。同时做空白实验。碳酸锂纯度按下式计算:

式中:c为盐酸标准滴定溶液的浓度,mol/L;V1为滴定试样溶液消耗盐酸标准滴定溶液的体积,mL;V0为滴定空白试样消耗盐酸标准滴定溶液的体积,mL;m为试样质量,g;M为1/2倍碳酸锂的摩尔质量,36.94 g/mol。
2)钠含量的测定。称取约10 g试样置于烧杯中,用适量水润湿,加盖表面皿后缓慢滴加浓硝酸溶液,直至完全溶解,溶液呈透明状,定容至250 mL。稀释10倍(取5mL,加入1.5 mL质量分数为1%的氯化铯,定容至50 mL)。同时制备空白实验溶液。采用原子吸收分光光度计 (于波长为589.0 nm处用水调零),测定实验溶液和空白实验溶液的吸光度,计算实验溶液中钠离子的浓度。
3)镁含量的测定。称取约10 g试样置于烧杯中,用适量水润湿,加盖表面皿后缓慢滴加浓硝酸溶液,直至完全溶解,溶液呈透明状,定容至250 mL。稀释5倍(取10 mL,定容至50 mL)。同时制备空白实验溶液。采用原子吸收分光光度计(于波长为285.2nm处用水调零),测定实验溶液和空白实验溶液的吸光度,计算实验溶液中镁离子的浓度。
4)硼含量的测定。称取约10 g试样置于烧杯中,用适量水润湿,加盖表面皿后缓慢滴加浓硝酸溶液,直至完全溶解,溶液呈透明状,定容至250 mL。取50 mL于三角瓶中,加热煮沸,冷却后加入2~3滴甲基红,溶液呈红色,用质量分数为20%的NaOH溶液调至亮黄色,用3∶47的硝酸溶液调至红色,用0.1 mol/L的NaOH标准溶液再次调至亮黄色(不计数),加入2~3滴酚酞,加入1 g左右的甘露醇,溶液又呈红色,用0.1 mol/L的NaOH标准溶液滴定(计数)溶液由红色变为亮黄色,亮黄色再变为红色,再加1 g左右的甘露醇,不返色即为终点。硼含量(以硼的质量分数计)按下式计算:

式中:c为 NaOH标准溶液的浓度,mol/L;V为消耗NaOH标准溶液的体积,mL;m为试样质量,g;M为硼的摩尔质量,10.811 g/mol。
5)氯含量的测定。称取约10g试样置于烧杯中,用适量水润湿,加盖表面皿后缓慢滴加浓硝酸溶液,直至完全溶解,溶液呈透明状,定容至250 mL。取50 mL于三角瓶中,加入2~3滴溴酚蓝溶液,溶液呈浅蓝色。用质量分数为20%的NaOH溶液调至蓝色,用3∶47的硝酸溶液调至黄色,硝酸多加4~5滴,加入二苯偶氮碳酰肼1 mL,用0.01 mol/L的硝酸汞标准溶液滴定至黄色变为紫红色。氯含量按下式计算:

式中:c为硝酸汞标准溶液的浓度,mol/L;V为消耗硝酸汞标准溶液的体积,mL;m为试样质量,g;M为氯的摩尔质量,35.45 g/mol。
1.4 粒径分布和扫描电镜测定
选用WJL-602激光粒度分析仪测定试样的粒度。选用JSM-6610LV扫描电镜观察样品的形貌。由于碳酸锂不导电,为防止样品累积负电荷,要在样品表面进行喷金操作。
2 实验结果与讨论
2.1 反应温度对碳酸锂的影响
固定条件:碳酸钠溶液质量浓度为250 g/L,反应温度为80℃,搅拌转速为400 r/min,碳酸钠加入量为110%,正向加料。改变其中一个条件,固定其他条件,考察各因素对碳酸锂纯度和粒度的影响。
表1为不同反应温度制备碳酸锂的纯度及杂质含量;图1为不同反应温度制备碳酸锂的粒径分布图。由表1可见,反应温度对碳酸锂纯度的影响比较显著。随着温度升高碳酸锂纯度有所升高,在80、90℃时碳酸锂纯度分别达到99.52%、99.50%,而钠、氯含量有所减少,镁、硼含量则无明显变化。
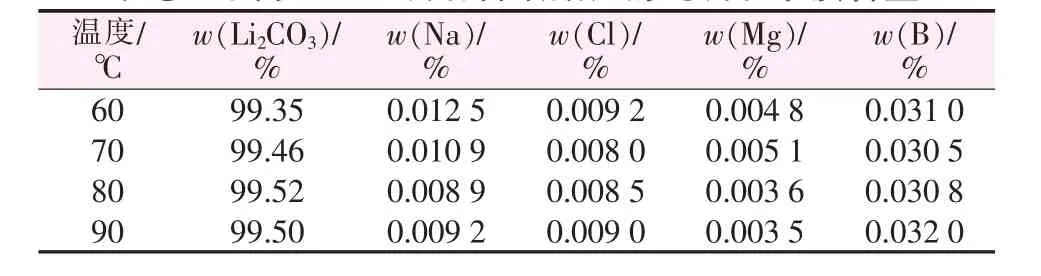
表1 不同反应温度制备碳酸锂的纯度和杂质含量

图1 不同反应温度制备碳酸锂的粒径分布图
由图1看出,80℃时产品的平均粒径为24.79μm,60℃时平均粒径为37.31 μm。80℃时产品的最大粒径为 95.91 μm,60℃时最大粒径为 405.87 μm。所以80℃相对于60℃所得产品更加均匀,而且平均粒径较小。

图2 不同反应温度制备碳酸锂的SEM照片
图2为60℃和80℃制备碳酸锂的SEM照片。从图2看出,60℃制备的样品颗粒较大,团聚较为严重[8],有包晶现象;80 ℃制备的样品颗粒较小,聚结现象有所减轻。造成上述现象的原因可能是,在较低温度时碳酸锂过饱和度较高,易形成片状或块状晶体,片状结构更容易夹带杂质,产生包晶现象;而较高温度时则形成棒状晶体,棒状结构会减轻包晶现象。因此,选择较高的反应温度有利于减轻包晶现象。
2.2 碳酸钠质量浓度对碳酸锂的影响
表2为不同碳酸钠质量浓度制备碳酸锂的纯度和杂质含量。由表2看出,随着碳酸钠质量浓度升高,产品主含量逐渐升高,氯和硼的含量则没有明显变化;在碳酸钠质量浓度为250 g/L和300 g/L时,产品主含量较高,均达到99.5%以上。造成上述现象的原因可能是,因为碳酸钠浓度过低,导致碳酸锂初级成核的量增加,使得碳酸锂过饱和度增加,碳酸锂晶体表面能增大,晶体更易聚结,更易产生包晶现象,从而夹带氯化钠杂质,使碳酸锂的纯度降低,因而应选择较高浓度的碳酸钠溶液进行反应。由于碳酸钠溶液质量浓度为300 g/L时更易结晶,因此选择碳酸钠溶液质量浓度为250 g/L。

表2 不同碳酸钠质量浓度制备碳酸锂的纯度和杂质含量
2.3 加料方式对碳酸锂的影响
表3为不同加料方式制备碳酸锂的纯度和杂质含量。加料方式分为正向加料、反向加料、同时加料和一次性加料。碳酸钠溶液加入富锂卤水中为正向加料;富锂卤水加入碳酸钠溶液中为反向加料;碳酸钠溶液和富锂卤水同时连续加入为同时加料;碳酸钠溶液和富锂卤水一次性加入为一次性加料。由表3看出,正向加料和反向加料制备碳酸锂的纯度都在99.5%左右,由此可见正向加料和反向加料制备碳酸锂的纯度较高且差异较小;而同时加料和一次性加料制备碳酸锂的纯度较低。造成上述现象的原因可能是,一次性加料和同时加料与正向加料和反向加料相比过饱和度增加,更易产生片状或块状晶体,导致包晶现象的产生,使NaCl更容易夹杂在晶体里面,从而钠、氯含量升高,镁、硼含量并无明显变化。

表3 不同加料方式制备碳酸锂的纯度和杂质含量
2.4 搅拌转速对碳酸锂的影响
表4为不同搅拌转速制备碳酸锂的纯度和杂质含量。由表4看出,搅拌转速为400 r/min时产品的纯度为99.56%,达到最高,同时钠、氯含量相对较低,硼、镁含量则无明显变化。
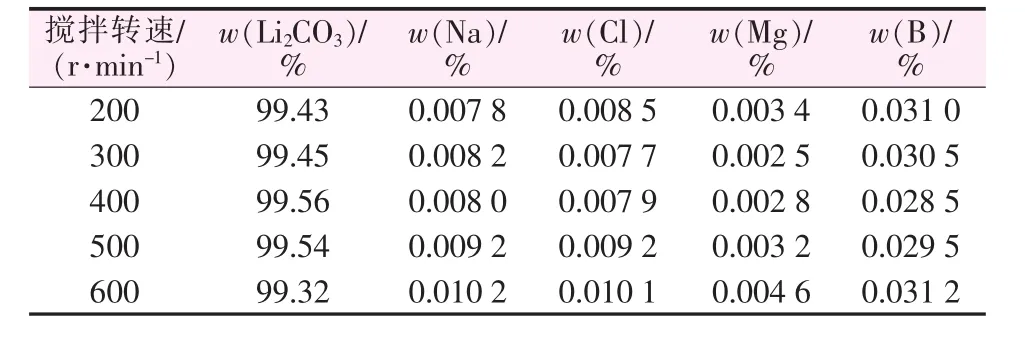
表4 不同搅拌转速制备碳酸锂的纯度和杂质含量
图3为不同搅拌转速制备碳酸锂的粒径分布图。由图3看出,400 r/min时碳酸锂的平均粒径为27.27 μm,最大粒径为 104.96 μm;600 r/min 时碳酸锂的平均粒径为33.61 μm,最大粒径为125.70 μm。400 r/min制备碳酸锂的平均粒径稍小于600 r/min制备碳酸锂的平均粒径,且粒径分布更均匀。

图3 不同搅拌转速制备碳酸锂的粒径分布图
图4为不同搅拌转速制备碳酸锂的SEM照片。由图4可知,搅拌转速为400 r/min时晶体较为完整,晶体聚结现象较轻;而搅拌转速为600 r/min时晶体被破碎,晶体聚结现象较为严重。造成上述现象的原因可能是,搅拌转速较低时反应不充分,晶体在反应体系中混合不均匀,从而导致杂质含量过高;而搅拌转速过高时,容易把晶体打碎,使其表面能增加,从而更易导致晶体聚结,更易夹带氯化钠杂质,产生包晶现象,使碳酸锂的纯度降低。综合考虑,选择搅拌转速为400 r/min。

图4 不同搅拌转速制备碳酸锂的SEM照片
2.5 碳酸钠加入量对碳酸锂的影响
表5为不同碳酸钠加入量制备碳酸锂的纯度和杂质含量。由表5看出,随着碳酸钠加入量的改变,碳酸锂的纯度并无较大差别,杂质含量也没有出现明显的变化。在碳酸钠加入量为100%之前,随着碳酸钠加入量的增加,碳酸锂的纯度略有降低。综合产品纯度与产率,选择碳酸钠加入量为110%。

表5 不同碳酸钠加入量制备碳酸锂的纯度和杂质含量
3 结论
包晶现象的出现是由于碳酸锂晶体中包裹了碳酸钠微晶与氯化钠微晶,通过检测碳酸锂的纯度及杂质含量,以及测定碳酸锂的粒径分布和观察SEM照片,可以更准确地分析各反应条件与包晶现象的关系。通过控制反应温度,在较高的温度下进行反应,可以控制碳酸锂晶体的形貌,减轻包晶现象;较低的碳酸钠浓度,导致碳酸锂初级成核的量增加,会使碳酸锂过饱和度显著增加,晶体更容易聚结,产生包晶现象,较高的碳酸钠浓度则会减轻包晶现象;不同的加料方式会导致过饱和度的改变,从而引起晶体形貌的变化,采用正向加料或反向加料可以抑制包晶现象的出现;过高或过低的搅拌转速都会使碳酸锂的纯度降低,选择适中的搅拌转速会使晶体聚结的现象减轻;改变碳酸钠加入量对碳酸锂的纯度并无明显的影响。

