激活Notch信号通路对人滋养细胞氧化应激损伤的影响及机制
任艳芳,姜永杰,张秀玲,姜姗,王玉红
(新乡医学院第一附属医院,河南新乡453000)
子痫前期是妊娠期高血压常见的一种类型,是导致孕产妇及围生儿死亡的一个重要因素。氧化应激学说作为子痫前期的发病学说之一逐渐得到认可[1]。Notch信号通路是一条在进化上高度保守的蛋白通路,可调节细胞的增殖、凋亡、分化、侵袭、黏附等过程[2]。研究显示,Notch信号通路的异常表达参与多种肿瘤的发生发展过程[3,4]。有研究指出,在妊娠各个阶段的胎盘组织中均有Notch家族蛋白表达,子痫前期胎盘组织中Notch神经同源蛋白1前体(Notch1)表达显著降低[5],说明Notch信号通路异常与子痫前期的发生有密切联系。Notch信号通路Notch1及下游靶基因发状分裂相关增强子1(Hes1)可通过调节滋养细胞的增殖、分化、侵袭[6]而影响胎盘形成过程。可溶性血管内皮生长因子受体1(sFlt-1)与子痫前期的血管内皮损伤有密切联系,血管内皮生长因子(VEGF)是新生血管形成的关键性因子。有研究显示,子痫前期患者细胞中sFlt-1和VEGF的表达均明显升高[7,8]。多项研究表明,缺氧/复氧(H/R)可引起滋养细胞氧化应激损伤[9]。2016年10月~2017年7月,我们通过对滋养细胞进行H/R处理,加入Notch信号通路激活剂重组人核因子κB(rhNF-κB),观察其对细胞氧化应激损伤的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 人早孕期绒毛外滋养细胞HTR8/SVneo购自中国科学院细胞库;胎牛血清、RPMI1640培养基购自美国Gibco公司;rhNF-κB购自Promega公司;BCA试剂盒、Annexin Ⅴ-FITC/PI凋亡试剂盒购自碧云天生物技术研究所;Notch1、Hes1、sFlt-1、VEGF抗体均购自美国Abcam公司;流式细胞仪购自美国Becton Dickinson公司。
1.2 细胞培养、分组与处理 向HTR8/SVneo细胞中加入含有10%胎牛血清的RPMI1640细胞培养液,置于37 ℃、5% CO2、95%饱和湿度的恒温培养箱中培养。将细胞分为正常对照组、H/R组和rhNF-κB+H/R组,正常对照组不经特殊处理;H/R组进行H/R处理,先缺氧培养8 h,再常规培养16 h,2个循环,共48 h;rhNF-κB+H/R组先加入1 gsu/mL的rhNF-κB孵育2 h后,再进行H/R处理。各组培养时间均为48 h。
1.3 细胞凋亡检测 采用Annexin-FITC/PI双标记法。取三组细胞,加入胰蛋白酶消化,离心后收集细胞沉淀,按照细胞凋亡试剂盒的操作说明检测各组细胞的凋亡情况。细胞凋亡率=凋亡细胞数/(凋亡细胞数﹢正常细胞数)×100%。
1.4 细胞活性氧簇(ROS)水平检测 实验结束时弃培养液,PBS清洗,加入2′,7′-二氯二氢荧光素黄二乙酸酯(DCFH-DA)探针至10 μmol/L的终浓度,置于37 ℃细胞培养箱中孵育30 min,上流式细胞仪检测,以荧光强度代表细胞内ROS水平。
1.5 细胞中Notch1、Hes1、sFlt-1、VEGF蛋白表达检测 采用Western blotting法。提取三组细胞总蛋白,BCA试剂盒检测蛋白浓度。按照1∶5比例将蛋白样品与上样缓冲液充分混匀后,100 ℃沸水中煮沸变性5 min。每泳道30 μg上样蛋白至SDS-PAGE分离,转移至硝酸纤维素膜,5%脱脂奶粉封闭。分别加入Notch1、Hes1、sFlt-1、VEGF(均按照1∶500稀释)和GAPDH(1∶1 000稀释)一抗,4 ℃过夜。洗膜后加入1∶5 000稀释的HRP标记的羊抗鼠IgG,37 ℃孵育1 h,洗膜后在暗室X片曝光1 min左右,显影、定影后成像拍照。采用Quantity One软件分析目的蛋白及内参蛋白GAPDH的蛋白信号条带灰度值,Image J软件对蛋白信号值进行具体的量化,以目的蛋白与GAPDH蛋白的信号值比值表示目的蛋白的相对表达量。
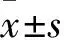
2 结果
2.1 三组细胞凋亡率比较 正常对照组、H/R组和rhNF-κB+H/R组细胞凋亡率分别为1.83%±0.47%、19.46%±1.45%、11.18%±1.21%,H/R组细胞凋亡率高于正常对照组,rhNF-κB+H/R组细胞凋亡率低于H/R组(P均<0.01)。
2.2 三组细胞ROS水平比较 正常对照组、H/R组和rhNF-κB+H/R组DCFH荧光强度分别为105.36±13.81、288.97±18.23、161.14±15.57,H/R组ROS水平高于正常对照组,rhNF-κB+H/R组ROS水平低于H/R组(P均<0.01)。
2.3 三组Notch1、Hes1、sFlt-1、VEGF蛋白表达比较 H/R组Notch1、Hes1蛋白表达低于正常对照组,sFlt-1、VEGF蛋白表达高于正常对照组(P均<0.01);rhNF-κB+H/R组Notch1、Hes1蛋白表达高于H/R组,sFlt-1、VEGF蛋白表达低于H/R组(P均<0.01)。
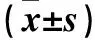
表1 三组Notch1、Hes1、sFlt-1、VEGF蛋白表达比较
注:与正常对照组比较,*P<0.01;与H/R组比较,△P<0.01。
3 讨论
氧化应激是体内的氧化与抗氧化失衡,自由基的产生超过了抗氧化剂的防御能力,从而引起的细胞损伤[10]。不良胎盘的形成是由于子宫胎盘血流灌注不足以及由此引起的缺氧、缺血及氧化应激,造成炎症介质释放、血管内皮细胞受损及中性粒细胞活化,从而导致子痫前期的病理变化,由子宫、胎盘局部发展至全身各系统[11]。滋养细胞担负着营养物质、母-胎间气体、代谢物质的运输交换,具有分泌孕激素、雌激素及多种营养因子的功能,对于妊娠维持及结局有重要作用[12]。因此,缓解和预防滋养细胞的氧化损伤对与正常妊娠有关键作用。
有研究表明,子痫前期患者氧化应激主要由胎盘缺氧引起,氧化应激可引起滋养细胞功能改变[13]。近年研究显示,滋养细胞中一些基因、信号通路的表达异常可能是子痫前期发病的重要原因。Notch信号通路可通过细胞间的相互作用调节组织和细胞的增殖、凋亡、分化等过程。越来越多的研究发现,Notch信号通路异常与一些肿瘤的发生发展及胚胎的发育密切相关。滋养细胞在增殖、侵袭、转移等生物学行为上与肿瘤细胞有很大的相似性,其行为受到高度的空间和时间的调控,而在侵袭过程中则失去增长能力,表现出“假恶性”[5]。Notch家族蛋白在妊娠的各个阶段均有表达,Zhao等[14]报道,子痫前期胎盘组织中Notch1、Hes1表达降低,提示Notch信号通路与子痫前期的发生有关。本研究用H/R及Notch信号通路激活剂处理HTR8/SVneo细胞,检测细胞凋亡情况,结果显示,H/R可增加细胞凋亡率,下调Notch1和Hes1表达,而激活Notch信号通路可降低细胞凋亡率,表明激活Notch信号通路可能减弱子痫前期的发生发展。
近年研究发现,sFlt-1与子痫前期的血管内皮损伤有密切联系,子痫前期患者中sFlt-1表达升高,其血清也有较强的抗血管生成作用[7];氧自由基清除剂可有效抑制胎盘和血清中sFlt-1的产生[15]。对实验大鼠输注sFlt-1可引起与子痫前期相似的血管内皮细胞病变。VEGF是新生血管形成的关键性因子,缺氧诱导的正常妊娠滋养细胞中,VEGF表达显著增加[8],提示滋养细胞的氧化应激可能与sFlt-1、VEGF有关。本研究结果显示,H/R可增加HTR8/SVneo细胞ROS水平及sFlt-1、VEGF蛋白表达,而激活Notch信号通路可降低此作用。
综上所述,激活Notch信号通路可降低氧化应激导致的滋养细胞凋亡,其机制可能与降低细胞ROS水平、sFlt-1、VEGF的表达而发挥细胞保护作用有关。该研究为子痫前期的分子靶向治疗提供了一定的理论基础。

