不同锥切术式在子宫颈高度鳞状上皮内病变中的应用比较
蒋军 王建芬 蒋学禄 张婷 梁月琴*
宫颈上皮内瘤样病变(CIN)作为宫颈癌的前驱病变,美国每年有50万人被诊断患有HSIL(CIN2和CIN3)[1]。根据美国阴道镜和宫颈病理学会指南,CIN1患者由于消退率高,且进展至CIN 2+的情况并不常见,故通常通过继续随访,而HSIL如不治疗可能会发展为浸润性宫颈癌[2]。锥切术是治疗HSIL的标准手术方法,也是希望保持生育力的微小癌患者的保守治疗方式。冷刀电外科手术(环形电切术,电手术刀)或激光均可进行锥切术,且这些方法具有不同的优缺点。本文比较三种不同锥切术治疗HSIL的临床疗效。
1 资料与方法
1.1 临床资料 选择2012年3月至2015年3月本院阴道镜下活检诊断为HSIL的患者。本项目经伦理委员会审查并批准,且豁免书面知情同意要求。根据术式分为冷刀组(CKC),电刀组(EKC)和环切组(LEEP),三组患者手术指征、术后处理、锥切后再处理及随诊原则一致,且在年龄、月经、生育情况及手术时所处月经周期等方面比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法 器械EKC采用美国CONMED 2400,电切及电凝功率均设定为<45W。LEEP 采用美国 ELLman LEEP刀。切除范围根据疾病的级别和程度进行调整,但通常使用3~5mm的宫颈外和宫颈管切除边缘。锥高表示从宫颈内膜管移除的组织的长度,除有生育要求的年轻患者外,需要≥10mm的锥形高度。如转化区不可见或仅部分可见,则进行宫颈刮片(ECC)以排除残余病灶的存在。LEEP使用环形电切环操作。在CKC及EKC患者中则分别使用手术刀或电刀,采用0号Vicryl polyglactin 910缝线在锥形化之后沿圆周缝合剩余的宫颈。
1.3 病理标本制作及固定 锥形标本从12点钟位置的前唇切开,用10%福尔马林固定,并包埋在石蜡中。用苏木精-伊红(HE)染色12个4μm连续切片并检查。手术边缘(宫颈外,宫颈内和深层基质)存在CIN或浸润癌的情况定义为切缘阳性。
1.4 随访 第一次治疗后随访在锥切术后1次/6个月行HPV分型、TCT-DNA联合筛查。记录相关并发症,包括术前和术后出血,持续性阴道分泌物,腹痛,盆
腔疼痛,感染,颈管狭窄引起的闭经等。任何访视时存在异常细胞学或2次连续访视时的HPV阳性状态则行阴道镜检查和宫颈活检。
1.5 观察指标 手术前后HPV感染情况;活检与术后锥切病理;手术的操作时间、出血量;标本锥高、锥宽、切缘情况;术后并发症情况及复发情况。
1.6 统计学方法 病理结果的一致性验证采用Weighted Kappa检验,kappa值>0且≤0.2之间为一致性很差,>0.2且≤0.4之间为一致性一般,>0.4且≤0.6之间为中等一致性,>0.6且≤0.8之间为较好一致性,>0.8且≤1.0之间为一致性非常好,a=0.05。采用T检验进行数据间比较,使用logistic回归分析危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1 不同型别HPV感染分布情况 见表1。2.2 手术前后病理检查结果比较 由取得阴道镜资质的医师专人进行阴道镜下检查和活检(标本数目为1~4个),虽然阴道镜活检诊断CINⅡ的具有一定局限性[3],但活检与锥切标本的中等一致性,提示阴道镜下活检的水平较高。Kappa=0.491(95% CI为0.401~0.580),P<0.01。见表 2。
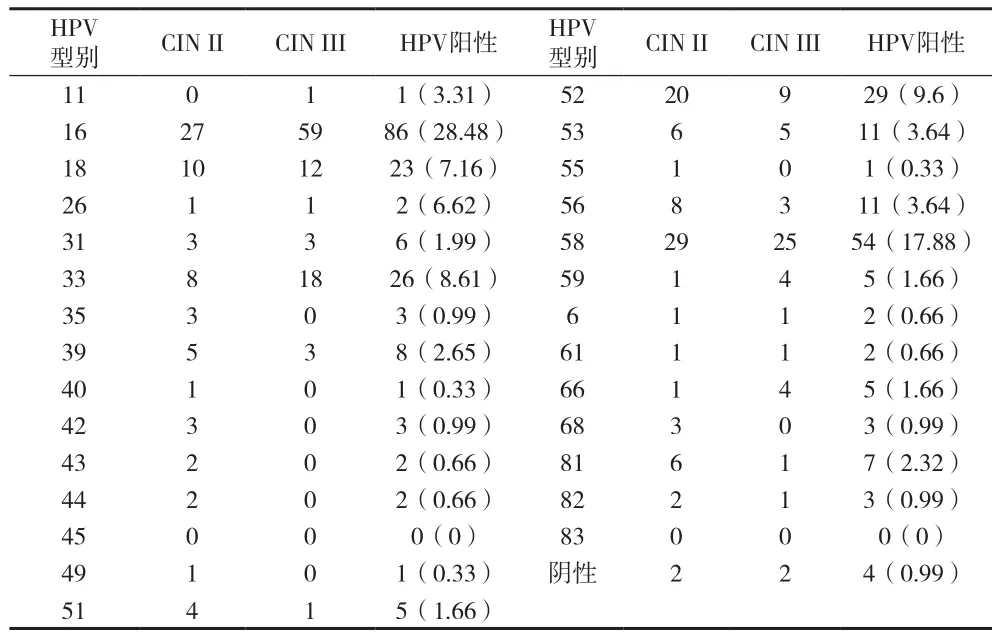
表1 不同型别HPV感染分布情况[n(%)]

表2 手术前后病理检查结果比较
2.3 两组患者术后HPV持续感染情况比较 EKC、CKC组患者高危HPV持续感染率在术后6、12、18个月均低于LEEP组,差异有统计学意义(P<0.05)。见表3。
2.4 三组患者手术情况比较 三组术中出血、手术时间、锥高、切缘阳性、术后复发两两比较,差异有统计学意义(P<0.05或P<0.01)。切缘阳性患者在锥切术后未补充手术治疗,定期随访观察,均未在随访期内复发。见表4。

表3 术后HPV持续感染情况比较(n)
表4 不同宫颈锥切术中及术后情况比较(±s)

表4 不同宫颈锥切术中及术后情况比较(±s)
组别 n 术中出血(ml) 手术时间(min) 锥宽(mm) 锥高(mm) 切缘阳性率[n(%)] 术后出血[n(%)] 创面感染[n(%)] 颈管粘连[n(%)] 术后复发LEEP 68 10.96±7.15 11.47±4.15 23.24±4.38 18.28±2.81 4(5.88) 5(7.35) 1(1.47) 1(1.47) 7 EKC 64 20.23±7.15 21.88±4.91 24.14±3.94 21.11±3.57 1(1.56) 1(1.56) 1(1.56) 1(1.56) 2 CKC 84 53.69±15.76 34.94±8.76 22.98±4.53 20.04±4.00 1(1.19) 2(2.38) 2(2.38) 1(1.19) 3
2.5 切缘阳性或复发的危险因素回归分析 年龄、术式、HPV基因型均与病灶残余或复发无危险相关。年龄>45岁的患者、HPV16/18阳性、LEEP术式为高危因素。见表5。

表5 切缘阳性或复发的危险因素回归分析
3 讨论
随着宫颈筛查的大范围展开,HSIL的数量显著增加。中国人群中的发病率为CINⅡ 1.5%,CINⅢ1.2%[4]。CIN的早期发现和适当管理是预防侵入性疾病进一步发展的有效策略。CKC作为传统锥切手术,通常需要在手术室麻醉下进行,相对手术时间长,术中出血量多。LEEP因其手术时间短,成本低,目前已成为最常用的锥切方式。但在LEEP中观察到的切缘受累比CKC更常见,并可能导致更大概率的复发和进一步的治疗[5]。
锥切最常见的术后并发症包括出血、感染及宫颈管狭窄。由于电手术刀术中锥形床的凝固通常在去除锥体后进行,因此,围手术期出血较少,且不常见。而晚期出血在结痂期间较常见。由于环扎缝合术在预防早期和晚期出血方面比烧灼术效率更高[6],因此术中出血量LEEP和EKC显著小于CKC,而LEEP术后晚期出血发生率大于另外两种术式。宫颈管狭窄是一种特别重要的并发症,可导致痛经,闭经和不孕。锥切术后的宫颈管狭窄也会增加细胞学检查假阴性结果及不满意的阴道镜检查。文献报道宫颈管狭窄的发生率从1%~15%[7]。由于锥切术后只有出现子宫积血和继发性闭经的患者被认为有宫颈管狭窄,但部分患者临床表现不典型,同时也缺乏阴道镜或三维B超证据来确认宫颈管是否存在轻度阻塞及异常。因此,宫颈管狭窄的发病率可能被低估。这也解释为何这项指标在这三种术式中未见明显差异,当然可能还和样本数目过少有关。
术后锥体标本中的边缘受累表明子宫颈残留疾病的可能性,并影响后续和再次手术的决策。边缘受累被认为是疾病复发和进展的最重要预测因子之一[8]。已经证实,锥切深度<10mm可能是预测宫颈管内切除边缘的危险因素和最佳预测因素[1],在本资料中,分别有2.94%、1.56%、1.19%的患者出现阳性手术切缘,均显著低于其他研究报道的水平[8-9]。这些较低的患病率可能由EKC和CKC技术的相似性及术中切除>10mm的锥高。对于宫颈原位腺癌,18%的CKC患者与40%的LEEP治疗的女性中发现阳性切缘[10]。这一发现可能归因于CKC比LEEP更深切除病灶。如实现阴性切缘是唯一的考虑因素,可能不推荐使用LEEP,尤其是对于老年妇女[11]。术前HPV16感染是残留/复发性HSIL的高危因素,术后持续性HPV感染是LEEP术后残留/复发HSIL的重要危险因素[12]。本资料LEEP组持续感染率在6个月时为27.9%,12个月时为16.2%,18个月时为10.3%,与Pirtea等[12]报道相一致。本资料中三组高危型HPV持续感染均较手术前明显下降,而EKC组、CKC组高危HPV的持续感染率低于LEEP组,但切缘阳性率及复发率LEEP组高于另两组。多因素回归分析指出年龄(>45岁),HPV高危型感染,LEEP术式是切缘阳性/复发的高危因素,提示HSIL治疗选择要依据患者年龄、生育要求、病灶的范围、病毒感染情况等综合考虑[1,7,12]。
Meta分析发现有CKC治疗病史的女性与有LEEP治疗史的患者比较早产风险增加。与CKC比较,LEEP更适合未来妊娠的CIN患者。但有关LEEP和CKC疗效差异的研究证据不足[12]。研究表明EKC是诊断和治疗CIN的替代技术,复发率和并发症的发生率相对较低。需进一步观察更多的病例以揭示EKC手术对不孕和产科结局的影响。

