脓毒症大鼠不同时点缺氧性肝损伤病理生理学特点及乌司他丁的保护作用
丁磊,龚一航,邹宝嘉,刘夏磊,张百萌,李坚
(中山大学附属第五医院,广东珠海519000)
脓毒症是由各种感染引起的生理、病理和生化紊乱综合征[1],常伴肝脏及其他靶器官损伤,低心排出量综合征和感染性休克可能是引起缺血性肝炎(HH)的主要原因[2]。到目前为止,HH相关脓毒症的机制未完全阐明,尚无标准、稳定的肝细胞缺氧动物模型以供研究。乌司他丁(UTI)作为常见的抑制急性炎症药物,已广泛用于临床,但很少有研究关注脓毒症大鼠多时间点肝功能变化、病理生理学特征及UTI作用。2017年1~11月,本研究通过盲肠结扎穿刺(CLP)制备脓毒症大鼠肝损伤模型,探讨CLP后不同时期肝损伤和HH的病理生理特点,同时评估UTI在此过程中对大鼠的保护作用。
1 材料与方法
1.1 动物、试剂及仪器 雄性SD大鼠175只,20~22周龄,体质量380~420 g,由中山大学动物实验中心提供。记录MAP的监护仪UT4000F prosystem购自美国Philips公司,血气分析仪ABL 80 FLEX购自美国Radiometer公司,血气分析试剂盒ABL 80 SC80购自美国Radiometer公司,TRIzol、Oligo(DT)购自日本Takara公司,逆转录仪器Applied Biosystems Veriti Thermal Cycler购自美国Foster公司,cDNA引物由美国Invitrogen/Life Technologies公司设计,原代兔Hif-1α及小鼠β-actin购自美国ABclonal公司,抗小鼠IgG和抗兔IgG购自美国Cell Signaling Technology,全自动发光荧光系统购自中国Tanon公司,免疫组化试剂盒购自中国迈新公司,Hif-1α抗体购自中国Bioss公司,DAB购自美国Solarbio公司,测定ALT的试剂盒购自美国Cayman Chemical,测定AST的试剂盒购自美国BioVision公司,测定IL-6和TNF-α的试剂盒购自美国eBioscience公司,酶标仪iMark Microplate Reader购自美国Bio-Rad Laboratoriesm公司。
1.2 动物分组及模型制备 将175只SD大鼠随机分为Sham组25只、Sham+UTI组25只、CLP组75只及CLP+UTI组50只,每组根据实验持续时间(12、24、36、48和72 h)平均分为5个亚组,Sham组、Sham+UTI组各时间点5只大鼠,CLP组各时间点15只大鼠,CLP+UTI组各时间点10只大鼠。CLP组及CLP+UTI组参照文献[3]方法进行CLP手术。腹腔注射戊巴比妥(60 mg/kg)麻醉,行左侧股动脉置管,深度8 cm。动脉搏动稳定后,连接换能器记录基线MAP,抽取血液0.2 mL进行动脉血气分析。正中开腹暴露盲肠,挤压盲肠以保证肠内容物分布均匀,4号丝线结扎约75%盲肠,18号针穿刺盲肠2次并挤出少量肠内容物。术中使用电热毯和红外线灯保持大鼠直肠温度(36.5±0.5)℃。Sham组及Sham+UTI组仅行麻醉和开腹手术,并牵拉盲肠,但不进行盲肠结扎和穿孔术。所有实验大鼠分层缝合关腹,并记录实验时间为T0,关腹后立即皮下注射温生理盐水(5 mL/kg)液体复苏。Sham+UTI组及CLP+UTI组于T0时点腹腔内注射UTI 3 000 U/kg,后每12 h重复1次,直到实验结束或大鼠死亡。大鼠复苏返笼恢复进水,6 h后恢复进食。实验过程中,175只大鼠参加试验,死亡31只,其中CLP组死亡23只,CLP+UTI组死亡8只,共144只大鼠完成实验。
1.3 脓毒症一般情况评估、血气分析及组织取材 术后分笼观察大鼠,由2名研究者在各亚组时间点(12、24、36、48和72 h)用脓毒症评分(MSS)[4]独立评估,评估内容包括大鼠毛发、外观、意识水平、活动程度、对刺激的反应、眼睛开合情况及呼吸状况,对以上指标分别打分,分值越高说明大鼠总体状况越差。研究者独立评分后麻醉固定大鼠,体温计插入大鼠直肠1 cm测量肛温,右侧股动脉置管测定大鼠血压,原切口开腹,离断肝圆韧带及三角韧带,暴露肝上下腔静脉,取肝上下腔静脉及股动脉导管(胸主动脉)血0.2 mL分别进行血气分析,记录动脉血pH、动脉氧分压(PaO2)、静脉氧分压(PvO2)、动脉血乳酸(Lac),用PaO2-PvO2计算动静脉分压差(APDD);开放动脉导管,留取大鼠动脉血约3 mL后予颈脱位法处死大鼠。快速解剖肝组织,部分标本固定于10%甲醛溶液中,4 ℃保存,部分标本置于冻存管,液氮保存。血液标本置于促凝管中,静置2 h后在1 000 g环境下离心15 min,取上清液置于冻存管中,保存于液氮中。
1.4 血清学指标检测 ELISA法检测血清ALT、AST、IL-6和TNF-α。严格按试剂盒说明操作。
1.5 HE染色观察 肝组织标本常规固定包埋切片,厚度10 μm。二甲苯脱蜡,梯度乙醇水化后,HE常规染色。显微镜下观察标本细胞损伤程度并用器官损伤程度评分(ODS)表示[5]。
1.6 肝组织Hif-1α基因表达检测 使用RT-PCR技术。TRIzol从大鼠肝组织中分离RNA,取RNA 1 μg逆转录为对应cDNA。Hif-1α正向引物为5′-CGGCGAGAACGAGAAGAAAA-3′,反向引物为5′-GGGGAAGTGGCAACTGATGA-3′。GAPDH作为cDNA内参,正向及反向引物分别为5′-CCTGGAGAACATGGCCAG-3′和5′-CCAGAGAGACACTGGTCC-3′,总反应体系为10 μL,包含50 ng cDNA,5 μL Sybr Green及混合引物1 μL。反应条件:50 ℃ 2 min,95 ℃2 min,共进行40轮PCR扩增,单个循环包括95 ℃ 15 s及60 ℃ 1 min。所有反应均在独立反应管中进行,并重复3次取平均值,采用2-ΔΔCt法计算Hif-1α相对表达量。
1.7 肝组织Hif-1α蛋白表达检测 采用Western blotting法。蛋白裂解液提取肝组织蛋白,BCA法测定蛋白浓度,20 μg蛋电泳分离后转移至PVDF膜。5%脱脂牛奶孵育1 h后,加入一抗:原代兔Hif-1α(5%胎牛血清稀释,1∶2 000)及小鼠β-actin (5%胎牛血清稀释,1∶2 000),4 ℃过夜。5%TBST充分洗涤后,加入二抗:抗小鼠IgG和抗兔IgG(5%脱脂牛奶稀释,1∶10 000)孵育1 h。在TBST中充分洗脱后,使用Tanon 5200 Multi system检测条带并使用Image J图像分析软件定量分析。
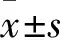
2 结果
2.1 各组大鼠不同时点直肠温度、MAP、MSS评分比较 见表1。
2.2 各组血气分析指标比较 见表2。
2.3 各组血清学检测结果比较 见表3。
2.4 各组ODS评分、Hif-1α基因及蛋白表达比较 见表4。
3 讨论
CLP模型目前是脓毒症研究的金标准模型[6],但其病理生理学变化机制尚未阐明。MSS评分可量化大鼠的一般情况,评估大鼠脓毒症进展程度[4]。随着CLP建模时间延长,大鼠MSS逐渐增加,一般状况持续恶化。MAP和Lac水平是评价脓毒症和脓毒症休克的重要指标[7]。CLP后期(36 h后),MAP和Lac变化明显,其原因可能为脓毒症休克早期心输出量增加,后期血管阻力逐渐降低[8]。IL-6和TNF-α与炎症及免疫反应相关,血清IL-6水平与感染性休克的严重程度相关。与Sham组相比,各时间段CLP组大鼠IL-6、TNF-α水平均明显升高,其改变明显早于大鼠生命体征开始变化的时间,提示细胞因子对脓毒症的早期预警作用。
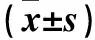
表1 各组大鼠不同时点直肠温度、MAP、MSS评分比较
注:与Sham组相比,*P<0.05,**P<0.01;与CLP组相比,#P<0.05,##P<0.01。
细胞对缺氧环境的适应主要由缺氧诱导因子(HIF)来介导,在富氧环境下,Hif-1α发生羟基化。本研究中大鼠肝组织Hif-1α水平在基因及蛋白层面均随实验时间的延长而升高,在48、72 h达高峰,提示脓毒症后大鼠组织缺氧。HE染色结果显示,CLP大鼠随实验时间延长,组织损伤加重。目前很少有研究着重观察CLP大鼠在多个连续时间点肝缺氧和脓毒症间的联系。Huang等[9]在不同时间点对CLP大鼠肝缺氧进行了研究,但仅使用了2个时间节点(9和18 h)。而引起CLP大鼠肝组织缺氧的原因可能包含大循环障碍和微循环障碍。本研究中,CLP晚期,尤其是48和72 h,大鼠PaO2明显下降,提示组织氧供量绝对不足。APPD可描述氧气的间接利用量,对比Sham组,APPD水平在CLP晚期显著降低,提示氧转运到肝细胞后不能有效利用。CLP后期大鼠PaO2和APPD显著下降,提示全身严重缺氧和肝细胞氧摄取率下降可能是脓毒症下肝缺氧性损伤的主要原因。
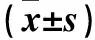
表2 各组血气分析指标比较
注:与Sham组相比,*P<0.05,**P<0.01;与CLP组相比,#P<0.05,##P<0.01。
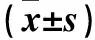
表3 各组大鼠血清AST、ALT、IL-6和TNF-α水平比较
注:与Sham组相比,*P<0.05,**P<0.01;与CLP组相比,#P<0.05,##P<0.01。
UTI是临床上常用的急性炎症反应抑制剂,本研究结果显示,UTI对CLP大鼠具有一定保护作用,对比CLP组,CLP+UTI组大鼠血清炎症因子(TNF-α、IL-6)在CLP后各个时段均明显下降,大鼠的HE染色结果提示UTI对大鼠肝组织缺氧存在保护作用。其机制可能是UTI降低血炎症因子水平,抑制淋巴细胞凋亡[10],抑制超氧自由基生成和脂质过氧化反应,保护内皮细胞等[11]。对比CLP+UTI组和CLP组,仅72 h后CLP+UTI组PaO2和APPD显著改善。UTI对于大鼠脓毒症的进展并无逆转作用,对大鼠宏观生理指标的改善作用有限,并不会改善CLP大鼠转氨酶水平。
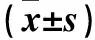
表4 各组ODS评分及Hif-1α基因及蛋白表达比较
注:与Sham组相比,*P<0.05,**P<0.01;与CLP组相比,#P<0.05,##P<0.01。
HH是缺氧性肝损伤的重要形式。研究显示[7],HH患者血清转氨酶水平会出现一过性升高(至少20倍)。本研究中我们发现,CLP大鼠只有72 h时AST水平升高,而其他时点CLP组转氨酶水平无显著变化。其他研究亦观察到CLP大鼠AST升高,而ALT水平不变[12]的现象。本研究认为在转氨酶升高之前,肝组织中已存在低氧。目前HH临床诊断标准(转氨酶升高至正常水平上限20倍以上等)[13]过于严格,不利于早期诊断。当转氨酶水平显著升高时,肝组织缺氧损伤已非常严重。本研究中,相比转氨酶,PaO2和APPD变化在肝组织缺氧早期即有所体现,对于HH早期诊断可能有更重要的价值。
本研究中我们发现,可将CLP大鼠各项指标变化分为两个阶段,即早期CLP(12、24 h)和后期CLP (36、48、72 h)。前者大鼠各项指标平稳,存在组织缺氧但程度有限,后者大鼠生理指标迅速恶化,缺氧明显加重。提示对于CLP诱导的脓毒症大鼠,36 h可能对于炎症爆发是一个重要的时间点,在此之前对炎症进行干预可能至关重要[18]。
综上所述,PaO2降低、肝细胞摄氧量下降可能是引起肝细胞损伤的主要原因。在CLP早期,肝细胞存在缺氧,缺氧的严重程度随感染时间的延长而增加,但转氨酶水平并未同时增加。在CLP晚期(72 h)时AST升高,而在整个研究过程中ALT水平无明显变化。UTI对于脓毒症引起的缺氧性肝损伤有一定保护作用,但不能彻底逆转脓毒症的进展。

