雪松松针多糖超声波酶法提取及其抗氧化性
周思杰,张智红,段久芳,2,蒋建新,2,朱莉伟,2*
1北京林业大学材料科学与技术学院;2林业生物质材料与能源教育部工程研究中心,北京 100083
雪松是松科Pianaceae植物雪松属Cedrus Trew树种的统称,在中国长江流域各大城市广泛种植,被作为城市环境大气污染的指示植物。雪松不仅具有观赏价值,也具有较突出的药用价值,其针叶为13个可供药用的松针之一[1]。松针是松树药用的代表部位,其作为松类植物的主要副产物,具有采收便捷、分布广泛、天然蓄积量大等特点,是一种丰富的天然再生资源。在我国古代就有用松针来治疗疾病的记载,其不但含有丰富的生物黄酮类、挥发油类物质,还富含脂肪酸、叶绿素、维生素等[2]。现代研究表明,松针提取物具有抗炎镇痛、抗氧化、抗惊厥、抗糖尿病、抗癌抑菌等多种药理活性[3,4],其研究开发日益受到重视。随着松针提取物产业的发展,松针药用活性成分在市场上形成了系列产品,但松针醇提后的残渣未得到有效利用,其中含有丰富的植物多糖。
近年来大量研究表明,植物多糖是一种具有多种生理功能和开发价值的活性多糖,对人体有独特的保健功效,许多植物多糖具有提高免疫力、抗肿瘤、抗病毒、抗衰老、抗感染、抗溃疡等多种生理功能[5,6]。目前,已有相关文献研究了松针多糖的提取工艺,葛霞[7]等人采用水提法提取雪松松针多糖,正交优化后最高得率为4.91%;许小向[8,9]等人采用超声波辅助热水浸提火炬松松针多糖,响应面法优化后最高得率为1.87%,采用微波辅助法提取马尾松松针多糖,正交优化后最高得率为2.17%。但使用超声波酶法提取松针多糖工艺的研究以及松针多糖的结构分析还未见报道。
本研究采用超声波酶法从雪松松针中提取多糖,在单因素基础上采用响应面分析法对其提取工艺进行优化,通过现代仪器表征了多糖结构,并测定其体外抗氧化活性,以期为松针多糖的高值化利用提供依据。
1 材料与方法
1.1 材料与试剂
雪松(Cedrusdeodara)松针,4月份采摘于北京林业大学校园内的成年雪松,经北京林业大学林木育种国家工程实验室康向阳教授鉴定。
菠萝蛋白酶(120万 U/g) 南京东恒华道公司;纤维素酶(160 FPU/mL) 诺维信(中国)公司;1,1-二苯基-2-苦基苯肼(DPPH)标准品、葡萄糖、半乳糖、阿拉伯糖、木糖、鼠李糖、果糖、甘露糖标准品 SIGMA公司;半乳糖醛酸标准品 Fluka公司;Bradford蛋白浓度测定试剂盒 北京鼎国昌盛公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BILON-1000CT型多用途恒温超声波提取机,上海比朗公司;UV-6100A型紫外-可见分光光度计,上海比朗公司;318C+酶标仪,上海欧沛公司;Bruker-ALPHA傅里叶变换红外,美国Bruker公司;Waters 2695 高效液相色谱(配有Aminex HPX-87P柱子,Sugar Park I柱和2414 RID示差折光检测器),美国Waters公司;Bruker UltrashieldTM 400 PLUS核磁共振分析仪,美国Bruker公司。
1.3 方法
1.3.1 松针预处理及提取方法预实验
将采摘的雪松松针除杂、清洗、干燥、粉碎,过40 目筛,石油醚和无水乙醇抽提,气干后得预处理松针粉末,测定含水率后密封,备用。
首先进行提取方法的预实验,比较U法(超声不加酶提取)、EU法(加酶后超声提取)、UE法(超声后加酶提取)三种方法对多糖得率的影响。
超声提取条件:称取3.0 g预处理松针粉末,按液料比30∶1(mL∶g),pH5.0,温度80 ℃,功率300 W,超声处理30 min。酶处理条件:纤维素酶用量为12 FPU/g原料,50 ℃ 振荡2 h,灭酶20 min。后续操作:将多糖提取液离心,残渣用水二次提取,合并清液,浓缩,醇沉,4 ℃静置12 h,离心,沉淀依次用无水乙醇、乙醚、丙酮洗涤[10],冻干后得松针粗多糖。
测得三种方法多糖得率分别为5.73%、7.27%和8.23%,表明超声结合酶处理可以提高多糖的得率,并且UE法效果最好,所以采用超声波酶法进行后续工艺优化研究。
1.3.2 葡萄糖标准曲线制作和多糖得率的测定
采用苯酚硫酸法制作标准曲线[11]。以糖液质量浓度X为横坐标(单位mg/L),吸光度A为纵坐标,通过线性回归求出方程A= 0.005 7X-0.075 5(R2=0.995)。将提取的粗多糖配成1 mg/mL的糖液,稀释一定倍数后同样采用苯酚硫酸法测其吸光度(A),测定粗多糖纯度,进一步用下列公式计算多糖得率。
式中:m1—预处理松针粉的绝干质量,g;m2—提取的粗多糖质量,g;n—稀释倍数。
1.3.3 单因素试验
按1.3.1节中的超声波酶法,依次比较超声温度(65、70、75、80 ℃)、超声时间(15、30、45、60 min)、超声功率(200、400、500、600 W)和液料比(20∶1、30∶1、40∶1和50∶1)(mL∶g下同)的条件下单因素对松针多糖得率的影响。
1.3.4 响应面分析工艺优化
在单因素试验基础上,利用Design Expert 8.0.6.1软件中Box-Behnken设计方法对超声波酶法提取松针多糖工艺进行优化,对超声温度、超声时间、超声功率这三个因素进行响应面优化试验设计,并对试验数据进行二次多项回归拟合。以多糖得率为响应值,比较三个自变量对多糖得率影响的显著性,优选出提取的最佳工艺条件。按最佳工艺条件验证三次,将得率与预测值进行对比。
1.3.5 粗多糖的纯化
采用酶法与Sevage法联用的方法来脱蛋白[12]。调节糖液pH至7.0左右,加入粗多糖质量0.1%~0.5%的菠萝蛋白酶,53 ℃,振荡1 h。灭酶后加入Sevage试剂,剧烈振荡30 min,静置分层,取上层清液,按上述方法重复处理2次。
采用双氧水与活性炭联用的方法脱除色素。将脱除蛋白的糖液pH调至9.0左右,加入3%过氧化氢和5%的活性炭,50 ℃,振荡1 h。过滤、浓缩后移入分子截留量为3 500的透析袋中,流动的自来水和蒸馏水中各透析两天,冻干后得到纯化多糖。
1.3.6 多糖结构初步表征
将纯化多糖样品配成一定浓度的溶液,在波长200~800 nm范围进行紫外可见光全波长扫描,检测其有无核酸、多肽、蛋白吸收。
称取干燥纯化多糖2 mg,加200 mg KBr,研磨,压片,在4 000~400 cm-1的波数范围内进行红外光谱扫描,绘制红外光谱图,分析其主要官能团。
取适量纯化多糖溶解于氘水中,并加入一滴氢氧化钠溶液振荡使其形成透明均匀溶液后,装入干燥、洁净的核磁管中,放入核磁共振仪中进行一维氢谱分析[13]。
1.3.7 单糖组分分析
分别准确称取适量粗多糖和纯化多糖,按1∶4体积比加入1M H2SO4,100 ℃,封管水解1 h,冷却中和,离心,上清液用0.22 um滤器过滤,滤液高效液相色谱检测[14]。
色谱条件:柱温为85 ℃,检测器温度为35 ℃,进样量为10 uL,流动相为双蒸水,流速为0.6 mL/min。
采用Bradford蛋白浓度测定试剂盒测定粗多糖和纯化多糖中的蛋白质含量的测定。
分别准确称取适量粗多糖和纯化多糖,用纯净水配制质量浓度为3~5 mg/mL的溶液,参考文献方法[15],采用HPLC检测糖醛酸含量。
1.3.8 松针多糖的体外抗氧化性
采用1,10-菲罗啉-Fe2+氧化法,测定松针粗多糖和纯化多糖对Fenton反应产生的羟自由基(·OH)的清除能力[16]。其中A0是不存在H2O2和样品的对照吸光度,A1是没有样品但存在H2O2的对照吸光度,A2是样品的吸光度,平行测定三次,取平均值,以Vc作阳性对照。清除率计算公式为:
参考文献[17]测定松针粗多糖和纯化多糖对DPPH·的清除能力,并以Vc作阳性对照。清除率计算公式为:
式中:A0—2 mL去离子水+2 mL DPPH醇溶液的吸光度值;A1—2 mL多糖样品+2 mL DPPH醇溶液的吸光度值。
2 结果与分析
2.1 单因素对松针多糖得率的影响
在液料比30∶1,超声功率400 W,超声时间30 min,纤维素酶用量为12 FPU/g原料条件下,研究超声温度对多糖得率的影响。由图1(a)可知:在65~80 ℃范围内,随超声温度的升高多糖得率呈现先升后降的趋势。这是因为高温可以加快多糖的溶出;但温度过高会导致多糖的部分降解,故最佳提取温度选择75 ℃。
超声温度为75 ℃时,研究超声时间对多糖得率的影响。如图1(b)所示:随着超声提取时间的延长,多糖得率逐渐提高,在60 min时达到最大。但是考虑到超声时间过长容易造成多糖结构的破坏,故最佳提取时间选择60 min。
超声温度为75 ℃,时间为60 min时,研究超声功率对多糖得率的影响。如图1(c)所示:在超声功率200~600 W的范围内,松针多糖得率呈先增后降的趋势。超声功率增大有助于多糖溶解,但大于500 W时,会对多糖结构造成破坏,发生降解,使多糖得率下降,故最佳超声功率选择500 W。
超声温度为75 ℃,时间为60 min,功率为500 W时,研究液料比对多糖得率的影响。如图1(d)所示:随着液料比的加大,多糖得率呈小幅下降的趋势,故最佳液料比确定为20∶1(mL∶g)。
2.2 响应面分析法对雪松松针多糖提取工艺的优化
2.2.1 响应面法试验设计及结果
在单因素试验基础上,以对超声波酶法提取雪松松针多糖得率影响效果显著的3个因素—超声温度、超声时间和超声功率为自变量,多糖得率为响应值Y,采用Box-Behnken设计模型进行三因素三水平响应面分析。试验设计及结果如表1所示。

图1 提取的单因素试验Fig.1 Simple factor experiments on extraction

表1 响应面试验设计及结果
通过Design Expert 8.0.6.1软件对各因素进行二次响应面回归分析,得出多元二次响应面回归拟合模型为:
Y=-27.683 5+1.021A+0.116 2B-0.0240 75C+0.001 066 67AB+0.000 68AC-0.000 016 6667BC-0.008 92A2-0.002 035 56B2-0.000 026 3C2。
该模型的方差分析结果见表2。

表2 方差分析表
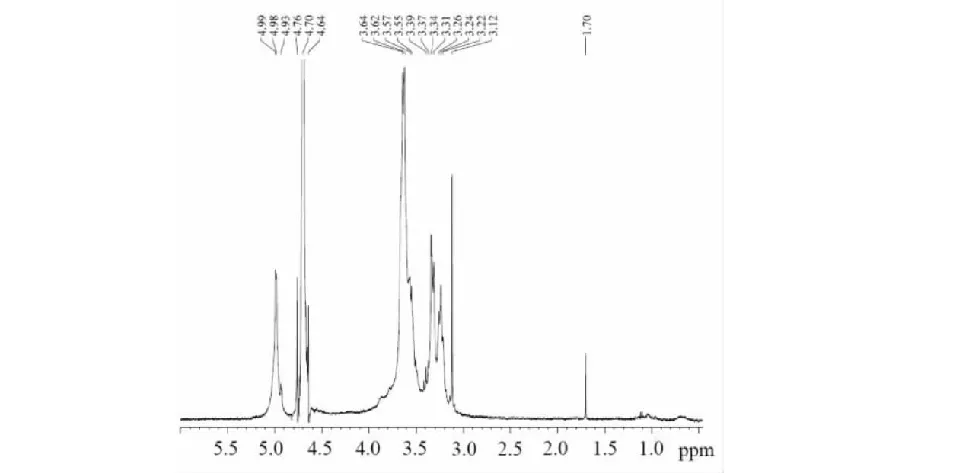
注:***差异极显著P<0.000 1;**差异高度显著 0.000 1 Note:***extremely significant differenceP<0.000 1;**highly significant difference 0.000 1 2.2.2 最优工艺参数的确定 通过对所得回归模型的分析,确定雪松松针多糖最佳提取条件为:超声温度80 ℃,超声功率561.66 W,超声时间47.17 min,在此条件下模型预测松针多糖提取得率为10.18%。为了给实际操作带来方便,修正最佳工艺条件为:提取温度80 ℃,超声功率560 W,超声时间47 min,且在此条件下进行3次验证实验,平均得率为10.39%,与模型预测值的相对误差为2.06%,实际值与理论值基本相符,说明优化后的工艺条件准确可靠,具有一定的应用价值。 2.3.1 紫外可见光扫谱和红外光谱分析 纯化多糖光谱图中波长260 nm和280 nm处未发现明显的吸收峰,表明其中不含核酸,并且多肽和游离蛋白等物质含量较低。 图2是雪松松针纯化多糖的红外图谱,3 400~3 300 cm-1处的宽峰是由多糖分子中O-H的伸缩振动产生,2 925 cm-1处的吸收峰是由-CH2-或-CH3的C-H键的伸缩振动产生,它们是多糖物质的特征吸收峰。1 620 cm-1处的吸收峰可能由-CHCOONH3基团中C=O的非对称伸缩振动产生,1 400 cm-1处的吸收峰也可能是由-COOH中C-O的伸缩振动产生,说明纯化的多糖中可能存在少量蛋白质或多酚。此外1 030 cm-1,1 152 cm-1处的一组强烈吸收峰是吡喃环中C-O-C和C-O-H的吸收,944 cm-1和762 cm-1处的吸收峰分别是由D-葡萄吡喃糖的C-O-C骨架非对称和对称伸缩振动产生,而呋喃糖相应的峰出现在944 cm-1和853 cm-1,880 cm-1为β-吡喃糖苷键的特征吸收峰。因此雪松松针纯化多糖中可能同时含有吡喃糖和呋喃糖,并且以β-糖苷键为主要连接方式。 图2 雪松松针纯化多糖的红外光谱Fig.2 Infrared spectrum of pine needles purified polysaccharides 2.3.2 纯化多糖1H NMR分析 从图3中可以观察到松针多糖的异头质子产生的信号集中出现在δ4.64~4.99 ppm的范围内,表明雪松松针多糖具有β构型的糖苷键,该结果与红外谱图中对糖苷键构型判断是一致的。异头氢质的化学位移处于较低场,一般在4.5~5.5 ppm的区域内有几个质子信号,即表示有几种单糖组分。1H-NMR谱表明有4个主要的异头质子信号:δ4.99,δ4.93,δ4.76,δ4.64,初步推断松针多糖有4种单糖组分。 图3 松针纯化多糖的1H NMRFig.3 1H NMR spectrum of pine needles purified polysaccharides 2.3.3 多糖组成分析 从表3中的结果可知,雪松松针粗多糖中含有葡萄糖、半乳糖、阿拉伯糖、果糖和甘露糖5种单糖,多糖的纯度为60.31%,其中还含有28.97%的半乳糖醛酸和10.46%蛋白质。纯化多糖中甘露糖未检测出,只含有其余4种单糖,多糖的纯度为91.23%,其次还有质量百分浓度分别为2.41%的半乳糖醛酸和5.40%的蛋白质。这说明经纯化处理后,粗多糖中的蛋白质、色素等杂质脱除接近一半,同时因为在碱性条件下采用H2O2脱色,半乳糖醛酸发生失稳现象,主链解聚,变成了可溶性小分子物质,在透析时流失,因此纯化多糖中的半乳糖醛酸含量大幅度降低。此外甘露糖作为中性糖可能处于半乳糖醛酸支链上,随半乳糖醛酸主链断裂也流失了,纯化多糖中不含有甘露糖,其余4种单糖的质量浓度大小为:葡萄糖>果糖>阿拉伯糖≈半乳糖,摩尔比约为23.02∶5.40∶1.22∶1.00,该结果与核磁共振氢谱的结果一致。 表3 多糖组成分析结果 2.4.1 清除羟自由基(·OH)的能力 由图4(a)可知:在0.1~1.4(g/L) 的浓度范围内,Vc和松针粗多糖对·OH的清除率随浓度的增大而不断增大,呈现一定的量效关系。Vc对羟自由基的清除率在0.6 g/L达100%,粗多糖在1.4 g/L达100%,它对羟自由基的半抑制浓度IC50为0.47 g/L,说明雪松松针粗多糖对羟自由基有较好的清除能力。但纯化多糖对·OH的清除率保持在25%左右,并不随浓度的增大产生较明显的变化,在1.4 g/L时仅为26.50%,粗多糖对羟自由基的清除能力远高于纯化多糖。 2.4.2 清除DPPH·自由基的能力 由图4(b)可知:在0.1~1.4(g/L)的浓度范围内,松针粗多糖和纯化多糖二者对DPPH·的清除率随浓度的增大而不断增大,均呈现一定的量效关系,且粗多糖清除DPPH·的能力远远强于纯化多糖。Vc对DPPH·的清除率在0.1 g/L达到90%以上,粗多糖在0.4 g/L时也可以达到90%,它对DPPH·的半抑制浓度IC50为0.076 g/L;但是纯化多糖对DPPH·的清除率在1.4 g/L时仅为27.71%,粗多糖对DPPH·的清除能力远高于纯化多糖,并且与对羟基自由基的清除结果一致。这与茶叶多糖非常类似,茶叶多糖的抗氧化活性与其糖醛酸含量呈正相关,糖醛酸含量越高,其抗氧化能力越强[18],雪松松针粗多糖中的半乳糖醛酸质量浓度高于纯化多糖,因此粗多糖的抗氧化性要明显优于纯化多糖。松针多糖的抗氧化能力可能主要取决于其中的半乳糖醛酸含量或者是多糖半乳糖醛酸复合物协同作用的结果。 图4 松针多糖的抗氧化活性Fig.4 Antioxidant activities of pine needle polysaccharides and Vc 研究采用超声波酶法从雪松松针中提取多糖,在单因素试验基础上,采用响应面分析法对提取工艺进行优化,获得最佳工艺为:3.0 g松针粉末,液料比20∶1(mL∶g),提取温度80 ℃,超声功率560 W,超声时间47 min,纤维素酶用量12 FPU/g原料,在此条件下多糖得率高达10.39%。通过测定松针多糖对·OH和DPPH·自由基的清除能力评价其体外抗氧化活性,结果表明:雪松松针粗多糖对·OH和DPPH·自由基有较好的清除能力,且呈现出良好的量效关系,对前者的清除率在1.4 g/L达100%,对后者的清除率在0.4 g/L时可以达到90%,粗多糖对·OH和DPPH·的半抑制浓度IC50分别为0.47 g/L和0.076 g/L。纯化多糖对两种自由基的清除率在1.4 g/L时仅为26.50%和27.71%,粗多糖对·OH和DPPH·的清除能力远高于纯化多糖,分析原因可能是粗多糖中的半乳糖醛酸质量浓度高于纯化多糖,松针多糖的抗氧化能力可能主要取决于其中的半乳糖醛酸含量或者是多糖半乳糖醛酸复合物协同作用的结果。与传统的水提法相比,超声波酶法提取松针多糖工艺具有较高的提取效率,雪松松针粗多糖表现出较强的体外抗氧化能力。并且采用高效液相色谱、红外光谱和核磁共振等对松针多糖结构进行了初步表征,为松针多糖结构的进一步研究和多糖的高值化利用提供依据。
2.3 松针多糖结构初步表征结果


2.4 松针多糖的抗氧化性试验结果

3 结论

