UFLC-MS/MS研究胡椒碱在不同种属肝微粒体中的代谢稳定性和代谢表型
苟立平,邓 星,罗莉娅,汤明海,万 丽
1成都中医药大学药学院,成都 611137;2四川大学华西医院肿瘤生物治疗研究室,成都 610041
胡椒碱(Piperine,Pip)为本实验室从胡椒科植物胡椒(PipernigrumL.)的干燥成熟果实中提取、分离、纯化获得的吡咯烷类酰胺生物碱,纯度大于99%。Pip是胡椒发挥药效作用的主要成分之一,药理作用较为广泛,已知具有抗惊厥[1]、抗炎[2]、抑制胆结石[3]、抗溃疡[4]等作用。近年来的研究表明,Pip具有抗癌活性[5-8]。由于其结构简单(见图1),有利于对其结构进行修饰,且具备药效基团的化学结构特征,如具有氢键接受体、疏水中心和芳环中心等可与受体结合的特征性单元。因此,其本身不仅可作为一种新药进行研发,而且化学研究空间为进一步化学合成研究获得高活性低毒性先导化合物奠定了基础[9]。

图1 胡椒碱化学结构Fig.1 Chemical structure of Piperine
体外代谢研究相比之下可直接观察候选化合物与受试靶点的选择性作用,不需要消耗大量的样品和实验动物,操作简便快捷,且能指导后期药效、药动以及安全性评价的模型选择,缩小体内研究的筛选范围,节约研发成本[10]。为全面了解Pip在不同种属中的代谢特性,为后续研究提供支撑,本课题研究了Pip在不同种属肝微粒体中的代谢稳定性及在人体肝微粒体中的代谢产物,采用选择性化学抑制法考察Pip在人肝微粒体中的代谢表型,为深入了解Pip的代谢特征和临床合理用药提供依据。
1 实验材料
超快速液相色谱(UFLC)系统包括:SIL-30AC 自动进样器,LC-30AD 高压输液泵,CBM-20A 连接器,CTO-20AC柱温箱(日本岛津公司)、Acquity UPLC®Hss C18(2.1 mm×100 mm,1.8 μm);AB SCIEX QTRAP5500三重四级杆质谱仪(美国AB公司);数据处理软件(MultiQuant 3.0.2);W201B升降智能水浴锅(郑州长城科工贸有限公司);Thermo Heraeus Fresco 17低温冷冻离心机(Thermo Scientific公司);230V-U K涡旋混合器(Labnet International公司);BT 125D 电子天平(赛多利斯仪器(北京)有限公司);移液枪(德国 Eppendorf公司)。
胡椒碱(Piperine,Pip):由四川大学生物治疗国家重点实验室分离纯化而得,纯度>99%;内标白屈菜红碱对照品,购于成都瑞芬思生物科技有限公司,纯度>98%。大鼠、人、犬、猴、小鼠等肝微粒体:20 mg/mL,NADPH发生系统:A液(含MgCl2)、B液,均购自武汉普莱特生物医药技术有限公司,于-80 ℃冷冻保存;α-萘黄酮(α-Naphthoflavone,ANF;纯度大于 98.0%,东京化成工业株式会社);毛果芸香碱(Pilocarpine,中国食品药品检定研究院)、盐酸噻氯匹定(Ticlopidine,TCP;纯度 99.7%,中国食品药品检定研究院);奎尼丁(Quinidine,QND;纯度>98.0%,TCI 上海化成工业发展有限公司);二乙基二硫代氨基甲酸钠(Clomethiazole,纯度> 99%,sigma 公司)、酮康唑(Ketoconazole,KCZ;纯度 99.0%,Dr Ehrenstorfer 公司),磺胺苯吡唑(Sulphaphenazole,SUP;纯度>99%,Sigma 公司);水:Milli-Q 18.2 MΩ,25 ℃,由本实验室制备;甲醇:批号:163629,Fisher Scientific 公司;甲酸:色谱纯,纯度98%,批号:1001003297,Fluka Analytical公司。
2 方法
2.1 溶液的制备
Pip溶液的制备:称取Pip适量,用甲醇溶解为1 mg/mL对照品储备液。
内标溶液的制备:称取白屈菜红碱适量,用甲醇稀释成10 ng/mL的内标工作液。
2.2 UFLC-MS/MS条件
液相条件:流速 0.3 mL/min;样品室温度:10 ℃;柱温:30 ℃;流动相为0.1%甲酸水(A相)-甲醇(B相),梯度洗脱,0~2 min,55%~90% B、2~5 min,90%B;进样体积2 μL。
质谱条件:电喷雾离子化(ESI)方式,检测离子为正离子;毛细管电压5.5 kV,离子源温度500 ℃,去簇电压(DP)为120 V。采用多级反应检测模式(MRM)模式,测定Pip和内标化合物,其对应的监测离子对和碰撞能量分别为Pip(m/z286.2→201.1,33 eV),内标白屈菜红碱(m/z348.3→332.2,43 eV)。
2.3 Pip在不同种属肝微粒体体外代谢孵育模型中的稳定性
2.3.1 代谢稳定性孵育模型
参照文献[11],每个孵育体系总体积为206 μL,包含188 μL K2HPO4缓冲液(即PBS,100 mM,pH 7.4)和12 μL NADPH发生系统(10 μL A液和2 μL B液于冰浴上临时混合制得),冰浴上加入1 μL 200 μmol/L Pip后,于37 ℃预孵5 min,分别加入5 μL各种属肝微粒体溶液启动反应。孵育时间为0、5、15、30、45、60 min。待反应完毕后,取孵育后的样品(200 μL)加400 μL含内标10 ng/ mL的冰甲醇终止反应,涡旋混匀3 min,13 000 rpm离心15 min,取上清液于进样瓶中。平行实验3次,考察Pip在不同种属肝微粒体中的代谢稳定性。
2.3.2 体外半衰期
将孵育0 min时间点Pip的浓度作为100%,其他孵育时间点的浓度与之相比得剩余百分量,将各时间点的剩余百分量的自然对数与孵育时间作线性回归,求算得斜率k,根据公式半衰期T1/2=-0.693/k;肝微粒体中的固有清除率CLint=0.693×孵育液(mL)/[T1/2(min)×肝微粒体(mg)]。
2.4 Pip在CYP450酶中的代谢表型研究
2.4.1 代谢表型研究体系
根据文献[12],代谢表型研究体系采用选择性化学抑制剂法。所选的CYP3A4抑制剂为酮康唑(1 μmol/ L),CYP2D6抑制剂为奎尼丁(10 μmol/ L),CYP2C9抑制剂为磺胺苯吡唑(20 μmol/ L),CYP2A6抑制剂为毛果芸香碱(25 μmol/ L),CYP2C19抑制剂为盐酸噻氯匹定(50 μmol/ L),CYP2E1抑制剂为二乙基二硫代氨基甲酸钠(100 μmol/L),CYP1A1为α-萘黄酮(1 μmol/L)。代谢表型反应时间、酶蛋白浓度及底物浓度根据“2.3.1”项下确定。
设定Pip孵育浓度为1 μmol/mL,人肝微粒体浓度为20 mg/mL。以2.3.1项下孵育体系,冰浴上加入200 μmol/L的Pip溶液1 μL,各选择性化学抑制剂1 μL,在37 ℃预孵5 min后,加入人肝微粒体溶液5 μL,涡旋混匀,37 ℃孵育10 min,反应结束后,加入400 μL含内标10 ng/mL的冰甲醇终止反应,每个样品平行3份。
另设置未发生反应样品为阴性对照组(不加NADPH发生液,只加等量甲醇);设定完全发生反应为阳性对照组(加入NADPH发生系统,但不加抑制剂,只加等量甲醇)。利用UFLC-MS/MS测定Pip的剩余浓度,考察不同选择性化学抑制剂对Pip代谢的影响。
2.4.2 数据处理
抑制率=[1-(阴性对照组浓度-实验组浓度)/(阴性对照组浓度-阳性对照组浓度)]×100%。利用OriginLab 9.0、EXCEL软件进行数据处理和制图。
2.5 体外代谢产物研究
设定Pip孵育终浓度为50 μmol/ L,在2.3.1项下孵育体系,冰浴上加入5 000 μmol/L的Pip溶液2 μL,在37 ℃预孵5 min后,加入人肝微粒体溶液5 μL,涡旋混匀,分别于37 ℃孵育0 min和90 min,反应结束后,加入200 μL冰甲醇终止反应。照2.3.1项下处理后,利用UFLC-MS/MS进行进样测定。
2.6 方法学考察
2.6.1 专属性考察
取PBS 188 μL,加入5 μL高温灭活的肝微粒体,记为“孵育体系Ⅰ”。取“孵育体系Ⅰ”,加入400 μL含内标10 ng/mL的甲醇溶液,照“2.3.1”项下的样品处理方法进行处理,即得空白对照样品A。另取“孵育体系Ⅰ”,加入含内标10 ng·mL-1的甲醇溶液400 μL和200 μmol/L Pip溶液1 μL,同法处理,得对照样品B。
2.6.2 线性关系
精密吸取Pip对照品贮备液,用甲醇逐级稀释为质量浓度分别为390.5、781、1 563、3 125、6 250、12 500、25 000、50 000 ng/mL的系列对照品溶液。于“孵育体系Ⅰ”中分别加入1 μL上述系列对照品溶液,涡旋混匀,照“2.3.1”项下样品处理方法进行处理,照“2.2”项下液质条件进行测定。利用“MultiQuant 3.0.2”数据处理软件,求得直线回归。
2.6.3 准确度
照“2.6.2”项下,制得质量浓度分别为781、31.25、400 ng/mL的低、中、高三组质控浓度样品进行准确度实验,同法处理后进行分析,计算各质控样品的回收率。每组样品平行5份。
2.6.4 精密度
照“2.6.3”项下,配制低、中、高浓度质控样品,用质控样品的日内和日间RSD表示。日内每隔2 h 处理一组低、中、高浓度样品,共处理5组,计算日内精密度。日间精密度连续3天测定3个分析批次,每个浓度测定5个样品来计算日间精密度。
2.6.5 基质效应
照“2.6.3”项下,配制低、中、高浓度质控样品,分别测定峰面积A;另取Pip对照品溶液,加含内标10 ng/mL流动相制成相同浓度的溶液,分别测定峰面积B,每组平行5份。基质效应公式为A / B × 100%,此值应在85%~115% 之间。
3 结果
3.1 方法学考察
在“2.2”实验条件下,Pip与内标白屈菜红碱的保留时间分别为4.27、2.93 min,达到基线分离,且无空白基质干扰,说明该方法专属性良好,结果见图2。利用“MultiQuant 3.0.2”数据处理软件,求得直线回归为:y=0.131 78x+ 0.378 41(r= 0.995 9),各浓度的准确度偏差均小于15%,表明在3.91~500 ng/mL范围内,Pip的浓度与响应值呈良好的线性关系,符合要求。低、中、高质控样品的回收率分别为(110.82 ± 3.91)%、(107.81 ± 4.96)%、(107.96 ± 3.17)%。实验结果表明,该浓度范围内,回收率较高,准确度符合要求,测定结果准确、可信。日内和日间精密度RSD小于5%,符合要求。基质效应在85%~115% 范围内,对测定结果影响较小。方法学验证结果表明,该方法特异性好,准确度、精密度和基质效应等均符合要求,结果见表1。
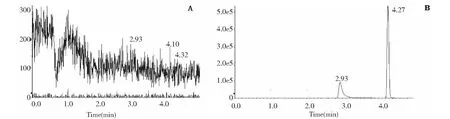
图2 Pip及内标白屈菜红碱的色谱图Fig.2 Chromatograms of Pip and internal standard compound chelerythrine注:A为空白对照样品;B为加入Pip及内标白屈菜红碱的标准对照样品。Note:A is a blank control sample;B is a standard control sample added Pip and internal standard chelerythrine.

质量浓度Concentration(ng/ mL)准确度Accuracy精密度RSDPrecision RSD(%)日内Day日间Daytime基质效应Matrix effect(%)低Low110.82±3.913.344.57100.64中Middle107.81±4.964.404.9097.45高High107.96±3.172.083.2898.70
3.2 Pip在不同种属肝微粒体中的代谢稳定性
分别考察了Pip在人、大鼠、小鼠、猴和犬的5个种属肝微粒体中的代谢稳定性,Pip均发生了代谢,孵育时间与底物剩余百分比的自然对数孵育曲线见图3。其中在猴和犬肝微粒体中代谢较为相似,在小鼠、猴和大鼠肝微粒体中代谢较缓慢,在人和大鼠肝微粒体中代谢较明显。
3.3 体外半衰期与固有清除率
在人、大鼠、小鼠、恒河猴和比格犬肝微粒体中,以孵育时间为横坐标,以底物剩余百分比的自然对数为纵坐标作线性回归,在肝微粒体中的线性方程人为y=-0.022 1x+4.392(r2=0.935 7),大鼠为y=-0.014 3x+4.375(r2=0.856 8),昆明种小鼠为y=-0.007 4x+4.559 8(r2=0.967 7),恒河猴为y=-0.004 7x+4.601 3(r2=0.991 5),比格犬为y=-0.004 2x+4.592 7(r2=0.991 8)。由各线性的斜率k求得Pip在各种属中的半衰期和固有清除率(见表2)。

图3 Pip在人、大鼠、小鼠、猴和犬5个种属肝微粒体中各时间点与底物剩余百分比的自然对数孵育曲线Fig.3 The natural logarithmic incubation curves of Piperine with the percentage of substrate remaining at each time point in human,rat,mouse,monkey and dog liver microsomes
表2 Pip在人、SD大鼠、小鼠、恒河猴和比格犬5个种属肝微粒体中的体外代谢半衰期和固有清除率
Table 2 Half-life in vitro and intrinsic clearance of Piperine in human ,rat,mouse,monkey and dog liver microsomes

种属 SpeciesT1/2(min)CLintmL/(min·mg)人 Human31.360.0442大鼠 Rat48.460.0286小鼠 Mouse138.60.0100猴 Monkey147.450.0094犬 Dog165.000.0084
3.4 Pip在人肝微粒体中的代谢表型
CYP3A4和CYP2C9是参与Pip代谢的主要同工酶,代谢抑制率分别为81.13% 和69.21%。各抑制剂对人肝微粒体中Pip代谢的影响结果见表3。
3.5 体外代谢产物研究
图4 A为孵育0 min与孵育90 min的样品色谱对比图。将孵育0 min的提取色谱图上保留时间为9.92 min的色谱峰命名为M0。通过图4 A可知,孵育90 min的提取色谱在M0的基础上,新增了3个色谱峰,保留时间分别为6.94、7.55、10.21 min,依次命名为M1(6.94 min)、M2(7.55 min))、M3(10.21 min)。[M+H]+峰m/z依次为274.15、318.24和284.19,分别见图4 D、E、F。各谱图详见图4。

表3 各抑制剂对人肝微粒体中Pip代谢的影响
4 结论
本文建立了Pip的UFLC-MS/MS定量测定方法,该方法专属性强,灵敏度高,线性、准确度、精密度和基质效应等均符合生物样品的测定要求。Pip在人、大鼠、小鼠、恒河猴和比格犬肝微粒体中体外代谢半衰期T1/2分别为31.36、48.46、138.60、147.45、165.00 min;体外固有清除率分别为0.044 2、0.028 6、0.010 0、0.009 4、0.008 4 mL·min-1·mg-1,推测Pip在人和大鼠肝微粒体中代谢较接近,代谢相对较快;在小鼠、猴和犬肝微粒体中代谢速率接近,均较慢;表明Pip在人、SD大鼠、小鼠、恒河猴和比格犬肝微粒体中代谢速率存在明显的种属差异。在后续进行体内实验动物的选择时,可以考虑采用与人代谢较为接近的大鼠作为参考。目前,CYP代谢酶表型的确定主要有特定的化学物质或抗体作为特定酶的抑制剂(特异性化学抑制剂法)和重组人源CYP同工酶法。由于重组人源CYP同工酶法相对来说成本更高,因此本实验采用选择性化学抑制剂法。考察受试药物的代谢被作用药物抑制时,选择了该酶已知的强抑制剂。代谢表型实验结果表明人肝微粒体中参与Pip代谢的酶主要有CYP3A4和CYP2C9。代谢表型的研究可以预测其潜在的药物-药物相互作用。Pip在与其他药物联用时,需考虑经CYP3A4和CYP2C9代谢的药物之间的相互作用,如与经CYP3A4代谢的大环内酯类抗生素(如红霉素、克拉霉素等)、CYP450酶抑制剂咪唑类抗真菌药(如主要的CYP3A4抑制剂酮康唑、伊曲康唑等)、经CYP2C9代谢的药物(如苯妥英、甲苯磺丁脲)、钙拮抗剂(如尼卡地平、维拉帕米、美贝拉地尔等)[13,14],实施个体化治疗,提高药物疗效、降低不良反应的发生率。

图4 孵育0 min与孵育90 min的样品色谱对比图及各色谱峰质谱图Fig.4 The chromatograms of samples incubated for 0 min and 90 min and mass spectrum of each chromatogram peaks注:A为孵育0 min与孵育90 min的样品色谱对比图;B为孵育0 min M0质谱图;C为孵育90 min M0质谱图;D为孵育90 min M1质谱图;E为孵育90 min M2质谱图;F孵育90 min M3质谱图。Note:A is Chromatograms of samples incubated for 0 min and 90 min.;B is incubation of M0 spectra for 0 min;C is incubation of M0 spectra for 90 min;D is incubation of M1 spectra for 90 min;E is incubation of M2 spectra for 90 min;F is incubation of M3 spectra for 90 min.

