超声-微波协同提取大青叶多糖及其分子特性和免疫活性研究
曹荣安,李朝阳,李昌盛,张开江,王长远
1黑龙江八一农垦大学食品学院;2黑龙江省农产品加工与质量安全重点实验室;3黑龙江八一农垦大学国家杂粮工程技术研究中心,大庆 163319;4韩国江陵原州大学海洋食品科学技术系,江陵 210702;5大庆市燃乏中药材种植专业合作社,大庆 163411
大青叶是十字花科(Cruciferae)菘蓝属(Isatis)植物菘蓝(IsatisindigoticaFort)的干燥叶,其地下部分为板蓝根,在我国中东部分布较广[1]。大青叶是我国传统中药,性寒、味苦、归心胃经[2]。经研究发现,大青叶中存在有机酸、靛蓝、靛玉红、菘蓝苷、色胺酮、喹唑酮、异牡荆素、多糖等化学成分化合物[3]。现代药理研究表明,大青叶具有清除自由基、调理血脂、抗病毒、抗菌、抗癌、增强免疫调节等作用[4,5],具有清热解毒、凉血消斑之功效,临床上可用于温病高热、神昏、发斑发疹、作腮、喉痹、丹毒、痈肿[6]。目前对于大青叶中化学成分的研究主要集中在小分子物质,对多糖的研究报道很少[7]。本文是以大庆地产大青叶为原料,利用超声-微波协同水提法进行大青叶多糖提取,研究提取参数,分析大青叶多糖化学成分、单糖组成、分子量和链接方式,同时进行体外生物活性研究,为大青叶多糖的研究利用提供理论基础。
1 材料与方法
1.1 材料与仪器
大青叶由大庆市燃乏中药材种植专业合作社提供,RAW264.7细胞来自ATCC。RPMI-1640细胞培养基、青霉素/链霉素、牛血清蛋白购自美国Lonza公司,脂多糖(LPS)、Griess (modified)购自美国Sigma-Aldrich公司,EZ-cytox细胞增殖及细胞毒性检测试剂盒(2-(4-碘苯)-3-(4-硝基苯)-5-(2,4-二磺基苯)-2H-四氮唑钠盐,WST-1)购自韩国Daeillab公司,蛋白质定量试剂盒购自美国Bio-Rad公司。其他化学试剂均为分析纯。
Excella ECO-170细胞培养箱,英国New Brunswick Scientific公司;EL800酶标仪,美国Biotech公司;6890N/MSD5973气质联用仪(GC-MS),美国Agilent公司;LR64912C傅里叶近红外光谱仪,美国PerkinElmer;高效尺寸排阻色谱-多角度激光光散射仪-示差折光检测器联用系统(HPSEC-MALLS-RI),包括泵(#321,Gilson,Middleton,WI,USA),注射器(#7072,Rheodyne),尺寸排阻色谱柱(TSK G5000 PW;7.5×600 mm,TosoBiosep,Mongomeryville,PA,USA),MALLS检测器(HELEOS;Wyatt Technology Corp,Santa Barbara,CA,USA),RI检测器(#2414,Waters);CW-2000超声-微波协同萃取/反应仪,上海新拓分析仪器科技有限公司。
1.2 方法
1.2.1 大青叶多糖提取
大青叶原料烘干研磨后加入85%乙醇,70 ℃加热回流搅拌2 h,冷却后室温搅拌12 h,离心后残渣中分别加入85%乙醇和无水丙酮室温搅拌,自然干燥得到脱脂大青叶。加入蒸馏水在水浴锅中提取一定时间,之后再放入超声-微波协同萃取/反应仪中浸提(超声功率50 W),合计提取时间2 h,离心得到上清液,浸提2次,上清液旋转蒸发浓缩,加入乙醇使最终乙醇体积分数为80%,搅拌10 min后放入4 ℃冰箱中静置12 h。离心弃去上清液,沉淀分别加入无水乙醇和丙酮洗涤2次,离心后沉淀室温干燥。干燥提取物利用Sevag试剂(氯仿与正丁醇体积比为5∶1)去除蛋白质,3 500 D膜透析冻干得到大青叶多糖,称质量后计算多糖得率,大青叶多糖得率(%)=(提取得到的多糖质量/脱脂后原料质量)×100%。
1.2.2 提取大青叶多糖单因素实验
1.2.3 提取大青叶多糖正交实验
根据单因素试验结果,4个因素各选取3个水平进行正交试验,从而确定提取大青叶多糖的最佳参数。
1.2.4 化学成分分析
采用苯酚-硫酸法[8]测定总糖含量,采用Lowry法(福林-酚法)[9]测定蛋白质含量,采用氯化钡-明胶浊度法[10]测定硫酸根含量,采用间羟基联苯法[11,12]测定糖醛酸含量。
1.2.5 单糖组成和链接方式分析
参考文献[13]方法并稍作改动,样品经过不同方法的衍生化后注入1 μL到GC-MS仪中进行分析,根据GC出峰时间和MS的离子峰同单糖标准品以及不同链接方式的多糖进行对比,从而确定单糖组成和链接方式。
在运用该系统的过程最后,车辆进场前,需在项目部安全环保部门办理台账登记手续(三证齐全),手续齐全后发项目部自编号,由设备物资科进行电子标签的录入信息工作,录入完成后装料,装料到达自动称重系统后看指示灯(红绿灯),当绿灯亮时,车辆行驶到电子标签扫描区域,扫描成功后道闸打开,车辆进入称台中间(此时红外线已扫描)不用停车方可称重记录,记录成功后语音提示称重保存成功,显示屏显示称重数据,道闸打开车辆通过称重完毕。
1.2.6 分子质量及分布测定
参考文献方法[14],将多糖配置成溶液溶解后利用HPSEC-MALLS-RI联机系统测定分子质量及分布情况。
1.2.7 红外光谱分析
取1 mg多糖样品,按照1∶200(W∶W)的比例与KBr混合,研磨后压片,利用傅里叶红外光谱仪扫描分析,扫描范围4 000~400 cm-1。
1.2.8 多糖对巨噬细胞增殖能力影响
细胞增殖采用WST-1细胞增殖及细胞毒性检测试剂盒,参考文献方法[15],RAW264.7细胞用不同浓度的多糖溶液处理后加入WST-1溶液,在450 nm下测定吸光值,计算细胞增殖率。
1.2.9 多糖激活巨噬细胞产生NO测定
参考文献方法[15],RAW264.7细胞在96微孔板中预培养24 h,细胞中加入多糖溶液,1 μg/mL LPS作为阳性对照,培养24 h。上清液中NO含量按照文献[16]方法进行测定。
1.3 数据分析
实验重复3次,数据采用M±SD表示,采用Sigmaplot 12.0作图。应用SAS 8.2软件对数据进行统计分析,各实验组之间的显著性差异分析采用单因素方差分析(one-way ANOVA)和邓肯氏复极差法。
2 结果与分析
2.1 大青叶多糖提取参数
2.1.1 单因素结果与分析
影响大青叶多糖得率的4个因素的单因素试验结果见图1,其中曲线a是液料比对多糖得率影响,可知在液料比10∶1~25∶1(V/m)范围内,随着液料比的增大多糖得率呈显著上升趋势(P<0.05),之后随着液料比升高多糖得率呈现下降趋势,所以最佳液料比(V/m)范围为20∶1、25∶1、30∶1。由曲线b可知,在提取温度75~90 ℃范围内,随着温度升高多糖得率逐渐升高,当提取温度升高到95 ℃时多糖得率呈现下降趋势,最佳提取温度范围为85、90、95 ℃。从超声-微波时间对于大青叶多糖得率影响可知(图1曲线c),当超声-微波时间在20~50 min时多糖得率一直呈上升趋势,最佳超声-微波时间范围为40、50、60 min进。图1中曲线d是微波功率对于多糖得率的影响,在微波功率300~500 W内多糖得率呈上升趋势,之后随着微波功率升高,多糖得率呈现下降趋势,微波功率最佳范围为400、500、600 W。

图1 单因素试验结果Fig.1 The results of single factor experiment
2.1.2 正交试验结果
根据单因素试验结果,选取液料比(V/m)20∶1、25∶1、30∶1,提取温度85、90、95 ℃,超声-微波时间40、50、60 min,微波功率400、500、600 W进行正交试验,试验设计和结果见表1。

表1 正交试验设计和结果
根据表1极差分析结果,判断出各因素对多糖得率影响的主次顺序为:B(提取温度)>A(液料比)>C(超声-微波时间)>D(微波功率),因此超声-微波协同提取大青叶多糖的最佳条件是A2B2C2D2,即料液比25∶1,温度90 ℃,超声-微波时间50 min,微波功率500 W,按照此参数进行验证试验,大青叶多糖得率为10.49%。张明以山东大青叶为材料,采用复合酶水解、乙醇沉淀法提取其中的多糖,多糖平均得率为18.24%[7],高于本研究的多糖得率10.49%,主要原因是张明在提取大青叶多糖过程中没有进行去蛋白和透析,而且所选取的大青叶原料产地、提取实验条件和设备差异也会造成提取率的不同。
2.1.3 超声-微波协同提取同其他提取方法的对比
为了验证超声-微波协同提取效果,进行了对比提取试验,在超声-微波协同提取得到最佳参数下进行。对比试验安排和结果见表2,可知仅利用超声辅助提取多糖得率为8.11%,仅利用微波辅助提取多糖得率是8.84%,水提法多糖得率仅为7.52%,都显著低于超声-微波协同提取法(P<0.05)的多糖得率,说明超声-微波协同萃取方法是有效的,可以显著提高大青叶多糖得率。

表2 对比试验安排和结果
注:a,b,c,d字母不同表示差异显著(P<0.05),相同表示差异不显著(P>0.05)。下同。
Note:The lettersa,b,c,dindicated a significant difference (P<0.05).The same below.
2.2 大青叶多糖化学成分和单糖组成
对大青叶多糖进行化学成分和单糖组成进行分析,由表3可知大青叶多糖化学组成包括63.8%总糖、13.1%蛋白质、14.2%硫酸根和12.6%糖醛酸。图2是大青叶多糖总离子流色谱图,同单糖标准品的出峰时间和质谱图进行比较,由峰面积可知大青叶多糖中含量最高的是半乳糖33.1%,之后依次是阿拉伯糖24.6%、鼠李糖17.2%、葡萄糖12.0%、甘露糖6.2%、木糖4.5%、岩藻糖2.4%(表3)。
2.3 大青叶多糖的分子质量及分布
采用高效尺寸排阻色谱-多角度激光光散射仪-示差折光检测器联机系统对大青叶多糖的分子质量及分布情况进行了研究,示差折光检测曲线见图3。利用ASTRA 6.1软件进行分析,得到分子质量(Mw)为7.85×105u,回转半径(Rg)为183.3 nm。
2.4 大青叶多糖的链接方式
利用GC-MS分析大青叶多糖链接方式,各碎片的质谱图与标准质谱NIST库和文献[17]进行比对分析,质谱解析结果列于表4。可知残基中主要存在2,3,4,6-四-O-、2,3,6-三-O-、2,4-二-O-甲基吡喃半乳糖醇乙酸酯,2,3,5-三-O-、3,4-二-O-、2,3-二-O-甲基阿拉伯糖醇乙酸酯,3,4-二-O-甲基吡喃鼠李糖醇乙酸酯,其峰面积分别为9.0%、14.6%、9.5%、8.8%、7.6%、7.5%、8.5%,说明大青叶多糖残基中主要存在-(→1)-、-(1→4)-和-(1→3,6)-(链接的吡喃半乳糖基,-(→1)-、-(1→2)-和-(1→5)-链接的阿拉伯糖基,-(1→2)-链接的吡喃鼠李糖半乳糖基,同时也存在其它比例比较小的糖基和分支。
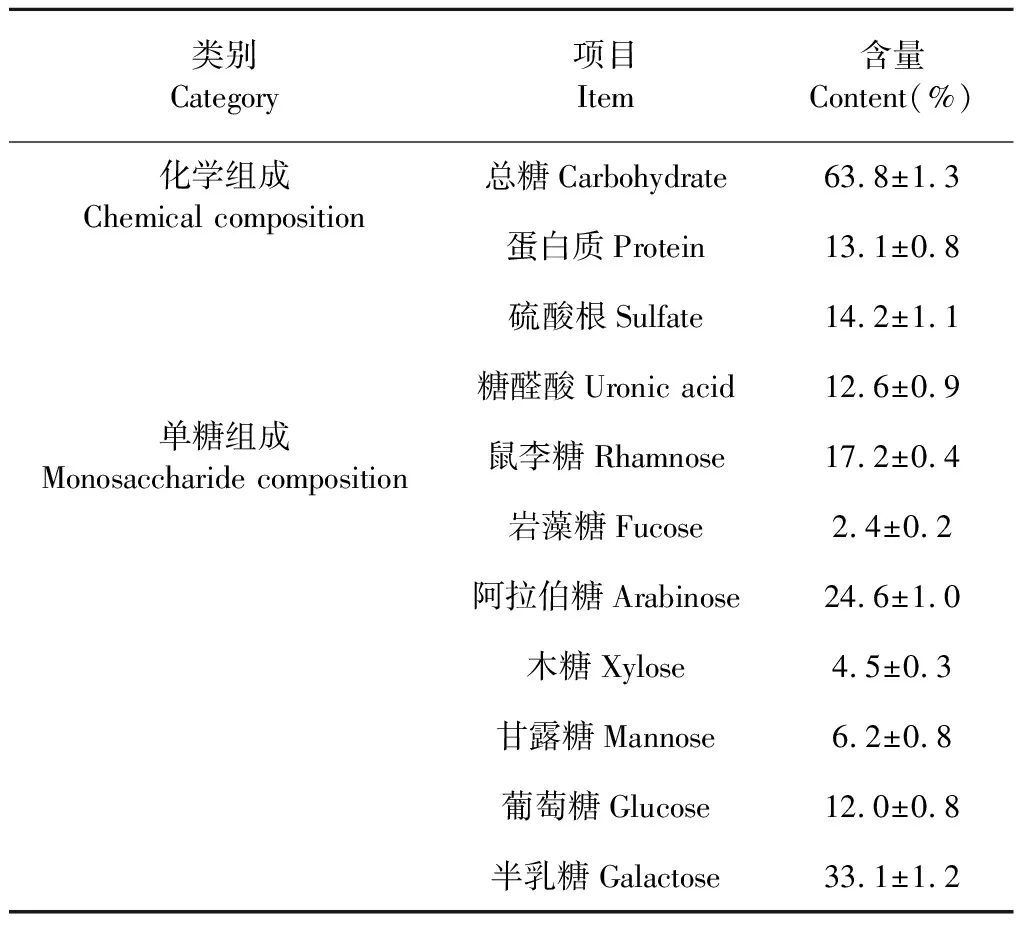
表3 大青叶多糖化学成分和单糖组成
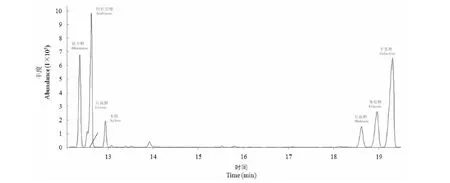
图2 大青叶多糖糖醇乙酸酯衍生物的总离子流色谱图Fig.2 Chromatograms of total ion current spectra for the alditol acetates derivatives of polysaccharide from Folium isatidi
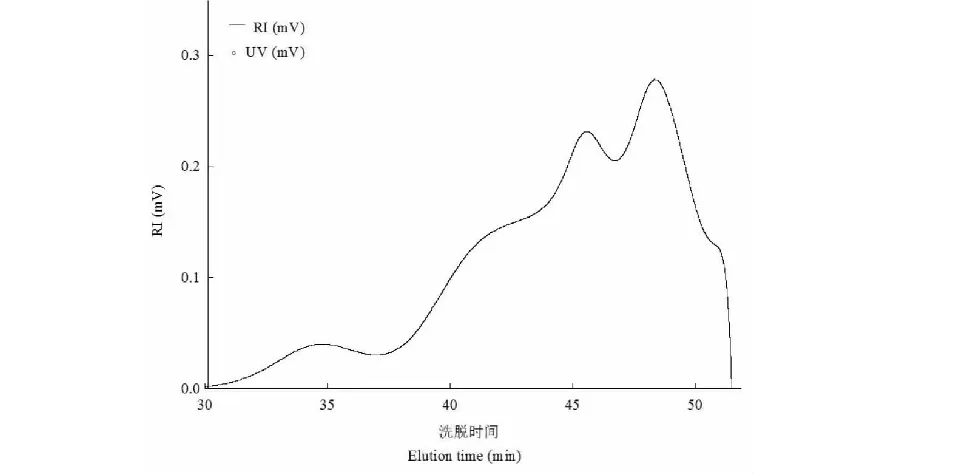
图3 大青叶多糖示差折光检测曲线Fig.3 RI chromatogram of polysaccharide from Folium Isatidi
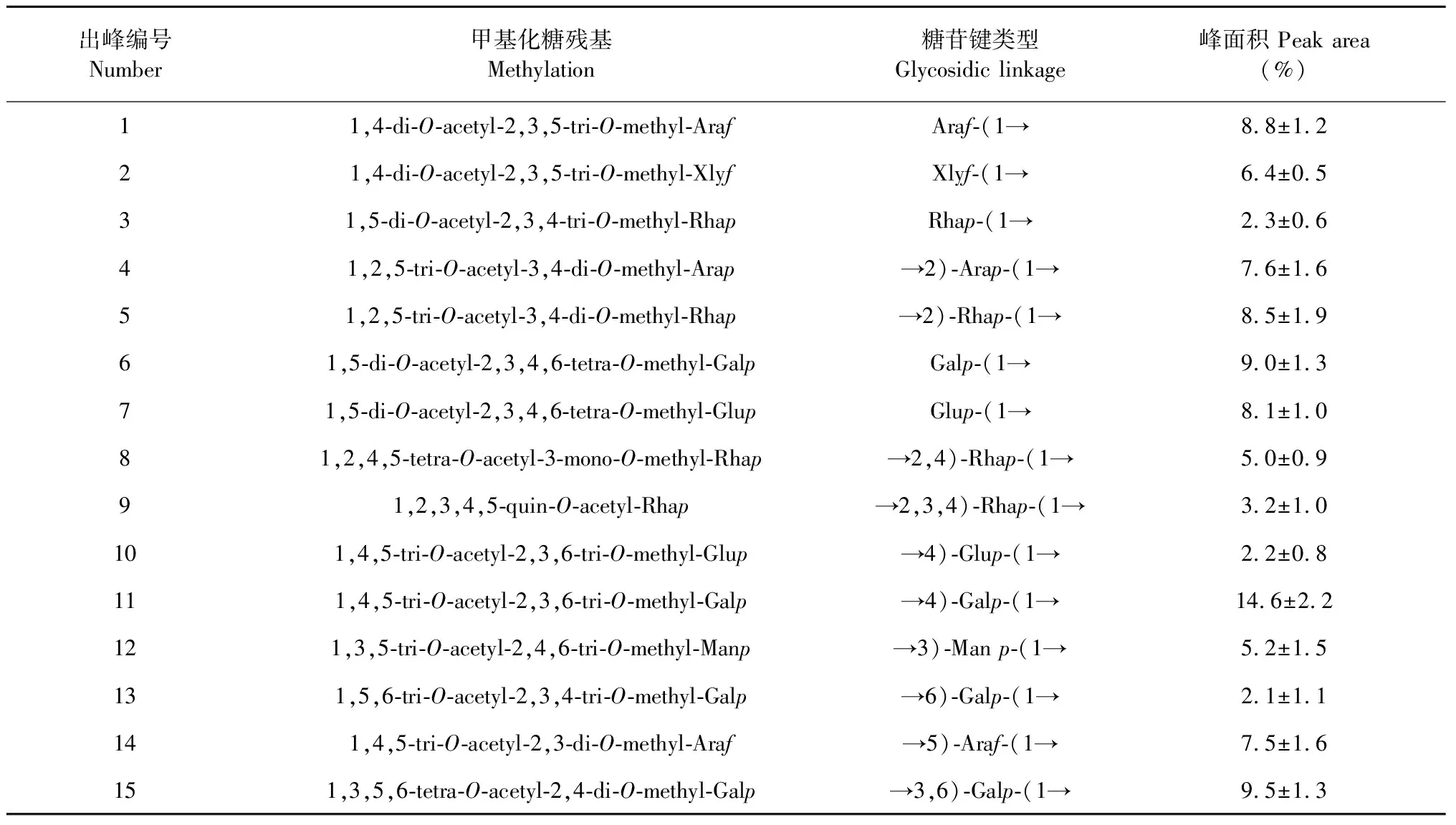
表4 大青叶多糖和还原后大青叶多糖的甲基化分析结果
2.5 大青叶多糖的红外光谱
大青叶多糖的FT-IR图(见图4)给出了大青叶多糖的特征吸收峰,通过FT-IR分析可以确定为多糖化合物[18,19]。位于3 400 cm-1附近宽而强的特征峰是糖分子O-H的伸缩振动引起的,表明大青叶多糖存在分子内的氢键。2 920 cm-1附近的一组峰是糖分子C-H的伸缩振动引起的,1 630 cm-1附近的一组峰是由C=O的伸缩振动引起的,1 420~1 220 cm-1吸收峰是C-H的变角振动,1 100 cm-1附近的吸收峰是C-O-C环内醚中的C-O的伸缩振动和C-O-H的O-H变角振动,在1 250 cm-1附近有强吸收峰,是S=O(硫酸基)的吸收峰[20],表明大青叶多糖中含有硫酸基,这与大青叶多糖中存在14.2%硫酸根的检测结果是吻合的。
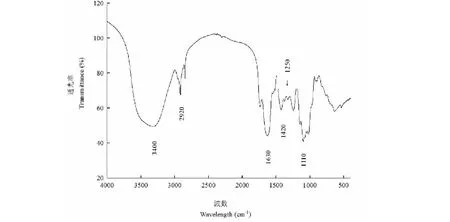
图4 大青叶多糖的FT-IR图Fig.4 FT-IR spectrum of polysaccharide from Folium isatidi
2.6 大青叶多糖的体外生物活性
首先分析大青叶多糖对巨噬细胞RAW264.7增殖能力的影响,大青叶多糖溶液(2、5、10 μg/mL)加入到细胞中培养后用WST-1试剂测定吸光度,同空白组相比得到巨噬细胞相对增殖率,结果见图5。可知当大青叶多糖溶液浓度为2、5、10 μg/mL时细胞增殖率分别为100.52%、101.22%和101.85%,说明在本试验所选定的浓度范围内,大青叶多糖可以促进RAW264.7细胞。大青叶多糖激活RAW264.7产生NO能力结果见图6,大青叶多糖溶液浓度为2、5、10 μg/mL时对应的NO产量分别为32.41、40.57和42.21 μmol/L,呈现剂量依赖关系,2 μg/mL的处理组与另外两个浓度对应的NO产量差异显著(P<0.05)。
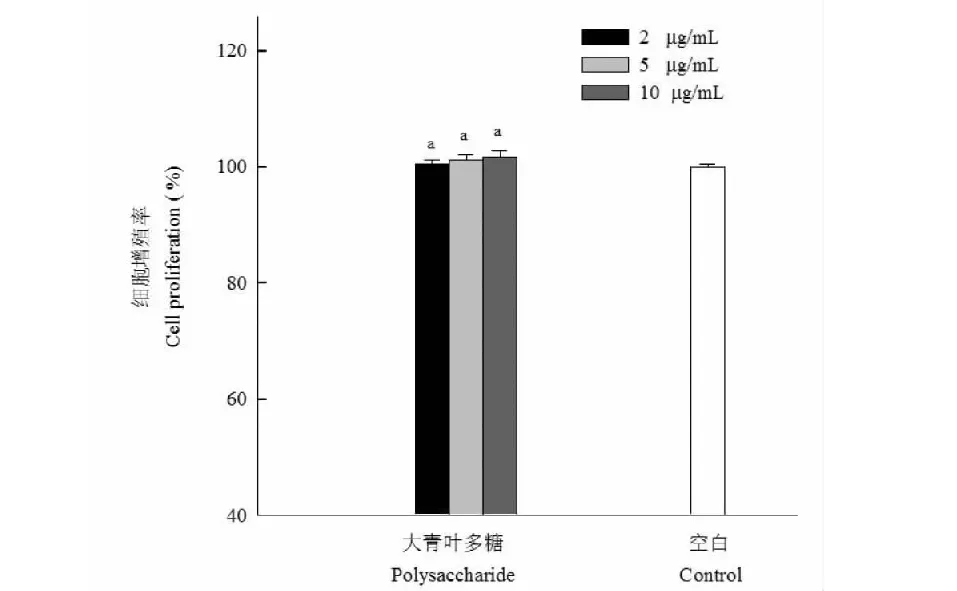
图5 大青叶多糖对巨噬细胞增殖的影响Fig.5 Effect of polysaccharide from Folium isatidi on the proliferation of RAW264.7 cells
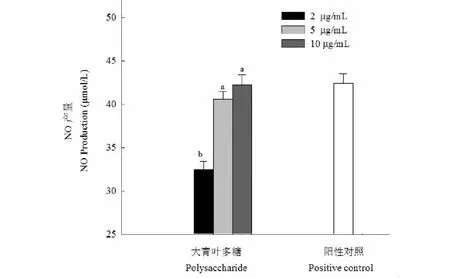
图6 大青叶多糖对RAW246.7细胞中NO产量的影响Fig.6 The amounts of NO produced by RAW264.7 cells treatment with polysaccharide from Folium isatidi
3 结论
利用超声-微波协同水提法可以显著提高大青叶多的得率,提取得到的大青叶多糖中主要成分是总糖,同时还含有一定量的蛋白质、硫酸根和糖醛酸,明确了大青叶多糖的单糖组成和分子量,通过衍生化后分析了大青叶多糖的链接方式。体外生物活性研究表明,大青叶多糖可以促进RAW264.7细胞增殖并产生一氧化氮。本文对大青叶多糖的分子特性和生物活性的研究成果可以为大青叶多糖的研究利用提供理论基础和参考,但对于体内外生物活性和及其机制有待于进一步研究。

