荠菜生长素极性运输基因1(CbPIN1)的克隆与表达分析
刘晓柱,李银凤
(贵州理工学院,贵州 贵阳 550003)
生长素(Auxin)是英国科学家达尔文(Darwin)父子发现的一种植物激素[1]。1928年荷兰科学家温特(Went)将其命名为生长素[2]。生长素在细胞水平调控细胞伸长、分裂与分化[3-6];在植物个体水平,生长素调控器官建构、果实发育、植物衰老等多种生命过程[7-9]。生长素通过极性运输实现在植物体内的差异分布[8]。
PIN家族是目前公认的一种生长素输出载体,细胞膜上呈现极性分布,将生长素由细胞内运输到细胞,因而调节着生长素浓度梯度的动态平衡[10-11]。PIN1、PIN2、PIN3、PIN4 、PIN7 等基因已先后从拟南芥或其他物种中分离出, 并发现这些基因参与调控器官建构、根的伸长、向地性、胚胎发育等过程[12-13]。
荠菜(Capsellabursa-pastoris),十字花科草本植物,营养价值丰富,同时还具有较高的药用价值,属药食同源植物[14]。另外,荠菜还是一种研究果实形态建成的模式植物。前期研究发现,生长素在荠菜心皮发育过程中起重要调控作用,同时生长素极性运输基因PIN3在荠菜果实生长素的侧向运输中起着关键作用[15]。PIN1作为生长素极性运输家族的重要一员,其在荠菜器官发育中的作用还未知。因此,笔者根据GenBank中拟南芥PIN1氨基酸序列,设计同源引物,通过RT-PCR技术,克隆了荠菜PIN1基因编码区cDNA序列,并进行了序列生物信息学分析。同时,分析了PIN1在拟南芥原生质体中的定位以及在荠菜组织中的表达特性。此外,对PIN1蛋白进行了原核表达,还构建了植物过表达载体,获得了转基因植株,为进一步研究PIN1在荠菜器官发育中的作用奠定了基础。
1 材料和方法
1.1 试验材料
供试荠菜品种为野生型荠菜。供试拟南芥品种为Col-0,种子经氯酸钠表面消毒,无菌水冲洗后,铺于MS培养基上,4 ℃春化2 d,生化恒温光照培养箱中培养10 d。将幼苗转移到基质中(营养土∶蛭石=1∶1),生长条件为22 ℃,12 h/12 h光照/黑暗,培养21 d叶片用于制备原生质体。
大肠杆菌DH5α;质粒pSAT6-YFP、pBI121均由湖南农业大学保存,PMD18-T载体购自TaKaRa公司。
甘油、琼脂粉、各种抗生素、MS粉等购自上海生工生物有限公司;植物总RNA提取试剂盒、反转录试剂盒、DNA纯化试剂盒、质粒提取试剂盒、荧光定量PCR试剂盒、各种限制性内切酶、dNTPs、普通/高保真TaqDNA聚合酶、DNA连接酶等购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 荠菜CbPIN1基因的克隆 严格按照试剂盒说明书提取荠菜叶片总RNA,甲醛变性胶电泳与核酸紫外分光光度计法分析检测提取的RNA质量与浓度,然后采用反转录试剂盒将提取的总RNA反转录成cDNA。荠菜PIN1基因克隆引物的设计参考GenBank中拟南芥PIN1基因(NM_106017.4)序列进行(表1)。
将反转录的荠菜cDNA用于PCR反应,反应体系为:1 μL cDNA模板,2.5 μL PCR Buffer(10×),1 μL dNTPs (10 μmol/L),1 μLCbPIN1-C-F (10 μmol/L),1 μLCbPIN1-C-R (10 μmol/L),2 UTaqDNA聚合酶,补水至总体积25 μL。PCR反应程序为: 95 ℃,3 min; 94 ℃,1 min,55 ℃,1 min,72 ℃,2 min,35个循环;72 ℃,10 min。纯化试剂盒纯化PCR产物,连接至T载体后转化至DH5α感受态细胞中,含IPTG和X-gal的氨苄青霉素LB培养基上筛选转化子。试剂盒法小提白色克隆所含质粒,双酶切法检测并送测序进行分析。
1.2.2 荠菜CbPIN1生物信息学分析CbPIN1基因核酸序列同源性采用Blast法进行分析;CbPIN1开放阅读框的查找和翻译、氨基酸序列组成特点以及理化性质分析利用DNAStar软件进行分析;CbPIN1蛋白结构特征采用蛋白质分析系统(http://www.expsy/ch/tools)进行分析;CbPIN1蛋白系统进化树采用ClustalX 1.8与MEGA 5.0软件进行构建。
1.2.3 荠菜CbPIN1亚细胞定位 扩增CbPIN1全长cDNA,PCR纯化产物、pSAT6-YFP载体经XhoⅠ和EcoRⅠ酶切后,进行连接反应,构建35Spro-CbPIN1-YFP重组分子。分离制备拟南芥叶片原生质体,PEG介导法将35Spro-CbPIN1-YFP导入原生质体中进行瞬时表达。激光共聚焦显微镜测定YFP荧光。引物序列见表1。
1.2.4 荠菜CbPIN1组织表达分析 分别提取荠菜根、茎、叶、花、种子部位总RNA并将其反转录成cDNA。β-actin为内参,实时荧光定量PCR(q-PCR)方法分析CbPIN1基因表达水平。采用Roche Lightcycler 480系统扩增CbPIN1基因。扩增体系:2 μL cDNA,0.8 μLCbPIN1-T-F,0.8 μLCbPIN1-T-R,10 μL SYBR Green Mix(2×),补水至总体积20 μL。扩增程序:95 ℃,3 min;95 ℃,10 s,60 ℃,30 s,72 ℃,10 min。CbPIN1相对表达量的分析按照2-ΔΔCt方法进行。
1.2.5 荠菜PIN1蛋白原核表达 扩增CbPIN1全长cDNA,采用Hind Ⅲ和EcoRⅠ酶切PCR纯化产物和pMal-p2X载体,构建重组DNA分子pMal-p2X-CbPIN1。含重组DNA分子的大肠杆菌经 IPTG (1.0 mmol/L)诱导6 h后,SDS-PAGE检测蛋白表达产物。
1.2.6 荠菜转化pBI121-CbPIN1 扩增CbPIN1全长cDNA,Hind Ⅲ和XbaⅠ酶切纯化的PCR产物和载体pBI121,16 ℃过夜连接反应,连接产物转化DH5α感受态细胞,涂布在含卡纳霉素的LB培养基上,挑选抗性克隆,抽提质粒,双酶切检测后送测序。测序正确的重组质粒可用于后续植物转基因研究。引物序列见表1。
构建好的重组载体pBI21-CbPIN1转化至根癌农杆菌GV3101中,菌落PCR检测分析。当野生型荠菜主花序10 cm左右,次花序在莲座开始形成时,剪掉已开花或将要开花的花苞,花絮浸渍法进行荠菜的遗传转化,转化植物培养至种子成熟,收取转基因荠菜种子进行下一步的筛选与检测分析。

表1 所用引物Tab.1 Primers used
注:下划线部分为酶切位点。
Note: The underlined characters were restriction enzyme cutting sites.
2 结果与分析
2.1 荠菜CbPIN1基因的克隆
提取21 d荠菜叶片总RNA并反转录成cDNA,以cDNA为模板,进行RT-PCR反应,经琼脂糖凝胶电泳检测,获得了一条约2 000 bp大小条带(图1)。纯化PCR产物,进行序列测定,最终确定所克隆cDNA全长1 869 bp,C+G含量为49%。Blast比对结果显示,所克隆序列与拟南芥(Arabidopsisthaliana)PIN1高度同源,相似性高达93%,与毛白杨(Populustomentosa)、碎米芥(Cardaminehirsuta)、金鱼草(Antirrhinummajus)等植物中PIN1基因同源性均超过70%。因此,荠菜PIN1基因已被成功克隆,命名为CbPIN1,并提交至GenBank(登录号:JN051352.1)。

M.1 kb plus DNA 分子质量标准;1-2.PCR扩增结果。M.1 kb plus DNA ladder; 1-2. Result of PCR.
2.2 荠菜CbPIN1蛋白结构分析
利用DNAStar软件翻译结果显示,CbPIN1编码的氨基酸个数为622(图2),蛋白分子量为67.05 ku,等电点为9.02。CbPIN1蛋白中包含49个碱性氨基酸(K、R);42个酸性氨基酸(D、E);241个疏水氨基酸(A、I、L、F、W、V);157个极性氨基酸(N、C、Q、S、T、Y)。在拟南芥中,生长素极性运输功能的发挥依赖于PIN组分关键位点的磷酸化修饰。因此,NetPhosBac 1.0 Server 在线预测了CbPIN1蛋白是否存在磷酸化修饰,发现12个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点存在于CbPIN1蛋白中(图3),这暗示磷酸化修饰可能也会影响CbPIN1蛋白功能的发挥。

图2 CbPIN1基因核苷酸序列及推测氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of the CbPIN1
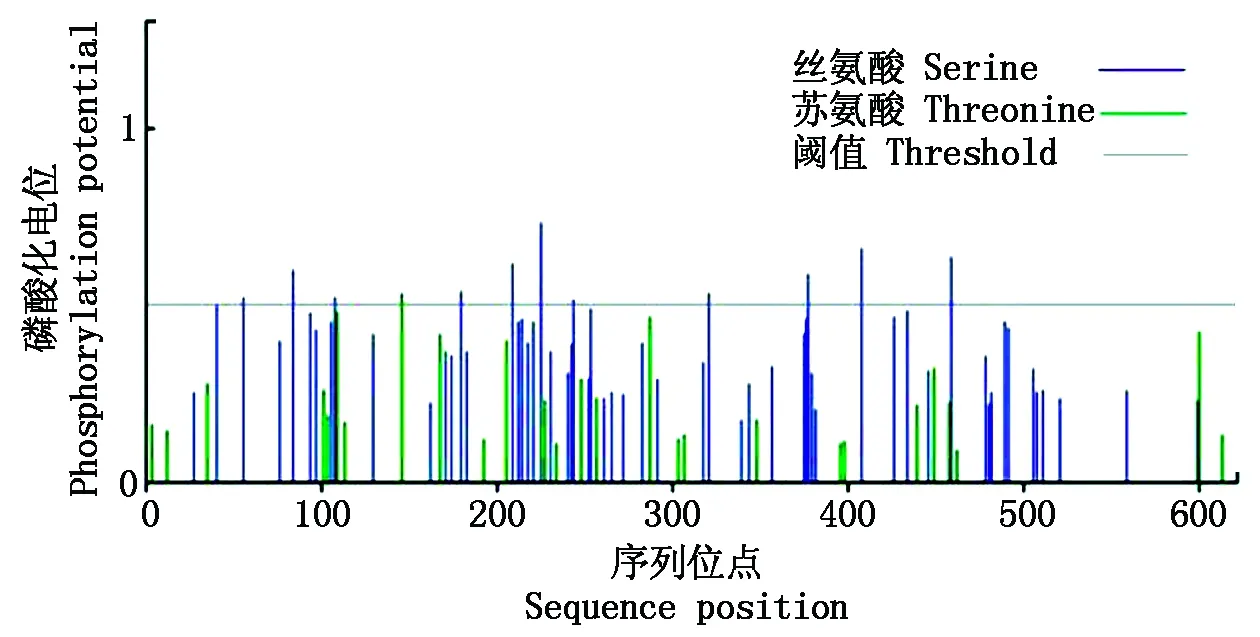
图3 CbPIN1蛋白的磷酸化位点预测Fig.3 Phosphorylation prediction of CbPIN1 protein
蛋白质二级结构在线预测结果表明:CbPIN1蛋白无规卷曲(Random coil(c))为56.91%;β-折叠(Extended strand(e))为25.08%;α-螺旋(Alpha helix (h))为18.01%。ChloroP 1.1 Server预测结果显示,CbPIN1蛋白信号肽切割位点在N端第1-73位氨基酸残基之间,成熟蛋白质为549个氨基酸。TMHMM Server V.2.0 World Wide Web Server预测结果显示,CbPIN1属于跨膜蛋白,N端具有5个跨膜区,C端具有4个跨膜区(图4)。

图4 CbPIN1蛋白跨膜区预测Fig.4 Prediction of transmembrane domain of CbPIN1 protein
2.3 荠菜CbPIN1蛋白系统进化分析
利用MEAG 5.1构建了PIN1系统进化树来分析CbPIN1蛋白的进化关系,发现在亲缘关系上荠菜PIN1与拟南芥PIN1最近,同属于进化树上的一支;与菠萝(Ananascomosus)PIN1(AcPIN1)亲缘关系最远(图5)。
进一步分析表明,荠菜PIN1蛋白与拟南芥PIN1蛋白结构同源性超过90%,二者的N端和C端包含保守的跨膜结构域。此外, CbPIN1与AtPIN1亲缘关系最近,属于进化树上的同一支;与AtPIN2关系也较近;与AtPIN6亲缘关系最远(图6)。
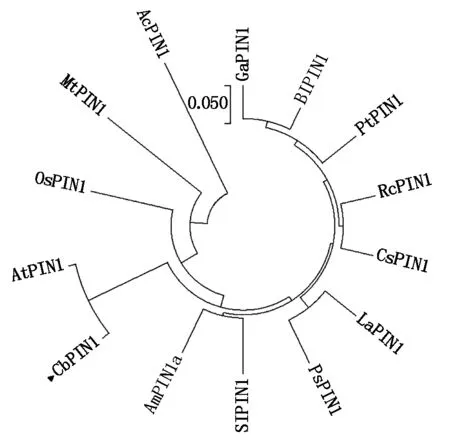
图5 CbPIN1蛋白系统进化分析Fig.5 Phylogenetic analysis between CbPIN1 and other PIN1 proteins
2.4 荠菜CbPIN1亚细胞定位
首先,在线预测了CbPIN1亚细胞定位,结果显示,CbPIN1在细胞膜上进行表达(图7-A)。为进一步证实CbPIN1在细胞中的表达部位,构建了荠菜亚细胞定位载体35Spro-CbPIN1-YFP,PEG介导法将35Spro-CbPIN1-YFP载体转化至拟南芥原生质体细胞中,发现拟南芥原生质体细胞膜上可检测到YFP信号(图 7-B-E),进一步证明CbPIN1 定位于细胞膜。
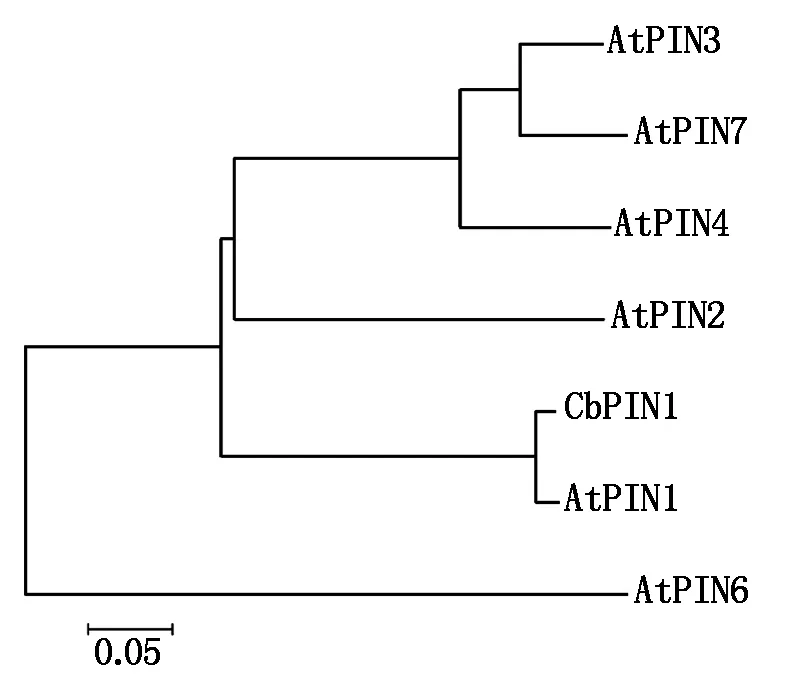
图6 PIN蛋白同源性分析Fig.6 Homologous analysis of PIN protein family

A.在线预测结果;B-E.原生质体瞬时表达结果(Bar=5 μm)。A.Prediction of subcellular location on line;B-E.Result of transient expression in the protoplasts (Bar=5 μm).
2.5 荠菜CbPIN1组织表达分析
为分析CbPIN1基因表达模式,q-PCR方法检测CbPIN1在荠菜不同组织部位的表达情况。结果显示,在荠菜根、茎、叶、花以及种子中CbPIN1基因均进行表达,但其表达量不同(图8)。荠菜根中CbPIN1基因表达量最高,茎、花以及叶、种子中表达量均显著低于根中的表达量。由此推测,CbPIN1可能参与调控荠菜在根、茎和叶的发育过程。
2.6 荠菜CbPIN1原核表达
为进一步分析CbPIN1蛋白表达情况,构建了原核表达载体pET-32a-CbPIN1,转化至大肠杆菌。CbPIN1蛋白推测为67.05 ku。pET-32a载体自身tag序列大概20 ku,则表达出来的蛋白质大小应为87.05 ku。pET-32a-CbPIN1经IPTG诱导,6 h后表达了预期蛋白条带(图9)。
2.7 荠菜过表达CbPIN1基因植株的获得
为进一步研究CbPIN1对荠菜生长发育的影响,构建了植物过表达载体pBI121-CbPIN1。重组载体双酶切反应,经琼脂糖凝胶电泳,可显示出载体与目的基因2个片段,大小均符合预期,表明载体构建成功(图10-A)。

图柱上的不同字母表示不同组间差异显著(P<0.05)。图10同。Different letters above the columns indicated significant differences among the different groups at 0.05 levels.The same as Fig.10.
植物过表达载体pBI121-CbPIN1经根癌农杆菌介导法转化野生型荠菜植株,经卡纳霉素检测与分子检测获得了5株转基因植株(图10-B、C)。荧光定量PCR方法检测其CbPIN1基因表达量,结果显示,过表达植株中CbPIN1 基因表达量显著增加(图10-D)。
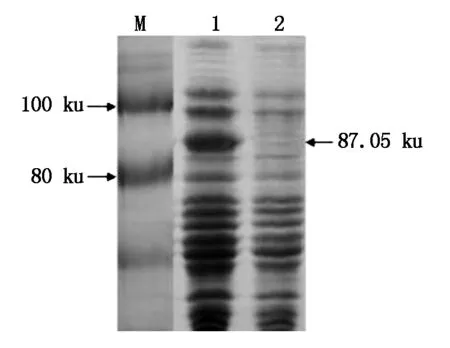
图9 荠菜CbPIN1原核表达Fig.9 Prokaryotic expression of CbPIN1

A.pBI121-CbPIN1载体构建:1.空载体,2-3.重组载体双酶切结果;B.转基因植株卡纳霉素筛选;C.转基因植株分子检测:CK. pBI121-CbPIN1载体,1-5.转基因植株;D.荧光定量PCR检测转CbPIN1基因表达量。
A.Construction of plant expression vector pBI121-CbPIN1: 1.Empty vector, 2-3.Double restriction enzyme digestion of recombinant vector; B.Kanamycin screening of transgenetic seedlings; C.Molecular identification of transgenetic seedlings:CK.Plant expression vector pBI121-CbPIN1, 1-5. Transgenetic seedlings; D.DetectionCbPIN1 expression level using q-PCR method.
图10pBI121-CbPIN1载体构建与荠菜转基因植株的检测
Fig.10ConstructionofplantexpressionvectorpBI121-CbPIN1andtransgeneticseedlingsidentification
3 结论与讨论
生长素作为植物体内的一种重要激素,受到国内外学者的广泛关注,而作为生长素运输载体之一的PIN1,其自然也一直是植物学中研究的一个重点研究领域。在拟南芥、水稻、狗蔷薇、苹果、桑树等多种草本、木本植物中先后均被克隆出来,也做了相应的功能分析,发现均参与生长素的运输过程,调控植物根、果实等器官的发育过程。而荠菜作为一种药食同源的植物,也可作为一种模式植物,但其PIN1基因一直未被克隆,且功能还未知,因此,本研究根据拟南芥PIN1蛋白序列,同源克隆了荠菜PIN1基因编码区cDNA区域,结果发现,荠菜PIN1基因与拟南芥PIN1基因相似性高达93%。实质上,荠菜与拟南芥同属十字花科,二者在遗传背景和生理特性上都较为一致,因此,二者PIN1基因高度相似。另外CbPIN1与碎米芥(Cardaminehirsuta)、金鱼草(Antirrhinummajus)等多种植物PIN1基因同源性也超过70%。说明植物中PIN1基因较为保守,暗示其功能可能较类似。为进一步证明其功能,采用生物信息学的方法分析了CbPIN1蛋白结构特点。发现CbPIN1是一个跨膜蛋白,亚细胞定位结果证实其在细胞膜上表达,这与其可能发挥生长素的运输功能相一致。
Zhang等[16]研究发现,在拟南芥中PIN蛋白在发挥生长素的极性运输载体功能时,需要其特定结构域被磷酸化;Weller等[17]试验结果进一步证实拟南芥特定TPRXS(N/S)模体(Motifs)位点的磷酸化是PIN1发挥生长素极性运输的必要前提。因此,在线分析了CbPIN1磷酸化情况,结果表明,CbPIN1蛋白包含12个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点,这暗示磷酸化修饰可能也会影响CbPIN1蛋白功能的发挥。另外,进一步分析发现CbPIN1磷酸化位点分布特点与其他植物PIN1磷酸化位点分布较为一致。
越来越多的研究结果证实,PIN1在植物根(包括侧根、侧根原基、根尖等部位)的发育中发挥着重要的调控作用[18-20]。通过荠菜PIN1组织表达分析显示,CbPIN1在荠菜根中表达水平最高,这暗示了CbPIN1也可能参与调控荠菜根的生长发育过程。此外,在茎、叶、花等部位CbPIN1也存在表达,但其表达量显著低于根中的表达量,推测其CbPIN1基因可能参与调控这些器官的建构过程。
本研究通过同源克隆的方法获得了CbPIN1 cDNA编码区,生物信息学预测了蛋白结构特点;对CbPIN1进行了基因亚细胞定位、组织表达分析以及原核表达,另外,构建了植物过表达载体,获得了转基因荠菜,结果显示,CbPIN1表达量均显著增加。因此,本研究对荠菜PIN1基因做了初步分析,为进一步研究荠菜PIN1功能奠定了基础,同时也丰富与完善了植物PIN1。

