大豆GmNAC23基因的克隆及特征分析
王 萍,于月华,白玉翠,郭坤鹏,康嘉楠,倪志勇
(新疆农业大学 农学院,新疆 乌鲁木齐 830052)
大豆(Glycinemax(L.) Merr.)是重要的食用蛋白、食用油和饲用蛋白原料,也是我国主要的粮食作物之一。近年来我国大豆的消费增长迅速,主要集中在食用大豆、大豆油、饲用豆粕等方面,且年消费量分别为800,900,3 000多万t。其中大豆油消费量占植物油总消费量的40%以上,饲用豆粕消费量约占国内饲料工业蛋白原料的60%,是肉、蛋、奶中蛋白质的间接来源[1]。为了培育优质高产的大豆品种来提高大豆的品质及产量,深入了解大豆发育和抗逆的分子机制对于该作物产量和品质的遗传改良有重要意义。
目前,已知几种类型的转录因子,如NAC、WRKY、AP2/EREBP、C2H2、MYB等[2-4],它们对植物在非生物胁迫中所受的压力有转录调节的作用。NAC蛋白家族是一个大型植物特异性家族,在大多数植物中具有100~170个成员[5],其特征在于在N末端具有保守的NAC结构域和高度不同的转录激活因子C末端[6]。Souer等[7]于1996年首次在矮牵牛(Petuniahybrida)中克隆出了NAC转录因子基因NAM(NoApicalMeristem)。紧接着Aida等[8]也在拟南芥(Arabidopsisthaliana)中发现了ATAF1/2和CUC2(cup-shapedcotyledon)转录因子基因,进一步研究发现该基因与NAM结构相似。近年来,研究者们发现了许多NAC转录因子,且该类转录因子具有多种多样的生物功能和植物特异性。目前,已在拟南芥、小麦(Triticumaestivum)、水稻(Oryzasativa)、马铃薯(Solanumtuberosum)、玉米(Zeamays)、大麦(Hordeumvulgare)等约20多种植物中发现了NAC基因。因此,NAC家族的转录因子是目前在植物基因组中发现的最大的转录因子家族之一[9]。
如今,在研究者们对大豆NAC基因家族不断深入的研究下,克隆并鉴定了许多大豆NAC类转录因子基因。该家族中许多成员还参与植物非生物和生物胁迫应答,同时也在植物适应外界不良环境过程中发挥着重要作用,表达谱分析结果表明,约20%~25%的NAC转录因子参与了至少一种非生物胁迫应答过程[10],它们在植物生长发育[11-12]、激素调节和抵御逆境[13-14]等方面发挥着重要的作用。例如,Jin等[15]、Quach等[16]研究发现,过表达的GmNAC2基因和过表达的GmNAC004基因分别会导致转基因烟草对干旱、盐和低温敏感并增加拟南芥侧根数量和长度,并且转GmNAC004的拟南芥和野生型拟南芥相比在中度水分胁迫条件下,其侧根数和长度都比野生型高。金杭霞[17]发现,过量表达GmNAC5基因使转基因烟草叶片形态发生改变,可能导致烟草叶片变狭长,GmNAC2基因过量表达使烟草对干旱、高盐和冷害胁迫表现较敏感,烟草幼苗出现矮小,根长较短等现象。刘晓庆等[18]通过对GmNAC8做Western Blot分析发现,GmNAC8与相应的抗体有良好的结合能力,具有特异性。Souer等[7]研究发现,矮牵牛的NAM基因突变体不能正常形成顶端分生组织,此结果说明NAC基因在分生组织的生长发育中起重要作用。韩巧玲等[19]研究表明,GmNAC2a基因可能作为交叉点,不仅参与非生物胁迫响应途径,而且可能参与乙烯相关的生物响应途径。Ni等[20]研究分析了大豆gma-MIR394a基因的功能,发现gma-MIR394a基因在干旱胁迫忍耐中具有正调控功能。刘辉等[21]研究发现,SlNAC80的表达受低温、干旱、高盐和ABA诱导,表明SlNAC80可能通过ABA依赖的途径参与番茄非生物胁迫应答。王国东等[22]发现,PnNAC1响应几种逆境相关信号分子,并参与三七对茄腐镰刀菌和人参链格孢的防卫反应。这些研究表明,NAC是一类具有多种生物学功能的转录因子。
大豆基因组由152个编码NAC转录因子的基因组成[23],目前,已经有许多大豆NAC基因被克隆和分析,同时也鉴定出了一些大豆NAC基因的功能。这些研究对深入探索大豆的生长发育情况及其对逆境胁迫响应的分子机制有着非常重要的意义。本研究从大豆中克隆了1个NAC转录因子基因,命名为GmNAC23,并对其进行了系统进化树、组织特异性表达模式及转录激活功能分析,旨在为进一步研究该基因的生物学功能奠定试验基础。
1 材料和方法
1.1 材料和试剂
大豆栽培品种为Williams 82,由中国农业科学院作物科学研究所作物种质资源中心抗逆研究课题组所提供。将其在温室中水培25 d后,取叶片组织,液氮速冻,并保存于-80 ℃冰箱备用;DL2000 Marker购自北京天根生化公司;TaqDNA聚合酶、大肠杆菌菌株(E.coli)DH5α感受态细胞购于北京全式金生物有限公司;卡那霉素(Kan)、限制性内切酶SalⅠ、BamH Ⅰ、T4DNA连接酶购于Fermentas公司;引物合成于北京鼎国昌盛生物技术有限责任公司;酵母 YPDA 培养基粉末、酵母单缺培养基粉末SD(Trp-)、酵母三缺培养基粉末SD(Trp-/His-/Ade-)购于北京泛基诺生物有限公司;ONPG购于北京全式金生物有限公司。
1.2 试验方法
1.2.1 大豆叶片RNA的提取与cDNA的合成 将保存于-80 ℃冰箱的大豆叶片经液氮研磨后,使用TRIzol试剂盒(Invitrogen)提取叶片组织总RNA,并用1%琼脂糖凝胶电泳检测所提取的RNA,电泳检测成功后使用反转录试剂盒First strand cDNA Synthesis (Thermo Fisher)的说明书,将提取的大豆叶片总RNA反转录合成cDNA。
1.2.2GmNAC23基因全长序列的获得及克隆 本试验根据数据库(http:∥www.phytozome.net/soybean.php)中大豆基因组数据的Glyma05g00930.1基因序列,设计了1对引物,nGmNAC23-F: 5′-CAA TAAAGAGTTTTGTTGAAATGGAA-3′和nGmNAC23-R: 5′-ACTTTTAGTAATTCCACAAACCATCA-3′,以合成的大豆叶片cDNA为模板,采用PCR的方法扩增GmNAC23基因的开放阅读框(ORF)。PCR程序为:94 ℃ 5 min;94℃ 30 s,64℃ 30 s,72 ℃ 1 min( 35个循环);72 ℃ 10 min。将扩增后的PCR产物置1%琼脂糖凝胶电泳,用紫外凝胶成像仪(Bio-Rad)观察结果。检测合格后将纯化的PCR产物连接到克隆载体pJET1.2 (Thermo Fisher)中,转化大肠杆菌挑选阳性克隆送上海美季公司测序。
1.2.3GmNAC23序列的生物信息学分析 利用生物信息学相关软件对GmNAC23序列进行分析,从GenBank上下载其他物种的氨基酸序列进行同源性分析,用DNAMAN软件进行多重序列比较,选取其他NAC基因的不同物种,如绿豆、鹰嘴豆、木豆、蒺藜苜蓿、木薯的NAC类基因,用MEGA 4.1软件构建这些物种的系统发生树。用Protparam(http://www. expasy.org/tools/protparam)在线工具,分析预测GmNAC23蛋白的分子质量、等电点及其理化性质;利用Predictprotein(https://open.predictprotein.org/)对氨基酸的二级结构进行预测;利用ExPASy(http://web. expasy.org/)对氨基酸的三级结构进行预测;利用 Phytozome V 10.3在线数据库对GmNAC23基因的组织特异性表达模式进行分析,并发现了GmNAC23基因在染色体上的定位。

图1 大豆GmNAC23蛋白与其他植物NAC蛋白的同源性比对(A)及其结构域预测(B)Fig.1 Homology comparison of soybean GmNAC23 protein with other plant NAC proteins (A) and its domain prediction (B)
1.2.4GmNAC23酵母表达载体的构建 根据大豆GmNAC23基因序列,设计带有EcoRⅠ和BamHⅠ酶切位点的引物用PCR方法扩增GmNAC23的ORF序列,引物序列为,23-F: 5′-ATTGAATTCATGGAA AACGTTCCGGCGGTG-3′和23-R: 5′-TTAGGATCCTTAGTAATTCCACAAACCATCAAGATCCAATG-3′,(引物中划线部分表示酶切位点)。胶回收带有酶切位点GmNAC23的ORF序列,经过双酶切,将酶切产物进行纯化后,与相同酶切的pGBKT7载体连接,转化大肠杆菌(E.coli)DH5α感受态细胞,挑选阳性克隆,通过菌液PCR和测序(上海美季)对重组质粒进行检测。
1.2.5 GmNAC23转录激活活性分析 酵母体内转录激活试验参照Yu等[24]方法。利用ONPG方法测定酵母菌株AH109中不同转化体β-半乳糖苷酶活性,参照李叶云等[25]方法。
2 结果与分析
2.1 GmNAC23基因的克隆及序列分析
本研究以大豆叶片cDNA为模板,利用RT-PCR的方法获得了一段长为1 077 bp的核苷酸序列,并将其命名为GmNAC23。GmNAC23编码区长1 053 bp,编码350个氨基酸,通过软件预测其分子量为39.483 ku,等电点为7.08。GmNAC23基因组DNA由3个外显子和2个内含子组成,长度为 1 778 bp。预测氨基酸序列如图1,发现GmNAC23中含有1个NAM结构域,该结构域位于第16-166个氨基酸,并且在GmNAC23的第188-202个氨基酸存在1个低复杂组成区域,此区域由LGSSALPPLSDSSPS氨基酸组成(图1)。
将利用NCBI搜索得到的绿豆、鹰嘴豆、木豆、蒺藜苜蓿、木薯的氨基酸序列与GmNAC23的氨基酸序列进行多序列比对并作系统进化树分析,发现GmNAC23与绿豆VrNAC(Vignaradiata,XP_ 014507026)和木豆CaNAC(Cajanuscajan,XP_020227105)的亲缘关系较近,氨基酸一致性分别为88%和84%,且GmNAC23与木豆CaNAC聚在一个分支(图2)。
2.2 GmNAC23蛋白质序列分析
利用蛋白质亚细胞定位预测网站 (http://www.psort.org/)对GmNAC23的亚细胞定位进行预测分析, 结果显示, GmNAC23与其转录因子的特征一致定位于细胞核中第5号染色体Chr05:2217936..2219956(reverse)上。利用在线软件(https://open.predictprotein.org/)预测GmNAC23蛋白质的二级结构(图3)。通过SWISS-Model(http://swissmodel.expasy.org/)对GmNAC23蛋白质的三级结构进行预测,得到了该蛋白质的三级结构(图4)。

图2 GmNAC23蛋白与其他NAC蛋白系统进化树分析Fig.2 Phylogenetic tree analysis of GmNAC23 protein and other NAC protein systems
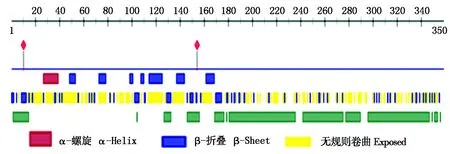
图3 大豆GmNAC23蛋白的二级结构预测Fig.3 Secondary structure prediction of soybean GmNAC23 protein
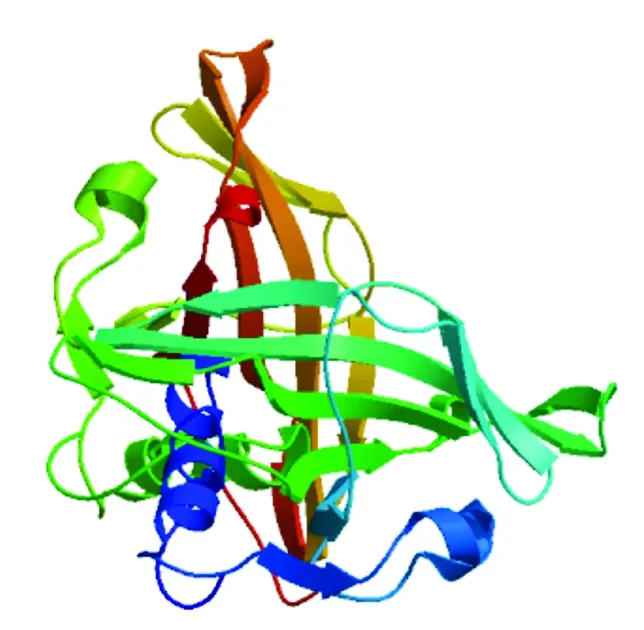
图4 大豆GmNAC23蛋白三级结构预测Fig.4 Prediction of the tertiary structure of soybean GmNAC23 protein
2.3 GmNAC23基因的组织特异性表达分析
本研究为了探索GmNAC23基因的组织特异性表达情况,利用Phytozome V 10.3数据库搜索获得了GmNAC23基因在大豆不同组织中的组织特异性表达数据,结果发现,在大豆的不同组织中GmNAC23基因均有表达,并且表达量存在差异。根据数据库中的FPKM值,发现GmNAC23基因在根中表达量最多,达到67.492。GmNAC23基因在茎顶端分生组织中表达量最小,为0.230(表1)。以上结果表明,在大豆不同组织的发育过程中均有GmNAC23基因的参与,且GmNAC23基因对大豆不同组织的生长发育起到一定的调控作用。
2.4 GmNAC23的转录激活功能分析
将扩增得到的GmNAC23与pGBKT7连接构建酵母表达载体,转化酵母菌株AH109,pGBKT7 空载体作为对照同时转化酵母菌株, 将稀释过的菌液分别点在单缺和三缺的平板上,30 ℃培养2 d。观察酵母菌落的生长情况,其结果是转化体pGBKT7和GmNAC23-pGBKT7在酵母单缺SD(Trp-)营养型缺陷培养基上均能正常生长,说明这2个质粒均已成功转化到酵母中。而转化GmNAC23-pGBKT7的酵母转化体能在三缺SD (Trp-/His-/Ade-)营养型缺陷培养基上正常生长,对照pGBKT7的酵母转化体不能在三缺SD (Trp-/His-/Ade-)营养型缺陷培养基上正常生长。以上试验结果说明,GmNAC23具有一定的转录激活功能,并且其转录激活功能较强(图5-A)。

表1 大豆GmNAC23基因的组织特异性表达Tab.1 Tissue-specific expression of soybean GmNAC23 gene

A.GmNAC23在酵母中的转录激活功能分析; B.GmNAC23转录因子β-半乳糖苷酶活性分析。A.Analysis of transcriptional activation function of GmNAC23 in yeast; B.Analysis of β-galactosidase activity of GmNAC23 transcription factor.
对GmNAC23的转录激活功能进行了定性分析后,本研究进一步对pGBKT7和GmNAC23-pGBKT7的转录激活活性进行了定量分析,分析了酵母菌株AH109中pGBKT7和GmNAC23-pGBKT7转化体β-半乳糖苷酶的活性,结果发现,GmNAC23-pGBKT7转化体表现出较高的β-半乳糖苷酶活性,而对照pGBKT7转化体表现出较低的β-半乳糖苷酶活性。结果进一步说明GmNAC23转录因子具有较强的转录激活功能(图5-B)。
3 结论与讨论
NAC转录因子是参与植物的许多调控和发育过程以及植物应激反应的一类转录因子,构成了一个大的植物特异性家族,由N端保守的DNA结合区域和C端的转录激活区域组成的,NAC也是植物特有的一个转录因子家族。邹嘉欣等[26]通过生物信息学分析发现,NAC家族基因分布广,结构多为个3个外显子,1个拥有两端保守基序的NAM结构域位于2个相邻外显子上。本研究从大豆中克隆得到了1个命名为GmNAC23的NAC转录因子,其具有1个NAM保守结构域,此结构域位于第16-166个氨基酸。经过分析发现,GmNAC23转录因子具有3个外显子和2个内含子,Meng等[27]研究发现,GmNAC1-GmNAC6都含有2个内含子,表明这些GmNAC具有保守的基因组结构。
NAC蛋白构成一个大的家族,其每个家族成员在植物发育中扮演不同的角色,NAC转录因子基因属于编码植物中重要调节蛋白的大家族基因。李伟等[28]通过聚类分析发现,19个生物学功能已知的NAC转录因子在同一分支的具有相似的生物学功能。本研究通过对NCBI搜索得到的绿豆、鹰嘴豆、木豆、蒺藜苜蓿、木薯的氨基酸序列与GmNAC23的氨基酸序列进行多序列比对并作系统进化树分析,发现绿豆(88%)和木豆(84%)与其进化关系最近,氨基酸一致性达到88%和84%,并且其具有相似的生物学功能。
前人经过研究发现,许多大豆NAC家族成员基因具有转录激活的功能。Tran等[29]对31个GmNAC转录因子进行酵母单杂实验,发现其中28个都具有转录激活活性。这些研究说明大豆NAC家族蛋白可能具有不同的转录调控机制。本研究预测GmNAC23亚细胞定位发现其定位于细胞核中第5号染色体上,并对GmNAC23的转录激活功能进行了定性和定量分析,结果发现GmNAC23具有较强的转录激活功能。这与NAC蛋白具有转录激活活性的传统认知相符合[30-32]。以上研究结果为下一步分析转录激活区的定位提供了依据。
大豆基因组中含有 152 个编码NAC转录因子的基因,这些NAC基因呈现的表达模式各不相同。孟庆长[33]从大豆中克隆了6个编码NAC同源蛋白的基因序列GmNAC1~GmNAC6,组织表达分析表明GmNAC4和GmNAC6为组成性表达。其他4个基因的表达具有不同的表达模式。本研究利用在线软件探索GmNAC23基因的组织特异性表达情况,发现在大豆不同组织的发育过程中均有GmNAC23基因的参与,且GmNAC23基因对大豆不同组织的生长发育起到一定的调控作用。
本研究利用RT-PCR的方法从大豆中克隆1个NAC基因GmNAC23。序列分析表明,GmNAC23基因组包含3个外显子和2个内含子。多序列比对结果表明,GmNAC23蛋白含有1个高度保守的NAM结构域。转录活性分析结果表明,GmNAC23具有转录激活功能。组织特异性表达模式分析表明,在检测的所有组织中GmNAC23都有表达,在根中表达量最高,在茎顶端分生组织中表达量最低。本研究为进一步分析大豆GmNAC23的生物学功能提供实验基础。

