2型糖尿病合并急性胰腺炎大鼠肠道菌群变化及其与胰腺炎病情进展的关系
张荣芳,吴敏娜,张静,倪军,王永磊,霍剑锋
(1中国人民解放军第三七一医院,河南新乡 453000;2新乡医学院基础医学院)
2型糖尿病(T2DM)患者长期处于高血糖状态,其机体免疫功能低下,内环境紊乱,容易引发肠源性感染,而糖尿病并发急性胰腺炎(AP)就是其中之一[1,2]。美国有一项回顾性研究指出,糖尿患者患AP的几率是普通人群的1.86~2.89倍[3],病死率也远高于普通人,糖尿病合并AP患者的发病率为54/10万人年[4],究其原因主要是肠道黏膜屏障破坏和肠道通透性增加[5]。目前,相关研究以T2DM合并AP患者病例特点分析为主,而肠道菌群结构变化方面研究甚少。本研究检测了T2DM合并AP大鼠肠道菌群结构变化,并分析其与AP病情进展的相关性。
1 材料与方法
1.1 实验动物 T2DM大鼠38只,Wistar健康大鼠33只,体质量180 g左右,8~10周龄。饲养在室温25 ℃左右的动物房内,内置专用鼠笼,相对湿度40%~70%,实验动物饲养和处理都按照动物福利和伦理原则执行。
1.2 主要试剂及仪器 牛磺胆酸钠(Sigma公司),TIANamp Stool DNA Kit(北京天根生化科技有限公司),大肠埃希菌和双歧杆菌引物(上海生物工程科技有限公司),琼脂糖(Sigma公司),琼脂糖凝胶DNA回收试剂盒(DP209,上海生物工程科技有限公司),溴乙锭(北京鼎国昌盛生物科技有限责任公司),DM3000DNA Marker (上海生物工程科技有限公司),质粒提取试剂盒(上海生物工程科技有限公司),a-淀粉酶测定试剂盒(EPS法,广州兆康生物科技有限公司),脂肪酶测定试剂盒(速率法,广州兆康生物科技有限公司),血糖测定试剂盒(葡萄糖氧化酶法,广州兆康生物科技有限公司);Nano Drop2000紫外分光光度计(美国Termo公司),-80 ℃低温冰箱(美国Termo公司),荧光定量Light Cycler PCR仪(美国Bio-Rad公司),EC3凝胶成像系统(美国UVP公司),常温离心机Labofuge400(美国Thermo公司),琼脂糖电泳仪DYCP-31DN(北京六一),紫外分析仪(上海骥辉科学分析仪器有限公司),电子天平(上海丽驰计量仪器有限公司),酶标仪(美国热电),全自动生化分析仪(美国雅培)。
1.3 实验动物分组及T2DM合并AP模型制备 大鼠于术前12 h禁食,自由饮水。38只T2DM大鼠随机挑选20只,腹腔注射戊巴比妥溶液(2 mg/100 g体质量)麻醉,用3.5%牛黄胆酸钠(1 mL/kg体质量)以0.2 mL/min的速度沿胰胆管逆行注射构建T2DM合并AP模型(A组);余下18只作为糖尿病组(C组),以同样的剂量和同等的速度注射生理盐水。33只Wistar大鼠随机挑选15只腹腔注射戊巴比妥溶液(2 mg/100 g体质量)麻醉,用3.5%牛黄胆酸钠(1 mL/kg体质量)以0.2 mL/min的速度沿胰胆管逆行注射构建单纯AP模型(B组)[6];剩余的18只作为正常对照组(D组),以同样的剂量和同等的速度注射生理盐水。动物模型制备成功标准:注射3.5%的牛黄胆酸钠24 h内,B组和A组大鼠出现明显的AP症状,即大鼠呈现焦虑、烦躁,并伴有呕吐现象;大鼠胰腺组织切片显示组织水肿、出血,组织结构边界不明显,组织浸润现象严重。动物模型纳入标准:①采用全自动生化分析仪检测血清胰淀粉酶和脂肪酶活性较给药前升高3倍以上;②光镜下采用改良的schmidt法对胰腺组织进行病理学评分达标。动物模型剔除标准:①给药过程中死亡,或给药后迅速死亡;②胰淀粉酶测试低于3倍;③病理切片评分未达标。
1.4 大鼠粪便总细菌、大肠埃希菌、双歧杆菌丰度检测 分别收集各组大鼠给3.5%牛黄胆酸钠或生理盐水前(0 h)及24、48 h的粪便样品1~2 g,提取粪便细菌基因组总DNA,利用16S rRNA V3区通用引物(341F/518R)和功能菌群特异性引物(大肠埃希菌和双歧杆菌),通过实时荧光定量PCR检测总细菌、大肠埃希菌、双歧杆菌的丰度,最终结果以细菌拷贝数的常用对数/g粪便表示。
1.5 大鼠血清淀粉酶、脂肪酶检测 分别采集各组大鼠给3.5%牛黄胆酸钠或生理盐水前(0 h)及24、48 h的静脉血2 mL,1 000 g离心10 min,后取血清,分装于无菌EP管内,采用全自动生化分析仪检测血清淀粉酶和脂肪酶。
1.6 胰腺组织病理学评估 于给3.5%牛黄胆酸钠或生理盐水前(0 h)及24、48 h,采用断头法处死大鼠,取胰头组织,用100 mL/L甲醛溶液固定,常规脱水,包埋,切片,HE染色,由两位病理学医师分别对胰腺组织进行双盲评分。胰腺损伤分别以Schmidt[7]标准进行评分。
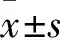
2 结果
2.1 各组粪便总细菌、大肠埃希菌、双歧杆菌丰度比较 结果见表1。

表1 各组粪便总细菌、大肠埃希菌、双歧杆菌丰度比较(细菌拷贝数的常用对数/g粪便,
注:与C组比较,△P<0.05;与D组比较,*P<0.05;与同组0 h比较,▲P<0.05;与同组24 h比较,#P<0.05。
2.2 各组血清淀粉酶、脂肪酶比较 结果见表2。

表2 各组血清淀粉酶、脂肪酶比较
注:与C组比较,△P<0.05;与D组比较,*P<0.05;与同组0 h比较,▲P<0.05;与同组24 h比较,#P<0.05。
2.3 各组胰腺组织病理学评分比较 结果见表3。

表3 各组胰腺组织病理学评分比较(分,
注:与C组比较,△P<0.05;与D组比较,*P<0.05;与同组0 h比较,▲P<0.05;与同组24 h比较,#P<0.05。
2.4 A组和B组大肠埃希菌、双歧杆菌丰度变化与病理评分的相关性 A组和B组大肠埃希菌变化趋势与病理学评分呈正相关(r=0.738,P<0.05),双歧杆菌的变化趋势与病理学评分呈负相关(r=-0.875,P<0.05),详见图1。
3 讨论
T2DM属于慢性代谢性疾病[8],合理有效的控制血糖,病死率可以降低到接近为零[9]。但是由于糖尿病患者抵抗力较健康人有明显的下降,极易产生各种并发症。美国糖尿病协会的一项回顾性研究分析指出,T2DM患者得AP的风险是普通人群的1.86~2.89倍[10]。大量T2DM合并急性应急损伤的患者给临床治疗带来很多困扰[11],也增加了糖尿病患者的临床死亡风险和经济负担[12]。为方便对其中机制展开更为深入的研究,合理的动物模型的建立便具有很大的必要性。我们通过注射3.5%牛黄胆酸钠促进Wistar大鼠发生AP,以此构建普通大鼠AP模型[13],同时在T2DM大鼠已患糖尿病的基础上诱导AP,构建糖尿病合并AP模型。实验结果表明,模型构建方式是成功的,两种大鼠均出现了AP的症状,且非常典型,病理切片中炎症浸润现象严重,血清淀粉酶和脂肪酶水平显著上升。
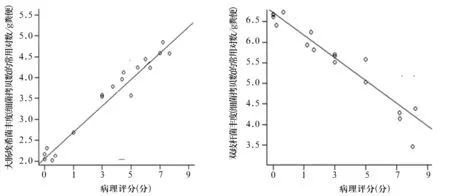
图1 大肠埃希菌、双歧杆菌丰度变化与病理评分的相关性
大量研究表明,双歧杆菌、乳酸杆菌等属于肠道益生菌,可以预防和缓解肠道炎症反应、阻止病原微生物的侵入机体和过度繁殖,同时分泌短链脂肪酸等对机体健康产生有益影响的功能[14];而大肠埃希菌数量增多可导致大量革兰氏阴性菌的脂多糖(LPS)入血,而LPS与TLR4结合可促发机体低度慢性炎症反应,最终导致胰岛素抵抗和其它代谢障碍[15]。也有研究[16,17]报道,补充益生菌能明显降低病患者的内毒素血症,可有效恢复肠道内的细菌定植。因此大肠埃希菌丰度增多可能是糖尿病发生胰腺损伤更严重的直接原因之一。本研究显示,与C组比较,A组24、48 h双歧杆菌丰度降低,24、48 h大肠埃希菌丰度升高;与D组比较,B组24、48 h双歧杆菌丰度降低,24、48 h大肠埃希菌丰度升高;与同组0 h比较,A组和B组24 h大肠埃希菌丰度升高,双歧杆菌丰度降低;与同组24 h比较,A组和B组48 h大肠埃希菌丰度升高,双歧杆菌丰度降低。这说明大肠埃希菌和双歧杆菌细菌丰度的变化参与了糖尿病并发AP的发生发展。本研究还显示,与C组比较,A组24、48 h血清淀粉酶和脂肪酶水平升高;与D组比较,B组24、48 h血清淀粉酶和脂肪酶水平升高;与同组0 h比较,A组和B组24 h血清淀粉酶和脂肪酶水平升高;与同组24 h比较,A组和B组48 h血清淀粉酶和脂肪酶水平升高。与C组比较,A组24、48 h病理学评分增加;与D组比较,B组24、48 h病理学评分增加;与同组0 h比较,A组和B组24 h病理学评分增加;与同组24 h比较,A组和B组48 h病理学评分增加。提示肠道菌群结构的改变加重了大鼠的炎症反应,而炎症反应的存在又加剧了肠道菌群的失衡,因此产生了恶性循环。本文结果显示,B组和A组的大肠埃希菌变化趋势与病理学评分呈直线正相关,双歧杆菌的变化趋势和病理学评分呈直线负相关。提示早期AP肠道菌群的紊乱可能是糖尿病并发急性胰腺损伤的始动因素之一。
总之,T2DM合并AP大鼠肠道菌群结构发生改变,其中大肠埃希菌和双歧杆菌的丰度与AP的严重程度相关。相信随着分子生物学技术的发展以及人们对肠道微生态研究的深入[18,19],我们终将完全掌握糖尿病并发AP肠道菌群的变化,为选择AP的最佳治疗方案提供有力的证据,从而降低糖尿病患者患胰腺炎的风险,减少致病病死率,改善AP整体预后。

